KRAS - תשנית בגן - KRAS mutation
הופניתם מהדף KRAS - מוטציה בגן - KRAS mutation לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| KRAS - תשנית בגן | |
|---|---|
| KRAS mutation | |
| מעבדה | ביולוגיה מולקולרית, פתולוגיה. |
| תחום | סרטן המעי הגס, סרטן ריאות, סרטן הלבלב. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
סמנים פרוגנוסטיים לחולים בסוגי סרטן אחדים, המטופלים בתכשירים המכוונים כנגד epidermal growth factor receptor.
הגן KRAS ממוקם על הזרוע הקצרה של כרומוזום 12 באתר 12.1. הגן KRAS מקודד לחלבון K-Ras שהוא רכיב במסלול התאי RAS/MAPK, וחלבון זה משגר איתותים מחוץ לתא לגרעין התא. איתותים אלה מסייעים לתא להתחלק ולשגשג, או להגיע לבשלות ולהתמיינות למילוי תפקידיו השונים. החלבון K-Ras פועל כ-GTPase ומסב GTP ל-GDP. על מנת לשגר איתותים, K-Ras מופעל על ידי קישור למולקולה של של GTP, ושיכוך פעילותו מתרחש כאשר הוא מסב מולקולת GTP ל-GDP. השם KRAS נקבע כיוון שהוא התגלה במקור כאונקוגן של הנגיף Kirsten RAt Sarcoma (על פי Tsuchida וחב' ב-Science משנת 1982), והגן KRAS הוא למעשה פרוטו-אונקוגן בהיותו נובע מהגנום התאי.
אמפליפיקציה של KRAS
הגן KRAS יכול להיות מוגבר בסרטן המעי הגס, על ידי תשניות (מוטציות). גידולים או שורות תאים בהם קיימת תשנית גנטית אינם מגיבים לטיפול עם מעכבים של EGFR. אף על פי שאמפליפיקציה של KRAS הוא תרחיש לא תדיר בסרטן המעי הגס, הוא עשוי להיות אחראי למניעת תגובה לטיפול אנטי-EGFR במטופלים אחדים (Valtorta וחב' ב-Int J Cancer משנת 2013). אמפליפיקציה של wild-type Kras נצפתה בסרטן השחלות, הקיבה, הרחם, והריאות (Sankaranarayanan וחב' ב-PLos ONE משנת 2015, ו- Chen וחב' ב-PLos ONE משנת 2014).
נתונים שונים הכוללים את סטאטוס המוטציות וביטוי גני לא היו בעלי עוצמה פרוגנוסטית משמעותית (Nagy וחב' ב-Int J Cancer משנת 2017). לא נמצא כל מתאם להישרדות ב-72% מכל המחקרים שכללו ריצוף של KRAS שבוצעו ב-NSCLC. עם זאת, מוטציות KRAS יכולות לא רק להשפיע על הגן עצמו והביטוי של החלבון המודד על ידי גן זה, אלא גם יכולות להשפיע על הביטוי של גנים אחרים downstream המעורבים במסלולים קריטיים המווסתים את שגשוגם של תאים, ההתמיינות של תאים אלה, ותרחיש האפּופּטוזיס. הביטוי שונה של גנים אלה בגידולים עם KRAS מוטנטי הם כנראה בעלי תפקיד חשוב יותר בהשפעה על התוצאים הקליניים של המטופל. מחקר של Guo וחב' שהתפרסם ב-Cancer Res משנת 2008, קבע שהזרקת oncrasin-1 דיכאה ביותר מ-70% את גידולם של תאי xenograft של סרטן ריאות אנושי עם מוטציית KRAS, והאריכה את הישרדותם של עכברי nude הנושאים גידולים אלה, מה שהצביע על כך ש-oncrasin-1 ואנלוגים פעילים שלו עשויים לשמש תכשירים אנטי-סרטניים חדשים, המסוגלים להרוג תאי סרט עם מוטציית KRAS.
סרטן ריאות
היותו של מטופל חיובי או שלילי לתשנית (מוטציה) ב-EFGR, תנבא כיצד יגיב המטופל לתרפיה עם אנטגוניסטים של EFGR כגון erlotinib (שם מותג Tarceva) או gefitinib (שם מותג Iressa). לעומת זאת, מטופלים עם תשנית ב-EGFR הם בעלי שיעור תגובה של 60% ל-erlotinib. עם זאת התשניות ב-EGFR או ב-KRAS הן אקסקלוסיביות ואינן תלויות זו בזו (Suda וחב' ב-Cancer Metast Rev משנת 2010, Riley וחב' ב- Proc Am Thoracic Soc משנת 2009, ו-Pao וחב' ב-PLos Med משנת 2005). חולי סרטן ריאות החיוביים לתשנית ב-KRAS, וסטאטוס wild type לגבי EGFR הם בעלי תגובה של 5% בלבד ל-erlotinib או ל-gefitinib.
מדידת KRAS
ביולי 2009, ה-FDA דרש מהחברות המייצרות את שני נוגדנים החד-שבטיים המכוונים כנגד EGFR (Vectibix ו-Erbitux) לכלול על אריזות התוצר מידע על התשניות ל-KRAS. בשנת 2012 אישר ה-FDA לחברת QIAGEN לשווק את ערכת therascreen KRAS test, שהיא בדיקה גנטית המתוכננת לזהות את 7 התשניות בגן KRAS בתאי סרטן המעי הגס והחלחולת. מציאת תשניות אלה מצביעה על כך שהטיפול ב-ERBITUX לא יהיה יעיל (Cox וחב' ב- Nature Drug Discovery Reviews משנת 2014). תשניות driver ב-KRAS אחראיות לפתוגנזה של עד 20% מסוגי הסרטן באדם (Kaiser וחב' ב-Science Magazine משנת 2019). לפיכך, KRAS הוא יעד תרופתי אטרקטיבי, אלא שאי הידיעה על זהותם של אתרי הקישור, עיכב את הפתרונות לפיתוח הפרמצבטי (Mullard ב-Drug Discovery משנת 2019). אתר קישור פוטנציאלי לתרופה הוא האתר אליו מתקשרים GTP/GDP, אלא שבגלל זיקת הקישור הגבוהה מאוד של GTP/GDP לאתר זה, יש סבירות נמוכה שתכשיר תרופתי יוכל להיקשר לאתר זה תוך תחרות עם GTP/GDP.
תשנית G12C
תשנית KRASG12C היא תשנית driver שכיחה, הממוקמת בשכנות לאתר קישור שטחי. נתון זה איפשר פיתוח של מעכבי KRAS אלקטרופיליים המסוגלים ליצור קשרים בלתי-הפיכים קו-וולנטיים עם אטום הגופרית הנוקלאופילי של ציסטאין בעמדה 12 של KRAS המוטנטי, ואינו נוגע ב-wild type KRAS (Plieth ב-Evaluate משנת 2019). שני מעכבים של KRASG12C המוטנטי הגיעו לשלב של ניסויים קדם-קליניים: חברת Amgen פיתחה את AMG 510 (Li וחב' ב-Genes & Development משנת 2000), וחברת Mirati Therapeutics ייצרה את MRTX-849 (Kyono וחב' ב-J Biol Chem משנת 2000, ו- Rubio וחב' ב-Eur J Biochem משנת 1999) שאושרה לניסויים קדם-קליניים. חברת AstraZeneca בשיתוף Ionis Therapeutics הודיעו על פיתוח מוטנט נוקלאוטידי antisense בשם AZD4785 שעבר כבר ניסוי phase 1 (Spaargaren ו-Bischoff ב-Proc Natl Acad Sci USA משנת 1994), אך פיתוחו הופסק בשל אי-יעילות (Vos וחב' ב-J Biol Chem משנת 2003).
תשנית G12D
התשנית השכיחה ביותר של KRAS היא G12D אך עד מאי 2019 לא היו ניסויים קליניים המכוונים כנגד תשנית זו. ניסוי של חברת Mirati המכוון כנגד G12D מתוכנן להתחיל במהלך שנת 2021.
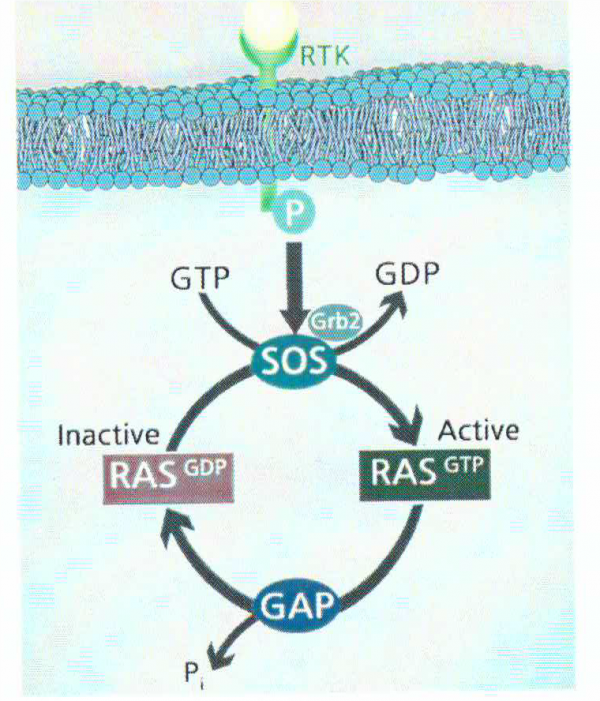
עם הזיהוי של התשנית ב-RAS כמנבא חזק של העמידות הקלינית בפני תרפיות המכוונות כנגד EGFR, מדידת התשנית הזו נכנסה לשגרת הטיפולים הקליניים, של מטופלים עם סרטן המעי הגס או של אלה עם סרטן ריאות. חלבוני RAS הם GTPases קטנים הנעים בין מצב פעיל בו RAS נקשר ל-GTP (או RAS-GTP), לבין מצב בלתי פעיל בו RAS נקשר ל-GDP (או RAS-GDP) (על פי Boguski ו-McCormick ב-Nature משנת 1993). שלושת הגנים של RAS מקודדים ל-4 חלבונים מאוד הומולוגיים במשקל מולקולרי של 21 קילו-דלטון: HRAS, KRAS-4A ו-KRAS-4B שהוא ריאגנט ה-splicing הפרידומיננטי המכונה KRAS, וכן NRAS. HRAS ו-KRAS זוהו לראשונה כגורמי התמרה בזני Harvey ו-Kirsten של נגיף סרקומה בעכברים, בעוד ש-NRAS מייצג את ההומולוג של האונקוגן הנגיפי של neuroblastoma RAS (על פי Parada וחב' ב-Nature משנת 1982, Chang וחב' באותו כתב עת מאותה שנה וכן ב-Proc Natl Acad Sci USA מאותה שנה, Der וחב' באותו כתב עת מאותה שנה, Shimizu וחב' באותו כתב עת משנת 1983).
הקישור של גורמי גדילה לקולטנים שלהם, מחיש את הגיוס והשפעול של GEFs (או guanine nucleotide-exchange factors) כגון החברים במשפחת SOS (על פי Egan וחב' ב-Nature משנת 1993). גורמי GEF מעודדים את השפעול של RAS על ידי הרחקת GDP מ-RAS, וסיוע בקישור ל-RAS של GTP השכיח בציטוזול. היפוכו של דבר, השפעול של RAS נמצא תחת בקרה שלילית על ידי חלבונים המשפעלים GTPase (הידועים כ-GAPs). בתאי יונקים, שני חלבוני המפתח של GAPs הם ו-neurofibromin (או NF1), כאשר NF1 הוא מדכא גידולים, ואם חלה בו תשנית ב-,germline מוביל הדבר ל-neurofibromatosis. תשניות סומטיות ב-NF1 מופיעות גם כן בגליובלסטומה ובמספר סוגי סרטן אחרים.
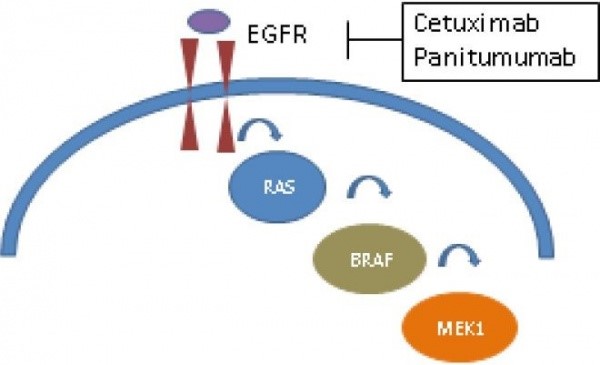
מסלול האיתות RAS-RAF-MEK-ERK
המסלול הקלאסי של MAP kinase משופעל בתאים סרטניים באדם על ידי מספר מנגנונים, כולל קישור ליגנד לקולטן של טירוזין קינאזות (RTKs), אובדן של מדכא הסרטן NF1, או על ידי תשניות ב-RAS, ב-BRAF וב-MEK1. שפעול של ERK מווסת את השעתוק של גנים המסייעים להתקדמות מחזור חיי התא והישרדות הגידול הסרטני. מעכבים בררניים של RAF כגון PLX4032 ו-GSK2118436, או של MEK כגון PD0325901, AZD6244 ו-GSK1120212, נמצא כבעלי פעילות מבטיחה בניסויים קדם-קליניים ב-phase 1 וב-phase 2. RAS הקשור ל-GTP מווסת מגוון של תהליכים תאיים, כולל שגשוג, התמיינות והישרדות, על ידי שפעול של לפחות 10 מסלולים שפעילותם אֶפקטורית, שהידועים בהם הם RAF–MEK–ERK, וכן מסלול ה- phosphatidylinositol 3‐kinase (PI3K)–AK כמו גם מסלול Ral guanine exchange factors (או RALGEFs).
איתות של Ras דרך Raf
חלבוני RAF (RAF-1/CRAF, וכן ARAF ו-BRAF) הם חלבוני serine/threonine kinases, המשופעלים על ידי RAS באופן התלוי ב-GTP. מבחינה מבנית ניתן לחלקם ל-2 מקטעים תפקודיים עם שלושה אזורים משוּמרים (CRs): המקטעים הרגולטוריים ה-N-טרמינליים (CR1 ו-CR2), ומקטע הקינאזה ה-C-טרמינלי (CR3). בקונפורמציה הבלתי פעילה RAF יוצר מבנה מכונס ו"סגור", עם מקטע רגולטורי המגיב עם מקטע הקינאזה (Wan וחב' ב-Cell משנת 2004). RAS המשופעל על ידי קישורו ל-GTP, נקשר למקטע הקושר RAS ב-CR1 ומגייס את RAF לממברנה, ושם מתרחשת פוספורילציה של השיירים threonine 599 ו- serine 602 בלולאה המשפעלת של CR3 ב-BRAF, מה שגורם לשפעול RAF. המקטע CR2 מכיל אתרי פוספורילציה רגולטוריים, אשר הדה-פוספורילציה שלהם נדרשת לקישור של RAS. בתגובה לשפעול של RAS איתות מסוגל להתקדם על ידי יצירה של הטרומרים (Weber וחב' ב-Cancer Res משנת 2001, ו-Rushworth וחב' ב-Mol Cell Biol משנת 2006). מספר צורות מוטנטיות של BRAF, כולל האלל המוטנטי V600E, פעילים באופן קונסטיטוטיבי ומסוגלים לזרחן את MEK כמונומרים באופן התלוי ב-RAS.
רוב התפקידים של RAF מתווכים על ידי פוספורילציה ובכך שפעול של MAPK (או mitogen -activated protein kinase) ושיגור של איתות חוץ-תאי על ידי פעילות קינאזות 1 ו-2 (לזרחון של MEK1 ו-MEK2). כיוון שנמצא ש-CRAF יכול גם הוא לאותת בצורה הקשורה ל-MEK, המשמעות של אפקטורים הפועלים באופן שאינו תלוי ב-MEK שנויה במחלוקת (Hindley ו-Kolch ב-J Cell Sci משנת 2002, Huser וחב' ב-EMBO J משנת 2001, Chen וחב' ב- Proc Natl Acad Sci USA משנת 2001, ו-Pearson וחב' ב- J Biol Chem משנת 2000). MEK 1 ו-MEK 2 המשופעלים, מזרחנים את ERK 1 ואת ERK 2 החוץ-תאיים, ובתגובה האחרונים מווסתים תפקודים תאיים על ידי זרחון ישיר של מצעים ציטוזוליים או כאלה בגרעין התא. חלבוני RAF שונים ביניהם בתפקודים: לדוגמה, BRAF הוא בעל פעילות קינאזה גבוהה יותר מאשר זו של CRAF, כיוון ש-serine 445 מזורחן באופן קונסטיטוטיבי ב-BRAF, בעוד שהאתר ההומולוגי ב-CRAF, serine 338, חייב להיות מזורחן לצורך שפעולו המרבי התלוי ב-RAS (Marais וחב' ב-J Biol Chem משנת 1997, ו-Chong וחב' ב-EMBO J משנת 2001). הבדלים רגולטוריים אלה מספקים בסיס ביולוגי לתצפית לפיה תשנית בודדת בקודון 600 משעלת באופן קונסטיטוטיבי את BRAF, בעוד שתשנית הומולוגית ב-CRAF אינה גורמת לשפעול דומה. הבדלים אלה מספקים גם הסבר פוטנציאלי מדוע BRAF הוא חלבון RAF העשיר ביותר בתשניות בסרטן אנושי (Emuss וחב' ב-Cancer Res משנת 2005).
איתות של Ras דרך מסלולים אפקטורים אחרים
Ras מאותת גם דרך PI3Ks, שהם הטרודימרים של תת-יחידה קטליטית (p110) ותת-יחידה רגולטורית (p85). PI3K משופעל מסיע להפיכה של phosphatidylinositol 4,5-biphosphate (או PIP2) ל- phosphatidylinositol 3,4,5‐triphosphate (או PIP3). תשניות בגן PIK3CA המקודד לתת היחידה הקטליטית p110α של class IA PI3, זוהו במגוון של גידולים סרטניים, כגון סרטן המעי הגס, השד, המוח והקיבה (Samuels וחב' ב-Science משנת 2004). תשניות במקטע הרגולטורי p85, גם כן זוהו (Jaiswal וחב' ב-Cancer Cell משנת 2009). ה-RalGEFs (הכוללים RGL2/Rlf, RGL, ו-RGL3), הם משפחה של גורמי guanine exchange, המשופעלים על ידי RAS ומגויסים לממברנת התא, שם הם ממירים את שני ה- GTPases הקטנים דמויי RAS (הידועים כ-RAls) וכינוייהם RalA ו-RalB, לצורה הפעילה הקשורה ל-GTP (Bodemann וחב' ב- Nature Rev Cancer משנת 2008).
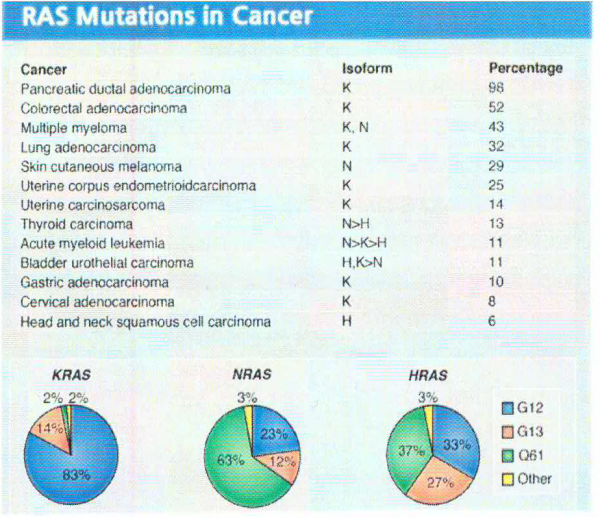
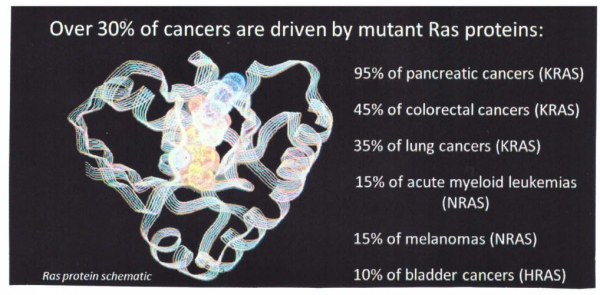
תשניות ב-KRAS בסרטן באדם
השפעול של KRAS בגידולים באדם יכול לנבוע מתשנית סומטית בגן KRAS, משפעול של קולטני טירוזין קינאזה או על ידי מוטציית loss of function של מדכא הסרטן NF1. תשניות נקודתיות סומטיות ב-KRAS מתרחשות בממאירויות באדם בעיקר בסרטן הלבלב, סרטן המעי הגס, וסרטן ריאות מסוג nsclc (Bos ב-Cancer Res משנת 1989). רוב התשניות ב-KRAS באות לביטוי בשחלוף של חומצות אמינו ב-exon 2 בקודונים 12 ו-13. בסרטן המעי הגס ופי הטבעת, תשניות ב-exon 2 אחראיות בערך ל-85% מכלל התשניות ב-KRAS, בעוד שהתשניות באקסונים 3 ו-4 בקודונים 61, 117 ו-146, נמצאות בלא יותר מ-15% מכלל התשניות ב-KRAS (Edkins וחב' ב-Cancer Biol Ther משנת 2006, ו-Janakiraman וחב' ב-Res Cancer משנת 2010). תשניות ב-exon 2 הן אפילו יותר מכריעות ב-nsclc, כאשר בסוג סרטן זה הם נמצאות בלמעלה מ-97% מכלל תשניות KRAS (Forbes וחב' ב-Br J Cancer משנת 2006).
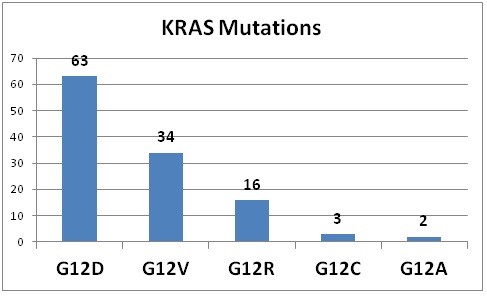
התשנית השכיחה ביותר ב-KRAS מופיעה בעמדה 12 כאשר במקום glycine מופיע שייר עם שרשרת צדדית. אנליזה של גבישי החלבון הזה מצביעה על כך ששחלוף זה כרוך בהפרעה סטרית הגורמת להידרוליזה של GTP בתיווך של GDP. כיוון שגליצין היא חומצת האמינו היחידה אליה לא ניתן לחבר שרשרת צדדית, מגוון של תשניות בעמדה זו גורם לאותן השפעות פנוטיפיות. תשניות באקסון 3 בעמדה 61 גם כן פוגעות בפעילות GTPase של KRAS, אך במקרה זה ההפרעה מתקבלת על ידי פגיעה בקשר המימן בין שייר גלוטאמין בעמדה 61 לבין שייר ארגינין בעמדה 789 של GAPp120 (על פי Scheffzek וחב' ב-Science משנת 1997). אלנין בעמדה 146 באקסון 4 מגיב על פי ההשערה עם קבוצת ה-guanine של GDP (על פי Milburn וחב' ב-Science משנת 1990). בניגוד לתשניות באקסונים 2 ו-3, תשניות בקודון 146 אינן פוגעות בפעילות GTPase של KRAS. נראה לעומת זאת, שתשניות בקודון 146 מסייעים לפעילות אנזים זה על ידי הגברת השחלוף של ה-guanine nucleotide (על פי Feig ו-Cooper ב-Mol Cell Biol משנת 1988). תשניות בקודון 146 גורמות לפעילות אינטרינזית נמוכה יותר של KRAS בהשוואה לתשניות בקודון 12 ובקודון 13.
ב-nsclc, תשניות ב-KRAS שכיחות יותר באדנוקרצינומה של הריאות בקרב מעשנים בהווה או בעבר, למרת שמוצאים תשניות אלו גם בערך ב-15% מבין אלה שמעולם לא עישנו (Riely וחב' ב-Clin Cancer Res משנת 2008). נראה שתשניות אחדות ב-KRAS (כגון התמרות של G ל-T או G ל-C) כרוכות בעישון סיגריות, ואילו תשניות של התמרה של G ל-A, אופייניות יותר לאלה שאינם מעשנים. Marks וחב' דיווחו ב-J Thorac Oncol משנת 2008, שגידולים עם תשניות ב-KRAS מאופיינים יותר עם שגשוג מתקדם מקומי עם הישרדות ממוצעת ל-3 שנים של 66%, בהשוואה לגידולים עם תשניות ב-EGFR בהם יש סבירות גבוהה יותר של מחלה stage 1 והישרדות ממוצעת ל-3 שנים של 90%.
תשניות KRAS כרוכות גם כן עם פרוגנוזה גרועה יותר בסרטן המעי הגס, אף על פי שלא כל המחקרים תמימי דעים בנקודה זו (Richman וחב' ב-J Clin Oncol משנת 2009, ו-Roth וחב' באותו כתב עת משנת 2010). הייתה השערה שאללים אינדיבידואליים ב-KRAS, הם בעלי השפעות פרוגנוסטיות משתנות ונזדקק למחקרים בהיקף גדול יותר לבחון את המשמעות הקלינית של נתון זה. מחקר רב-מוסדי שכלל 3,439 מטופלים שבחן תשניות בקודונים 12 ו-13, דיווח שרק האלל המוטנטי G12V היה כרוך בהישרדות גרועה יותר. אנליזה נוספת העלתה שתשניות non exon 2 KRAS עשויות להיות כרוכות עם פרוגנוזה טובה יותר במטופלים עם סרטן המעי הגס בשלב הלא-גרורתי (Janakiraman וחב' ב-Cancer Res משנת 2010).
פרוטאומיקה בחקר סרטן הלבלב
KRAS הוא אחד הגנים הקשורים לסרטן הלבלב עם שיעור התשניות הגבוה ביותר, המופיע בלמעלה מ-90% מהמקרים של pancreatic ductal adenocarcinoma. תשניות בגן KRAS (דהיינו תשניות G13D ,G12D ו-G12V) הן תשניות missense, והבדלים כה קטנים במבנה החלבון המתורגם, אינם יכולים להימדד על ידי ELISA או Western blot כיוון שלא קיים נוגדן המסוגל להבדיל באופן אמין בין צורות החלבון (wild type) לבין החלבון המוטנטי. לכן, המסה המולקולרית, ולכן מס-ספקטרומטריה הוכנסה לאתר את חלבוני KRAS המוטנטיים ברקמת סרטן הלבלב, בתאי סרטן זה ובנוזל ציסטות בלבלב הסרטני. השיטות העדכניות מאפשרות זיהוי חלבונים מוטנטיים ברקמת הלבלב בריכוזים של פמטומול/מיליגרם רקמה. במחקר אחר, תוך שימוש באלקטרופורזה בג'ל, הריכוזים של חלבוני KRAS wild-type או חלבוני KRAS מוטנטים הניתנים לגילוי הם בסדר גודל של פמטומול/מיליגרם רקמה.
תפקידן של התשניות ב-KRAS וב-BRAF בניבוי התגובה לתרפיה אנטי-EGFR
שתי קבוצות של מעכבי EGFR נמצאות בשימוש קליני נרחב. Gefitinib ו-erlotinib הם תכשירים קרובים ממשפחת ה-quinazoline, שהם מולקולות קטנות, מתחרות ב-ATP, ומעכבים הפיכים של EGFR שהראו הבטחה מסוימת בטיפול בחולים ב-non-small cell lung cancer (Fukuoka וחב' ב-J Clin Oncol משנת 2003, ו-Shepherd וחב' ב-N Eng J Med משנת 2005). התכשירים cetuximab ו-panitumumab הם נוגדנים חד שבטיים הנקשרים ל-EGFR על שטח פני התא, שהראו יעילות קלינית בתת-קבוצה של מטופלים עם סרטן מעי גס גרורתי (Saltz וחב' ב-J Clin Oncol משנת 2004, ו-Cunningham וחב' ב-N Eng J Med משנת 2004). אדנוקרצינומות של הריאות המגיבות ל-erlotinib ול-gefitinib מכילות מוטציות באקסונים 19 ו-21 של EGFR (Marchetti וחב' ב-J Clin Oncol משנת 2005, Paez וחב' ב-Science משנת 2004, Pao וחב' ב- Proc Natl Acad Sci USA משנת 2004 ו-Lynch וחב' ב-N Eng J Med משנת 2004). בניגוד לערך הניבוי החיובי PPV)) של המוטציות של EGFR, מוטציות ב-KRAS מנבאות עמידות לתרפיה עם תכשירים אנטי-EGFR (Miller וחב' ב-J Clin Oncol משנת 2008, Pao וחב' ב-PLos Med משנת 2005, Zhu וחב' ב-J Clin Oncol משנת 2008, ו-Hirsch וחב' ב-Ann Oncol משנת 2007). יתרה מכך, נראה שמטופלים עם גידולים נושאי מוטציות ב-KRAS המטופלים ב- erlotinib ביחד עם קרבופלטין ו-paclitaxel עלולים לסבול מתוצאות קליניות גרועות יותר מאלו המתקבלות בטיפול כימותרפי בלבד (Eberhard וחב' ב-J Clin Oncol משנת 2005).
נראה אם כן שמוטציות ב-KRAS מהוות מנבא שלילי מרכזי ליעילות הטיפול במעכבי EGFR בסרטן המעי הגס והחלחולת, ולכן מומלץ על טיפולים אלה רק למטופלים בהם הגידולים מכילים KRAS מסוג wild‐type. (Lievre וחב' ב-J Clin Oncol משנת 2008, Benvenuti וחב' ב-Cancer Res משנת 2007, ו-Freeman וחב' ב- Clin Colorect Cancer משנת 2008). אף על פי שבדיקות לזיהוי מוטציה ב-KRAS הן בעלות ערך ניבויי שלילי גבוה להערכת התגובה ל-cetuximab ול-panitumumab במקרים של סרטן המעי הגס והחלחולת, ערך הניבוי החיובי שלו נמוך (רגישות של 47%) (Linardou וחב' ב-Lancet Oncol משנת 2008).
בדיקת המוטציות של KRAS בסרטן גרורתי של המעי הגס
סרטן המעי הגס הוא אחד מסוגי הסרטן השכיחים ביותר בעולם, כאשר בארצות הברית אובחנו בשנת 2010 כ-102,900 מקרים ועוד 39,670 מקרים של סרטן החלחולת (פי הטבעת). באותה שנה נפטרו בארצות הברית 51,370 מאובחנים עם סרטן המעי הגס, שהיוו כ-9% מכלל הנפטרים מכל סוגי הסרטן בארצות הברית (Jemal וחב' ב-CA Cancer J Clin משנת 2010). עם הופעתם של שני הנוגדנים החד-שבטיים המכוונים כנגד הקולטן של EGF, הידועים כ-cetuximab או Erbitux ו-panitumomab או Vectibix, הטיפול בסרטן גרורתי של המעי הגס נכנס לעידן של טיפולים מותאמים אישית. הראשון מבין השניים הוא נוגדן IgG1 כימרי של עכבר ואדם שאושר על ידי ה-FDA לטיפול קו-שני ב-2004, והשני הוא נוגדן אנושי מסוג IgG2 שקיבל את האישור לטיפול קו שלישי בשנת 2007.
עם זאת, EGFR שהוא היעד של 2 נוגדנים אלה, המבוטא ביתר ב-80% בערך מכלל הקרצינומות של המעי הגס, נכשל ביכולת לנבא את התגובה התרפויטית בניסויים קליניים (Chung וחב' ב-J nClin Oncol משנת 2005, ו-Sartore-Bianchi וחב' באותו כתב עת משנת 2007). לכן תרו אחר גורמים המשפיעים על איתותים תאיים, כדי לסייע בניבוי היעילות של טיפולים כנגד EGFR. הגן KRAS, שנחקר באופן נמרץ החל משנות ה-80, נמצא יעיל כסמן ניבוי שלילי חזק.
שיטות לבחינת המוטציה ב-KRAS
מספר שיטות הוצעו למדידת/בחינת המוטציה ב-KRAS, עם רגישויות שונות, משך זמני ביצוע שונים, ועלויות שונות. בהמלצות של NCCN או של ASCO PCO, אין המלצה על שיטת בדיקה ספציפית. בהערכה של חוקרים באיטליה לגבי איכות הבדיקה, נשלחו 5 דגימות ל-59 מעבדות שהתבקשו לנקוט בשיטותיהן המועדפות לגבי מיצוי DNA ואנליזה של המוטציות (Ciardiello וחב' ב-Target Oncol משנת 2011). מתוך 59 מעבדות אלו, ב-48 מעבדות (81.3%) ריצוף על ידי PCR הייתה השיטה הדומיננטית לאנליזת המוטציות, בין המעבדות האחרות, ב-5 מתוכן (8.5%) השתמשו ב-pyrosequencing, ב-3 מעבדות (5.1%) נקטו ב-Real-time PCR (בערכת Therascreen®), שתי מעבדות (3.4%) השתמשו באנליזת -restriction fragments length polymorphism (או RFLP), ואילו מעבדה אחת (1.7%) השתמשו בשיטת KRAS strip. בארצות הברית ברוב המעבדות נעשה שימוש ב-amplification refractory mutation system (על פי Fakih ב-Clin Colorectal Cancer משנת 2010).
השיטות המסורתיות ששימשו למדידת מוטציות הן היברידיזציה וריצוף של DNA. אך שיטות אלה מורכבות וגוזלות זמן ביצוע ממושך. הופעת PCR שפכה אור חדש בתחום זה. שיטות של אנליזת מוטציות מתבססות על PCR באופן כמעט בלעדי, כולל ריצוף המבוסס על PCR, אנליזת התכה בטמפרטורה גבוהה (המוכרת כ-HRMA), שיטת amplification refractory mutation system (המוכרת כ-ARMS), וכן שיטת cleaved amplification polymorphism system tagged sites (המוכרת כ-PCR-RFLP). בין השיטות הללו, ריצוף DNA המוכר כריצוף ע"ש Sanger, וכן כ-dideoxy sequencing, נחשבת כסטנדרט הזהב כיוון ששיטה זו מבצעת את אנליזת רצף ה-DNA על ידי זיהוי נוקלאוטיד לאחר נוקלאוטיד, ויכולה לזהות את כל המוטציות במקטע נתון של הגן הנבחן של KRAS, כולל שחלוף של בסיסים, הַחְדָּרָה של בסיסים או השמטתם. אך לשיטה זו רגישות נמוכה של בערך 20%, היא מורכבת וגוזלת זמן. שיטה חלופית היא של pyrosequencing אך זו לוקה ברגישות נמוכה של 5-10%, אך מוסחרה על ידי שיווק ערכות (PyrpMark®) על ידי חברת Qiagen מקליפורניה (Tsitis וחב' ב-J Mol Diagn משנת 2010). ו-Ogino וחב' באותו כתב עת משנת 2005).
מבין השיטות הלא-מרצפות, שיטת ARMS (על פי Franklin וחב' ב-J Mol Diagn משנת 2010), שיטת Real-time PCR עם HRMA (על פי Krypuy וחב' ב-BMC Cancer משנת 2006), שיטת RFLP (על פי Lanthaler ב-Diagn Mol Pathol משנת 2011), ושיטת allele-specific real time PCR (על פי Oliner וחב' ב-Diagn Pathol משנת 2010), שרובן מתבססות על טכנולוגיית ,real time PCR נחקרו תוך שימוש בשיטת הריצוף של Sanger כשיטת reference מה שהוכיח את האמינות של שיטות אלו לקביעת הסטאטוס של KRAS. מחקר רב-מוסדי שהעריך שיטות גילוי של 6 מוטציות KRAS שונות, גילה הַתְאָמָה ב-66 מתוך 80 דגימות (83%) שנלקחו מרקמה קפואה, וב-71 דגימות תוך 74 (96%) של דגימות שעבו embedding בפרפין (Monzon וחב' ב-Arch Pathol Lab Med משנת 2009, ו-Anderson ב-Expert Rev Mol Diagn משנת 2011).
שיטת HRMA, מגלה את רצף המוטנט על ידי מדידת שינויים בהתכה של דופלקס DNA בעזרת הַחְדָּרָה של צבעים. שיטה זו מהירה ורגישה, אך יש לה נטייה ל-20% של תוצאות חיוביות כזובות (Ibrahem וחב' ב-Int J Exp Pathol משנת 2010). השיטות של ARMS ושל allele-specific real time PCR יכולות לזהות רק אזורי מוטציה מוגבלים של הגן של KRAS, ולכן 2 שיטות אלה אינן מקובלות בשגרה הקלינית. הערכה המסחרית המבוססת על ARMS (ערכת Therascreen® של חברת DxS Ltd ממנצ'סטר) שימשה באופן נרחב במעבדות (Angulo וחב' ב-J Mol Diagn משנת 2010). שיטות יותר רגישות הוכנסו לשימוש לזיהוי מוטציות ב-KRAS. אחת השיטות הידועה כ-PCR-clamp assay, והאחרת היא קו-אמפליפיקציה בטמפרטורת דנטורציה הנמוכה ביותר ((COLD-PCR. שיטת PCR-clamp יכולה לגלות פחות מ-1% של האלל (Ausch וחב' ב-J Mol Diagn משנת 2009), ו-Oh וחב' באותו כתב עת משנת 2010). ערכת בדיקה מסחרית (KRAS LightMix של חברת TIB MolBiol מברלין, עושה שימוש בטכנולוגיה זו תוך הפעלת טמפרטורה של 80 מעלות צלזיוס לצורך דנטורציה. בהשוואה לטמפרטורה הקונבנציונלית של 94 מעלות צלזיוס. כשיטה רגישה להעשרת DNA, מלווה לרובCOLD-PCR על ידי שיטתHRMA או על ידי pyrosequencing. הודגם ששיטת COLD-PCR משולבת עם HRMA עשויה לשפר את מגבלת הזיהוי של מוטציות ב-KRAS וב-BRAF בסרטן המעי הגס והחלחולת, ובכך להגדיל את אחוז המוטציות המזוהה בסרטן זה מ-40% ל-48.7%, בהשוואה לשיטת PCR מסורתית וריצוף ישיר (Mancini וחב' ב- J Mol Diagn משנת 2010). בנוסף, שיטת COLD-PCR משולבת ב-HRMA אינה דורשת פרוצדורה יקרה וגוזלת זמן, וניתן להשתמש בה לזיהוי אותם מטופלים המתאימים לתרפיות המכוונות נגד EGFR.
הוראות לביצוע הבדיקה
הבדיקה מתבצעת ברקמה המגיעה כ- tissue block מקובע בפורמלין ועבר embedding בפרפין. תיתכן הצגת החומר הלקוח מרקמת הגידול על זכוכית נושא אחת צבועה בהמטוקסילין ואאוזין וחמישה slides שאינם צבועים. העובי המועדף של הרקמה הנחתכת על ידי מיקרוטום הוא 5 מיקרונים. שיטת הבדיקה: Polymerase Chain Reaction.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק