Ki-67
| מדריך בדיקות מעבדה | |
| Ki-67 | |
|---|---|
| שמות אחרים | MIB-1 clone, MIB, MIB1Q, MKi67 |
| מעבדה | פתולוגיה |
| תחום | הערכה פרוגנוסטית של סרטן שד, אך גם של סוגי סרטן נוספים |
| טווח ערכים תקין | צביעה חיובית של גרעיני 10-25% מתאי הסרטן הנסקרים |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
להעריך את שיעור השגשוג (פרוליפרציה) של תאים סרטניים (אנלוגי לבדיקת cytometry flow של פאזת S). כמו כן עשויה בדיקה זו לסייע בהערכה פרוגנוסטית של סרטני שלפוחית השתן, המוח, השד, הכליה, הריאות, השחלה, בלוטת הערמונית ובלוטת התריס. קביעת רמת Ki-67 מסייעת ב-staging של גידולים נוירו-אנדוקריניים וההערכה הפרוגנוסטית שלהם. בהתאם, מטופלים הראויים לבדיקת Ki-67, הם אלה עם ממאירויות בשלפוחית השתן, המוח, השד, הכליה, הריאות, השחלה, בלוטת הערמונית ובלוטת התריס. כמו כן ביצוע בדיקה זו יכול להישקל במקרים של אלה עם גידולים נוירו-אנדוקריניים של הלבלב ומערכת העיכול.
תכונות החלבון Ki-67
האנטיגן Ki-67 זוהה על ידי Gerdes וחב' על ידי שימוש בנוגדן החד-שבטי MIB1 ותואר ב-1983 ב-Int J Cancer כחלבון לא-היסטוני הממוקם בגרעין התא. הנוגדן נוצר על ידי חיסון עכברים עם חומר גרעיני משורת התאים L428 שבודדה מ- Hodgkin’s lymphoma. שם האנטיגן מקורו בעיר Kiel בה בודד האנטיגן, והמספר נובע ממיקומו של שבט התאים בפלטת ELISA של 96 בארות. שנה לאחר מכן פרסמו Gerdes וחב' ב-J Immunol, שנוגדן זה מגיב עם מבנה גרעיני שניתן לאתרו באופן בלעדי רק בתאים מתחלקים. אנליזה מפורטת של מחזור חלוקת התאים, גילתה שהאנטיגן האמור נמצא בגרעיני תאים בפאזות G1 ו-G2 ובמחצית המאוחרת של פאזת S, של מחזור חלוקתם, כמו גם במיטוזה (פאזת M). לעומת זאת, האנטיגן Ki-67 לא ניתן לאיתור בתאים בלתי מתחלקים או כאלה הנמצאים בשלב G0, עפ"י Gerdes וחב' ב-J Immunol משנת 1984.
התברר שכתוצאה מ-splicing חלופי של הקודמן (precursor) של mRNA ששועתק מגן בודד המכיל 16 אקסונים, נוצרו 2 איזופורמים של Ki-67: הגדול מבין השניים, בעל משקל מולקולארי של 359 אלף דלטון, ואילו האיזופורם הקטן בעל משקל מולקולארי של 320 אלף דלטון. הסיבה ליצירת 2 איזופורמים אלה, נובעת מנוכחות או מחסר של רצף המקודד על ידי אקסון 7 של הגן ל-Ki-67. נמצא ש-2 האיזופורמים מכילים אזור מרכזי גדול המורכב מ-16 רצפים החוזרים על עצמם הידועים כ-"Ki-67 repeats", המקודדים על ידי אקסון 13 המורכב מ-6,854 זוגות בסיסים, ואקסון גדול זה מקודד ל-70% ול-79% מה-open reading frame של האיזופורמים ה"גדול" וה"קטן", בהתאמה.
בתוך ה-"repeats" הללו זוהה רצף של 22 חומצות אמינו, המכונה Ki-67 motif, שהשתמר היטב באבולוציה בין מינים שונים, מוטיף זה מכיל את ה-epitope הידוע כ-FKEL אליו מכוון הנוגדן החד-שבטי Ki-67. בשנת 1996 דווחו Gerdes וחב' ב-Cell Prolif על הריצוף של הגן של Ki-67 בשלמותו, גן המכיל כמעט 30,000 זוגות בסיסים.
ההקשר הציטולוגי של Ki-67
כיוון שהאנטיגן Ki-67 נוכח בכלל התאים המתחלקים (נורמאליים כמו גם סרטניים), התעורר בו עניין רב, שכן הוא זוהה כסמן יעיל להחליט לפיו את סטאטוס הפרוליפרציה של כל אוכלוסיית תאים נתונה, בפרט בהערכה אבחונית של שאתות סרטניות שונות. יחד עם זאת, אופיו של אנטיגן זה נותר בלתי מפוענח שנים אחדות, עד שקבוצתו של Gerdes החלה בסריקה של ספריית cDNA ותיעדה ב-Am J Pathol את היותו של Ki-67 חלבון גרעיני לא-היסטוני. מכאן ואילך החל מאמץ מחקרי מרשים להבנת אופיו ותפקידו של אנטיגן Ki-67. בשנת 1991 פרסמו Fonatsch וחב' ב-Genomics שהגן MKi67 המקודד לאנטיגן זה ממוקם על הזרוע הארוכה של כרומוזום 10 בעמדה 10q25-26 (על פי Schonk וחב' ב-Hum Genet ב-1989), ובשנת 1993 פרסמו Schlüter וחב' את תוצאות השיבוט והרצף השלם של ה-cDNA של Ki-67 ב-J Cell Biol.
כיוון ש-Ki-67 נוכח בגרעין התא בריכוזים קטנים בתאים "נחים", ובריכוזים גבוהים בתאים מתחלקים, ניתן בעזרת צביעה אימונו-היסטוכימית לקבוע את אחוז התאים הסרטניים החיוביים לצביעה זו, כמדד גרעיני לדרגת פעילותם. ביטוי יתר של Ki-67 מתגלה לעתים תכופות בתאים ממאירים הכרוכים בהישרדות נמוכה, בסוגי סרטן שונים. וכך ניתן להשתמש במדד זה בסרטן שלפוחית שתן (Kilicli-Camur וחב' ב-Pathol Int משנת 2002), בסרטן מוח מסוג אסטרוציטומה (Johannessen וחב' ב-Pathol Oncol Res משנת 2006), בסרטן שד (Stuart-Harris וחב' ב-Breast משנת 2008, שעשו מטה-אנליזה של 85 מחקרים שכללו 32,825 נשים, וכן Viale וחב' שבחנו את משמעות בדיקת Ki-67 במסגרת המחקר הבינלאומי Trial 1-98 בנשים עם סרטן שד במחקר שהופיע בשנת 2008 ב-J Clin Oncol), בסרטן כליות (על פי Kankuri וחב' ב-Anticancer Res משנת 2006), בסרטן ריאות (על פי Shiba וחב' משנת 2000 ב-Cancer), בסרטן שחלות (על פי Müunstedt וחב' ב-Cancer Invest משנת 2004), בסרטן ערמונית (על פי Pollack וחב' ב-J Clin Oncol משנת 2004), ובסרטן מֶדולארי של בלוטת התריס (על פי Tisell וחב' ב-Br J Cancer משנת 2003).
הביטוי התאי והמיקום של Ki-67 לאורך ה-cell cycle אינו הומוגני. בשלב המוקדם של G1 צביעת החלבון חלשה באופן כללי כאשר הצביעה מתמקדת בנקודות (foci) על פני כל הקריופלזמה (Kill וחב' ב-J Cell Sci משנת 1996). בהדרגה יש דחיסה של החלבון בשלב המאוחר של G1, ליצירת גרנולות סב-גרעיניות גדולות יותר (Starborg וחב' ב-J Cell Sci משנת 1996, ו-Braun וחב' ב-Virchows Arch B Cell Pathol משנת 1988). במהלך פאזות S ו-G2, מוצאים את Ki-67 בעיקר קשור לאזור גרעין התא כגרעין צביעה גדול יותר, וכן מוצאים אותו ביחד עם אזורים הֶטֶרוֹ-כרומאטיניים בתא. כאשר ממברנת הגרעין מתפוררת בשלב המוקדם של המיטוזה, נצבע Ki-67 באופן חזק כאשר הוא צמוד לשטח הפנים של כרומוזומים דחוסים בציטופלזמה. אך צביעה אינטנסיבית זו מתפוגגת בפאזות האנאפאזה והטלופאזה.
המיקום התאי של חלבון Ki-67 נמצא בתלות בפאזת מחזור חלוקת התא
כיום כבר ברור שהפיזור התאי של החלבון Ki-67 אינו קבוע, אלא נקבע על ידי השינויים הדרמטיים במהלך מחזור חלוקת התא. בשלב המוקדם של פאזת G1, הצביעה של Ki-67 מוגבלת למספר מוקדים ב-nucleoplasm. עלתה הצעה על ידי van Dierendonck וחב' ב-Cancer Res משנת 1989, ועל ידי du Manoir וחב' ב-Cytometry שנת 1991, שמוקדים אלה תואמים בעיקר לאזורי ההתהוות מחדש של הגרעינונים (nucleoli). לעומתם, טען Kill ב-J Cell Sci משנת 1996, שמוקדי הצביעה של Ki-67 אינם תואמים את אלה של הגרעינונים, ודעה זו אוששה על ידי מחקר שהראה שהחלבון Ki-67 עובר אינטגרציה עם הגרעינונים רק בנקודת זמן מאוחרת, כאשר האנטיגנים hPop1 ,Nop52 ,nucleolin ו-fibrillarin כבר נמצאים בגרעינון (Savino וחב' ב-J Cell Sci משנת 1999).
במחקר מפורט הראו Bridger וחב' ב-Chromosome Res משנת 1998, שהמיקום של Ki-67 בשלבים המאוד מוקדמים של G1, תואם את האזורים של ה-satellite DNA (כמו centromeric α ,telomeric minisatellite ו-satellite III). במהלך ההתקדמות של פאזת G1, הולך נחלש המיקום ה"משותף" של Ki-67 והגרעינון, אך לאחר האיחוד מחדש של הגרעינונים באמצע פאזת G1, שוב נראה ש-Ki-67 מופיע בצמידות למבנים אלה (Verheijen וחב' ב-J Cell Sci משנת 1989). חוקרים אחרונים אלה השתמשו בשיטת immuno-electron microscopy להראות ש-Ki-67 לא מופיע באזורים הגרנולאריים ובמוקדים הסיביים שבתוך הגרעינון.
הפיזור של Ki-67 בפאזת S נתון אף הוא לוויכוח. בעוד ש-Kill גורס שצביעת Ki-67 מוגבלת לגרעינון, du Manoir ו-Dierendonck סבורים שהצביעה בשלב זה מוגבלת ל-nucleoplasm. יש גם דיווחים סותרים באשר למיקום חלבון זה בפאזת G2. בעוד ש-du Manoir וחב' מוצאים ש-Ki-67 ממוקם על פני כל הגרעין, אחרים מצדדים בפיזורו על פני ה-nucleoplasm. מעניין פיזור Ki-67 במהלך המיטוזה. בפּרוֹפאזה, עובר Ki-67 רה-ארגון ונראה בפיזור דמוי-רשת עדינה הקשורה עם הכרומטין הנדחס (Verheijen וחב' ב-J Cell Sci משנת 1989). בשלב המטפאזה, הצביעה הבוהקת של Ki-67 נראית מכסה את פני הכרומוזומים האינדיבידואלים (Starborg וחב' ב- J Cell Sci משנת 1996), אך יחד עם זאת החלבון Ki-67 אינו כרוך עם הכרומטין.
לאחר התפרקות ממברנת הגרעין, חלק מ-Ki-67 ניתן לגילוי כשהוא מפוזר באופן דיפוזי בציטופלזמה, ומספר חוקרים (Braun, Starborg וחב') מדווחים על כך שלקראת סוף המיטוזה, בפאזות האנפאזה והטלוֹפאזה, החלבון Ki-67 מפגין מצג של צביעה גרנולארית, ואילו du Manoir וחב' מצאו דווקא צביעה הומוגנית של חלבון זה בשתי פאזות מאוחרות אלו. אין ספק שהסיבה למחלוקות ולסתירות בדיווחים לגבי מיקומו של Ki-67 מקורן בעובדה שמדובר בסוגי תאים שונים מזנים שונים, תוך שימוש בפרוטוקולים שונים של קיבוע וצביעה אימונו-היסטוכימית.
תפקוד Ki-67
Ki-67 הוא חלבון גרעיני הכרוך בתהליך השגשוג התאי, דרך מעורבותו בשעתוק של RNA ריבוזומאלי (Bullwinkel וחב' ב-J Cell Physiol משנת 2006), כאשר אינאקטיבציה של Ki-67 מובילה לעיכוב הסינתזה של RNA ריבוזומאלי (Rahmanzadeh וחב' ב-Cell Prolif משנת 2007). בשלב ה-interphase, האנטיגן Ki-67 ממוקם באופן בלעדי בתוך גרעין התא, ואילו במיטוזה רובו עובר לשטח הפנים של הכרומוזומים.
בשנת 1983 כאשר תוארו לראשונה נוגדנים חד שבטיים כנגד Ki-67, התמונה של המנגנונים המולקולאריים המפקחים על מחזור חיי תא האאוקריוטי, הייתה ממש בחיתוליה. באותה שנה, הוצע על ידי Evans וחב' ב-Cell המושג cyclin עבור חלבונים הנהרסים בנקודות מסוימות של חלוקת תאי ביציות של קיפוד ים, ובשנים שלאחר מכן חלה התקדמות מהירה בהבנת המארג המסובך של ה-cyclins, ושל הקינאזות התלויות ב-cyclins כמו גם במעכבים השולטים על הקואורדינציה של התקדמות ה-cell cycle (כפי שסקר Pines ב-Biochem J משנת 1995). כמו כן נרשמה התקדמות בהבנת הגורמים המפקחים על אירועי מפתח במחזור חלוקת התא, לדוגמה במעבר מפאזה אחת במחזור התא לפאזה שבאה אחריה, שלב הרפליקציה של DNA, ותהליכי דחיסת הכרומוזומים והיפרדותם.
נמצא ששני הגנים מדכאי הסרטן, p53 ו-pRb, הם יעדים מרכזיים בבקרה של מעבר התא מפאזה G1 לפאזה S (עפ"י Agarwal וחב' ב-J Biol Chem משנת 1998). למרות שהבנתנו את הבקרה המולקולארית של מחזור חלקת תאים רחוקה מלהיות מושלמת, מתחילה להצטייר התמונה המפורטת של המארג המורכב המווסת על ידי ביטוים של חלבונים שונים, ותהליכים הקשורים לחלבונים אלה כגון פוספורילציה, ubiquitination ופרוק חלבונים אלה, ואף טרנסלוקציה של מספר חלבונים. אך עדיין קיימת אי-ודאות באשר לחלבון Ki-67, למרות שברור לכל הקשר שלו לנקודות חיוניות במחזור חלוקת התא.
במספר מחקרים נמצא שהביטוי של Ki-67 בפאזה G1 יכול להיות מינימאלי, מה שעלול להוות מגבלה בדיוק הביטוי של חלבון זה לצורך זיהוי תאים בפאזה זו (Gerdes וחב' ב-J Immunol משנת 1984, וכן du Manoir וחב' ב-Cytometry משנת 1991, ו-Bruno ו-Darzynkiewicz ב-Cell Prolif משנת 1992). ביטוי בלתי רגולארי זה של Ki-67 בפאזת G1 לפי הסברה, נובע כתוצאה מההבדלים בין פאזת G1 בתאים שהיו קודם לכן רדומים, לבין פאזת G1 בתאים שסיימו אך זה מחזור קודם של חלוקת תא, או אפילו כאינדיקציה לתנאי גידול שונים של התא. משך מחצית החיים של החלבון Ki-67 מוערך סביב 60-90 דקות (Heidebrecht וחב' ב-Cell Prolif משנת 1996).ההבדלים בביטוי Ki-67 לאורך מחזור חלוקת התא אינם נובעים כנראה מהצטברות של חלבון זה שלא עבר פירוק, אלא שהם משקפים בעיקר שונות בסינתזה de novo של החלבון.
למרות כל הנתונים הללו על מיקום ועוצמת הביטוי של Ki-67, ידוע רק מעט על תפקודו מעבר לעובדה שחלבון זה עובר פוספוריליציה דרך שיירי serine ו-threonine שלו, עם תפקיד קריטי במנגנון חלוקת התא. למסקנה האחרונה הגיעו על בסיס העצירה המוחלטת של שגשוג תאים כאשר Ki-67 נחסם או על ידי מיקרו-הזרקה של נוגדנים המנטרלים חלבון זה, או על ידי עיכוב שלב הדה-פוספורילציה שלו.
משמעות Ki-67 בהתנהלות הטיפולית של סרטן השד
סרטן שד קל לאבחון, אך קשה יותר להערכה פרוגנוסטית. אכן, הגורמים הפרוגנוסטיים והטיפול המתבקש בתרחישים של סרטן שד עם קשרי לימפה בלתי נגועים, הם גיל המטופלת, גודל השאת בשד, הדירוג ההיסטולוגי, נוכחותם של קולטנים לאסטרוגן (ER), הסטאטוס של קולטנים לפרוגסטרון (PR), כמו גם הסטאטוס של HER2 או human epidermal growth factor receptor 2 (עפ"י Harris וחב' ב-J Clin Oncol משנת 2007, כמו גם Eifel וחב' ב-J Natl Cancer Inst משנת 2001 ו-Goldhirsch וחב' ב-Ann Oncol משנת 2009). יחד עם זאת, יש צורך לזיהוי טוב יותר של מטופלות עם סיכון גבוה ל-relapse, כדי שאלו מהן עם סיכון נמוך ל-relapse, לא תעבורנה טיפול כימותרפי שיש להימנע ממנו במקרים האחרונים. בסרטן השד, שיעורים גבוהים של חלוקת תאים, כרוכים בפרוגנוזה גרועה יותר, אך יחד עם זאת בסבירות גבוהה יותר לתגובה לכימותרפיה (עפ"י Beresford וחב' ב-Breast Cancer Res משנת 2006, וכן Colozza וחב' ב-Ann Oncol משנת 2005, ו-de Azambuja וחב' ב-Br J Cancer משנת 2007).
קצב חלוקות תאי סרטן השד יכול להימדד על ידי אינדקס סימון על ידי תימידין רדיואקטיבי, או על ידי אנליזת flow cytometry של מקטע פאזת S. שני סמנים אלה נבחנו בניסויים פרוספקטיבים אך הסיבוך בביצועם והצורך ברקמת-שד קפואה טרייה מגבילים את השימוש השגרתי בשיטות אלו (עפ"י Malmstrom וחב' ב-J Clin Oncol משנת 2001, ו-Silvestrini וחב' באותו כתב עת משנת 1995). עם הכנסת הטכנולוגיה של gene microarray נוצר כלי פרוגנוסטי בו על ידי תת-קלספיקציה בסרטן שד, ניתן לקבל הבדלים פרוגנוסטיים בקבוצת אלו עם מחלה חיובית ל-ER ומטופלות עם מדרג היסטולוגי- grade 2, כאשר בעבר תת-קבוצות אלו נחשבו הומוגניות (Ivshina וחב' ב-Cancer Res משנת 2006; Paik וחב' ב-N Eng J Med משנת 2004; Sorlie וחב' ב-Proc Natl Acad Sci USA משנת 2001; van’t Veer וחב' ב-Nature משנת 2002 ו-Sotiriou וחב' ב-J Natl Cancer Inst משנת 2006). בשיטת ה-microarray עושים שימוש בשבבי זכוכית או פלסטיק אליהם מודבקות פיסות DNA חד-גדילי לרוב (DNA chips), על מנת לאתר נוכחות של mRNA המשועתק מגנים שונים. לכל גן מוקצה נקודה על פני השבב, וכאשר זו מאירה, מסיקים שהגן בא לביטוי.
בשנים האחרונות, פותחו מספר מבחני multigene להערכת הסיכון בשלבים מוקדמים של סרטן השד. שני ניסויים גדולים פרוספקטיבים רב-מוסדיים, הידועים כ-TAILORx או Trial for Assigning IndividuaLized Options for Treatment Rx, שתואר על ידי Sparano וחב' ב-J Clin Oncol משנת 2008, תוך שימוש ב-Oncotype DX שתואר על ידי Paik וחב' ב-N Eng J Med משנת 2004, וכן MINDACT או Microarray in Node-Negative Disease May Avoid ChemoTherapy (עפ"י Cardoso וחב' ב-J Clin Oncol משנת 2008, תוך שימוש בערכת Mammaprint (עפ"י van de Vijer וחב' ב-N Eng J Med משנת 2002). השימוש בשתי הערכות האחרונות נועד לזהות את התועלת שבטיפול כימותרפי בנוסף לטיפול אנדוקריני בשלבים המוקדמים של סרטן שד ללא נגיעות קשרי הלימפה (Oakman וחב' ב-Breast cancer Res משנת 2009).
כיוון שמדידת רמת Ki-67 זמינה יותר לביצוע הרקמה סרטנית משוקעת בפרפין, היא כבר הוכנסה לשימוש, למרות שהיא לא הומלצה באופן גורף לשימוש בכל הקטגוריות של סרטן השד, כיוון שלא קיימת סטנדרטיזציה בינלאומית לשיטה זו. יחד עם זאת, שיטות Ki-67 ו-תדירות מיטוטית נכללו לאחרונה בהנחיות של St Gallen, אם כי הודגש שאמינותן של 2 שיטות אלו שונה באזורים גיאוגרפיים שונים. אכן, נכון להיום לא קיים עדיין תהליך בחינה תקני (SOP או standard operating procedure), וכן לא קיימת הסכמה גורפת לגבי סף "נורמה" או הגדרת ערך "cutoff" לגבי Ki-67 (עפ"י Yerushalmi וחב' ב-Lancet Oncol משנת 2010, וכן Luporsi וחב' ב-Breast Cancer Res משנת 2012). מסיבה זו ההשוואה הבין-מעבדתית של ערכי Ki-67 אינה מיושמת בשגרת ההערכה הפתולוגית (Gnant וחב' ב-Breast Care משנת 2011, וכן Untch וחב' באותו כתב עת משנת 2013).
בדגימות מרקמת שד בריאה, נמצא ש-Ki-67 מבוטא ברמות נמוכות של (בפחות מ-3% מהתאים) בתאים שליליים לקולטני אסטרוגן (ER-negative), אך לא ניתן היה למצוא אנטיגן זה בתאי שד חיוביים לקולטני אסטרוגן (ER-positive) על פי Urruticoechea וחב' ב-J Clin Oncol משנת 2005. בשיטות של immunostaining עם נוגדן חד-שבטי כנגד Ki-67 ניתן להעריך את מידת השגשוג של אוכלוסיית תאים סרטניים, אך יחד עם זאת עד כה לא הוגדרה באופן מוסכם רמת הסף של האנטיגן Ki-67 (על פי Gnant וחב' ב-Breast Care משנת 2011 ו-Untch וחב' באותו כתב עת כמאמר עוקב), ולכן לא השתלב Ki-67 עד כה בשגרת הפעילות הקלינית עם סרטן שד.
ערכים מוחלטים של Ki-67 ופרמטרים היסטו-פתולוגיים של סרטן שד
Inwald וחב' במחקרם ב-Breast Cancer Res Treat משנת 2013, בחנו על ידי ANOVA את המתאם בין ערכים מוחלטים של Ki-67 לבין פרמטרים היסטו-פתולוגיים. ערך ממוצע של Ki-67 בנשים premenopausal היה 19% ובנשים postmenppausal הוא היה 24%. באשר לגודל השאת בשד, לא נמצאו הבדלים מהותיים ברמת Ki-67, אך הבדלים כאלה נמצאו בהקשר של סטאטוס קשרי הלימפה: רמה ממוצעת של Ki-67 בגידולי-שד שליליים לנגיעות קשרי הלימפה הייתה 19%, ואילו במקרים של גידולי שד בדרגה N3 רמת Ki-67 הייתה בממוצע 24%.
מעניין שבמושגים היסטולוגיים, במקרים של קרצינומה דוקטלית-חודרנית רמת הביטוי של Ki-67 הייתה 22%, בניגוד לגידול לובולרי בו רמת הביטוי הממוצעת של Ki-67 הייתה 13%. יצוין שדרגת ההתמיינות של גידולי השד הראתה מתאם טוב עם Ki-67. לגידולי G1 נקבע ה-labeling index של Ki-67 כ-10%, לגידולי G2 אינדקס הסימון של Ki-67 היה 16%, ולגידולי G3 נקבע אינדקס סימון של 37%. חודרנות לימפאטית ווסקולארית הראו ממצאים דומים של ביטוי Ki-67. בגידולי L0 של השד, רמת הביטוי הממוצעת של Ki-67 הייתה 18%, ואילו בגידולי V0 היא נקבעה כ-20%. בגידולי L1 ו-V1 הרמה הממוצעת של Ki-67 הייתה 24% ו-28%, בהתאמה. בגידולים חיוביים לקולטן של אסטרוגן (ER) או לקולטן של פרוגסטרון (PR), רמת Ki-67 הייתה זהה-17%. בגידולי שד שליליים לקולטני ההורמונים הביטוי של Ki-67 היה גבוה יותר (42%) בגידול שלילי לאסטרוגן, מאשר לגידול שלילי לפרוגסטרון (34%). רמה ממוצעת של Ki-67 של גידולים חיוביים ל-HER2/neu הייתה 27%, לעומת 19% בגידולים שליליים ל-HER2/neu.
הקשר בין רמות Ki-67 והפרוגנוזה של סרטן שד
היעדרותו של Ki-67 מתאים בלתי מתחלקים (quiescent cells) והביטוי האוניברסאלי שלו בתאים מתחלקים, הביאו למספר ניכר של מחקרים על סגולותיו האפשריות כסמן פרוגנוסטי של התהליך הסרטני (van Dierendonck וחב' ב-Cancer Res משנת 1989). העובדה ש-Ki-67 לא נקלט בתודעה של האונקולוגים כסמן משמעותי, קשורה אולי לכך שהביטוי של חלבון זה, משתנה בעוצמת הצביעה האימונו-היסטו-כימית שלו לאורך כל מחזור חיי התא, מה שהוליד ספקות שמא יתכן זיהוי שגוי של תאים מתחלקים שיסווגו כתאים נייחים. כללית, הראיות מצביעות על כך שרמת Ki-67 נמוכה יחסית במשך שלב G1 ובשלבים המוקדמים של פאזת S, ורמתו עולה בהדרגה ומגיעה לשיאה בעת המיטוזה. ירידה מהירה ברמת Ki-67 מתחילה במשך האנפאזה והטלופאזה (Lopez וחב' ב-Cytometry משנת 1991).
כדי להעריך את הערך הפרוגנוסטי של Ki-67 בחנו Klintman וחב' מקבוצת "סרטן השד של דרום שוודיה", את ביצועי Ki-67 ביחס לגורמים פרוגנוסטיים מוסכמים, במטופלות עם קשרי-לימפה בלתי נגועים, וכמו כן בחנו חוקרים אלה האם המשמעות הפרוגנוסטית הייתה בתלות בסטאטוס של הקולטן לאסטרוגן (ER) וכן ב-grade ההיסטולוגי. ממצאי מחקר זה הופיעו ב-Modern Pathol משנת 2010. המדגם כלל 200 נשים בשנות הפריון שלהן, וכולן נמצאו במעקב של 5 שנים כאשר Ki-67 נקבע בשיטת tissue microarrays. באנליזה חד-משתנית (univariate) הושוו מקרים של Ki-67 נמוך מ-20%, למקרים של Ki-67 גבוה מ-20%, ונמצא ש-Ki-67 בערכיו הנמוכים הוא גורם פרוגנוסטי להישרדות נקייה מתהליך גרורתי מרוחק, בעוד שבערכיו הגבוהים הוא מהווה גורם סיכון למחלה מפושטת (HR=2.7 עם p=0.003).
מטה-אנליזה שכללה 12,155 משתתפות, הראתה שרמות גבוהות של Ki-67 בשלב מוקדם של סרטן השד, כרוכה בסיכון מוגבר להישנות המחלה (recurrence), לפרוגנוזה גרועה יותר ולהישרדות נמוכה יותר (de Azambuja וחב' ב-Br J Cancer משנת 2007). מטה-אנליזה נוספת שבחנה הישרדות ב-32,825 נשים עם סרטן שד בשלב מחלה מוקדם, מצאה שביטוי של Ki-67 היה כרוך בשיעורי הישרדות גרועים יותר (Stuart-Hearris וחב' ב-Breast משנת 2008). למרות זאת, נראה שסמן זה עדיין אינו בשל לשימוש שגרתי. הוועדה לסמני סרטן של החברה האמריקנית לאונקולוגיה קלינית (ASCO), לא המליצה על השימוש ב-Ki-67 כמדד פרוגנוסטי בנשים שזוהו זה מקרוב עם סרטן שד בגין מה שמוגדר כ-insufficient Quality assurance" " על ידי Harris וחב' ב-J Clin Oncol משנת 2007.
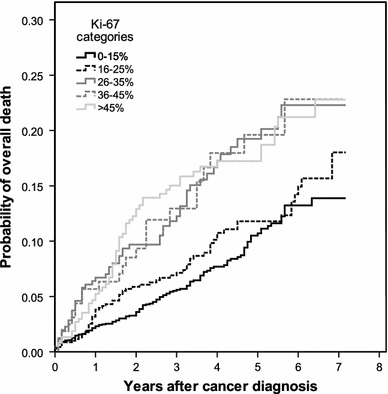
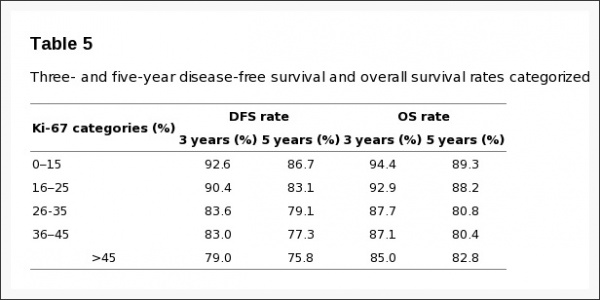
Inwald וחב' אנשי אוניברסיטת Regensburg, ערכו מחקר שנועד להעריך את ערכו של Ki-67 כסמן פרוגנוסטי, כמו גם לנתח את הקשר בין ביטוי חלבון זה לבין פרמטרים היסטולוגיים בשגרה הקלינית של טיפול בסרטן השד. נתונים נאספו מרישומי תיעוד באזור העיר רגנסבורג בחבל בוואריה בדרום גרמניה. המדגם כלל 4,692 נשים שאובחנו בין השנים 2005 ו-2011 עם סרטן שד, כאשר ב-3,658 מתוכן נקבעה באופן רוטיני רמת הביטוי של Ki-67. בכל 3,658 הנשים הללו אובחן תהליך מפושט וחודרני של סרטן שד. המתאם החזק ביותר נמצא בין רמת Ki-67 לבין ה-grading ההיסטולוגי של השאת בשד, כאשרp<0.001 . במושגים של ניתוחי סך-הישרדות (overall survival), חולק Ki-67 ל-5 קטגוריות, כאשר קטגוריית ההתייחסות הייתה זו בה Ki-67 בא לביטוי בפחות מ-15% מהתאים שנסקרו.
באנליזה רב-משתנית (multivariate) נמצא ש-Ki-67 היה פרמטר פרוגנוסטי בלתי-תלוי בגורמים קליניים או היסטולוגיים הן לגבי הישרדות חופשית ממחלה (DFS) וכן להישרדות בכלל (OS). שיעור ההישרדות בנשים עם Ki-67 נמוך מ-15% לתקופה של 5 שנים חופשית ממחלה נקבע כ-86.7%, ואילו שיעור ההישרדות בכלל בנשים אלו היה 89.3%. זאת בהשוואה לנשים בהן ערכי Ki-67 נמצאו גבוהים מ-45%, בהן שיעור ההישרדות ל-5 שנים ללא מחלה היה 75.8%, ואילו שיעור ההישרדות בכלל היה 82.8%.
ברבות מ"טביעות אצבע" גנטיות אלו, רוב הגנים הם גנים של שגשוג (proliferation) בקביעת הפרוגנוזה של המטופלת. באשר ל-Ki-67, מספר מחקרים הראו שאינדקס שגשוג גבוה של Ki-67 כרוך בהישרדות גרועה יותר נקייה-ממחלה, ובמשך הישרדות כללית קצר יותר, של מטופלות עם קשרי לימפה נגועים או בלתי נגועים (Railo וחב' ב-Tumour Biol משנת 2007; Ahlin וחב' ב-Histppathlogy משנת 2007; Brown וחב' ב-Clin Cancer Res משנת 1996; Pinder וחב' ב-Br J Cancer משנת 1995; Rudolph וחב' ב-J Natl Cancer Inst משנת 1999 ו- Jung וחב' ב-Ann Surg Oncol משנת 2009). כמו כן נמצא ש-Ki-67 הוא מנבא טוב יותר של תגובה לטיפול כימותרפי (Urruticoeches וחב' ב-J Clin Oncol משנת 2005).
מספר גדול מחקרים בוצעו לקבוע את ערכו של Ki-67 כסמן סרטני. יש הסכמה שרמות גבוהות של Ki-67 מצביעים על גידול אגרסיבי ועל פרוגנוזה גרועה. מחקר בריטי מצא שאופיו של סרטן שד יכול להיות שונה בהתאם לרגישותו להורמונים, ולסטאטוס הנגיעות של קשרי הלימפה. אך עם תאי סרטן השד מתקבלים עשירים במיוחד עם Ki-67, הסיכון להישנות הנגע גדולה יותר מהממוצע.
בשנת 2011 "קבוצת העבודה הבינלאומית להערכה של Ki-67" פרסמה ב-J Natl Cancer Inst המלצות של Dowsett וחב', בהן הודגש הפוטנציאל של מדד ה-Ki-67 באשר להערכת הפרוגנוזה, ניבוי התגובה לטיפול כימותרפי, וכמדד דינאמי ליעילות הטיפול בסרטן שד. בכינוס הקונצנזוס ב-St Gallen בשנת 2013 רוב המשתתפים הצביעו בעד הכללת Ki-67 בין השיקולים להתחלת adjuvant chemotherapy. יחד עם זאת, מסקנות ASCO, כמו גם אלו של St Gallen, ואף אלה של וועדה בינתחומית בגרמניה, אינן ממליצות על הכנסת Ki-67 באופן מיידי לשגרת הטיפולים והמדידות בסרטן השד.
לאחרונה, יצאו לשימוש מספר סמנים מולקולאריים, כולל ERCC1 או excision repair cross-complementation group 1, כמו גם RRM1 או ribonucleotide reductase M1, ו-ROS1, שניתן להשתמש בהם כסמני ניבוי להישרדות וכן להעריך את השפעת הטיפול. אך יחד עם זאת, שיטות ה-IHC של שלושת סמנים אלה שנויות במחלוקת, והם בעלי שימוש מוגבל בשגרת המעקב הפתולוגי. נראה אם כן שיתרונותיו של Ki-67 רבים ממגבלותיו, כפי שהדגיש Dowsett בסיכום המלצות כינוס בינלאומי משנת 2011 על תפקיד Ki-67 בתחום סרטן השד שהתפרסם ב-J Natl Cancer Inst באותה שנה.
בכל הקשור להתייחסות לחלבון Ki-67, הקהילייה המדעית מתחלקת ל-3 קבוצות: הקבוצה הראשונה מתחום הפתולוגיה, מכירה היטב את Ki-67 ואת הנוגדנים כנגדו, כאשר הקבוצה השנייה של אנשי רפואה מתחומים אחרים נוטה להתעלם מחלבון זה. הקבוצה השלישית, שהיא גם הקטנה ביותר מתעניינת בעיקר בביולוגיה של Ki-67 ובתפקודו. על כל פנים נראה שלמעלה מ-3 עשורים מאז תואר לראשונה, Ki-67 לה זכה עדיין להכרה גורפת ולניצול בשגרת העשייה הטיפולית בתחום מחלת הסרטן. אם קיימת הסכמה בין החוקרים לגבי Ki-67, היא קשורה לעובדה ש-Ki-67, היה ונותר פרמטר שנוי במחלוקת באשר ליתרונותיו לגבי החלטה על טיפולים בסרטן השד.
ראיות עדכניות לערך האבחוני של Ki-67 בסוגי סרטן שונים
על ידי מדידה של כמות התאים הסרטניים המבטאים את האנטיגן Ki-67, ניתן לעשות הערכה של סינתזת DNA. מחקרים מרמזים לכך שאנליזה של דגימות רקמה מקובעת בפרפין עשויה לספק מידע פרוגנוסטי שימושי במספר סוגי שאת סרטניות. המתאם של labeling index של Ki-67 עם הפרוגנוזה של שאתות באיברים רבים נידון בהרחבה במחקרים אחדים, ביניהם סרטן השד (Veronese וחב' ב-Cancer משנת 1993, ו-Tawfik וחב' ב-Hum Pathol משנת 2013), סרטן הערמונית (Miyake וחב' ב-Urol Oncol משנת 2010), סרטן שלפוחית השתן (Pfister וחב' ב-Hum Pathol משנת 1999), סרטן נוירו-אנדוקריני במערכת העיכול ובבלוטת הלבלב (Jamali וחב' ב-Endocr Pathol משנת 2008) וסרטן ריאות (Macdonald וחב' ב-Eur J Cancer משנת 2004, וכן Haga וחב' ב-Ann Thorac Surg משנת 2003 ו-Hommura וחב' ב-Clin Cancer Res משנת 2000).
ייאמר, שבחלק מהמחקרים האחרונים המצוטטים, נמצא ש-Ki-67 נכשל כגורם פרוגנוסטי בלתי תלוי, באנליזה רב-משתנית. Takano וחב' ב-Japan J Clin Oncol משנת 2008, ו-Bergethon וחב' ב-J Clin Oncol משנת 2012, דיווחו שבסרטן ריאות נמצא שיש ל-Ki-67 ערך פרוגנוסטי מוגבל או אף שלילי. לעומתם, Cheng וחב' ב-N Eng J Med משנת 2007, הראו שה-score הגבוה ביותר של Ki-67 ב-NSCLC, באדנוקרצינומה וב-squamous cell carcinoma של הריאה, היו במתאם טוב עם ההישרדות הכללית (OS), באנליזה חד-משתנית ורב-משתנית. אי ההסכמה במחקרים השונים, עלולה לנבוע כתוצאה משוני בשיטת הבחינה ה-IHC, והן בהטרוגניות של הרקמות הנבחנות, וכן בבחינה מיקרוסקופית של מספר שדות קטן מדי.
בשנת 2014 פרסמו Ding וחב' ב-Urol Oncol מחקר שנועד לבחון את משמעות Ki-67 כמדד בלתי-תלוי בשילוב עם גורמי הסיכון של EORTC בהערכה של סרטן שלפוחית השתן, ושיפור ה-risk stratification של NMIBC או non-muscle invasive bladder cancer. בניסוי זה שנמשך מאוקטובר 2002 עד יולי 2010, השתתפו 332 מטופלים שעברו פרוצדורת TUR של סרטן השלפוחית ואובחנו עם NMIBC על ידי אנליזה היסטו-פתולוגית. הביטוי של Ki-67 נקבע הן מבחינת כמות השטח הנצבע והן מבחינת עוצמת הצביעה, והתבצע ניתוח המִתאם בין ביטוי Ki-67 לבין המאפיינים הקליניים והפתולוגיים.
המעקב אחר משתתפי המחקר נמשך 47 חודשים בממוצע, ונמצא שב-119 מתוכם הייתה חזרה של הגידול, וב-40 מהם נרשמה התקדמות בממדי הגידול. נמצא שחיוביות בביטוי Ki-67 (מעל 25%) נרשמה ב-108 משתתפי המחקר (32.5%), והוא נכרך משמעותית עם ביטוי גבוה של מאפייני סיכון (EORTC). באנליזת רב-משתנים, ביטוי Ki-67 נמצא גורם סיכון בלתי-תלוי ומנבא טוב לחזרת הגידול (HR=2.14; ו-p<0.0001). או להתקדמותו ( HR=2.97; ו-p=0.004). עקומות Kaplan-Meier הצביעו על כך ששילוב מאפייני סיכון של EORTC עם ממצאי צביעת Ki-67 הביאו לניבוי מדויק יותר של חזרת הגידול או מידת התקדמותו (p<0.0001).
ערך פרוגנוסטי של Ki-67 במטופלים עם סרטן כליות גרורתי
Gorelov וחב' פרסמו בשנת 2014 ב-Urologia תוצאות מחקר שנועד לקבוע את תפקיד Ki-67 בבחירת החלופות הניתוחיות במטופלים עם סרטן כליות גרורתי. במדגם נכללו 71 מטופלים עם RCC גרורתי: בקבוצה הראשונה נכללו 16 מטופלים שעברו nephrectomy והרחקה מלאה של גרורות; הקבוצה השנייה כללה 55 מטופלים שעברו רק cytoreductive nephrectomy. אנליזה אימונו-היסטוכימית של הרקמות שהורחקו בוצעה בכל המטופלים להערכת רמות הביטוי של Ki-67. כאשר הושוו התוצאות הקליניות במטופלים שעברו הרחקת גרורות בתלות בביטוי Ki-67 (של פחות מ-10% או יותר מ-10%), נמצאה הגברה משמעותית (p=0.0001) בהישרדות של אלה בהם רמת Ki-67 הייתה נמוכה מ-10%. אותה תוצאה התקבלה גם בקבוצת המטופלים בהם בוצעה רק nephrectomy. ברמת ביטוי של Ki-67 הנמוכה מ-10%, שיעור ההישרדות במטופלים שעברו פרוצדורה כפול של nephrectomy והרחקת הגרורות נמצא גבוה משמעותית (p=0.001) בהשוואה לאלה שעברו רק nephrectomy. נמצא אם כן מתאם טוב בין רמת ביטוי Ki-67 לבין דרגת התהליך הגרורתי ב-RCC.
הביטוי של Ki-67 בסרטן הערמונית והיחס בינו לבין מדרג Gleason כמנבאים של תמותה מסרטן הערמונית במחקר ב-Mayo Clinic
בשנת 2014 פורסם ב-Mayo Clin Proc מחקרם של Tollefson וחב' שבוצע בין השנים 1993 ו-2012, בו נמדדה כמותית ה-DNA ploidy ורמת Ki-67 ברוב הדגימות בהן בוצעה ביופסיית מחט. המדגם כלל 451 גברים עם סרטן ערמונית מוכח בביופסיה, שטופלו בין ינואר 1995 עד דצמבר 1998 בהרחקה מלאה של הבלוטה, ללא טיפול הורמונאלי. נתונים קליניים ונתוני הביופסיה התקבלו לפני ניתוח הרחקת הבלוטה, ועובדו במודל רב-משתנית של Cox proportional hazards regression על מנת לנבא תהליך גרורתי ומוות ספציפי לתהליך הסרטני.
תקופת המעקב הממוצעת נמשכה 12.9 שנים, כאשר במהלכה נמצא תהליך גרורתי סיסטמי או מקומי ב-46 מתוך משתתפי המחקר, ו-18 מטופלים מתוכם נפטרו במחלה. באנליזה רב-משתנית נמצא שביטוי Ki-67 בדגימות הביופסיה שנלקחו מהמטופלים, ממצאי החודרנות ה-perineural, ומדרג Gleason נתנו תמונה מהימנה של התהליך הגרורתי, כאשר שלושה פרמטרים אלה היו כרוכים במוות תוצאת תהליך סרטני זה, עם concordance index של 0.892. לאחר התאמה לחודרנות ה-perineural ןלמדרג Gleason, נמצא שכל עלייה של 1% בביטוי של Ki-67 הייתה כרוכה בעלייה של 12% במוות-תלוי סרטן הערמונית (p<0.001). הביטוי של Ki-67 כשלעצמו נמצא מנבא חזק של התוצאות הקליניות של סרטן הערמונית, שיכול לשפר את יכולת הניבוי של האלגוריתמים הטיפוליים הנהוגים כיום. בהתחשב בעלות הנמוכה של בדיקת Ki-67, קלות הביצוע, ועוצמת הניבוי הגדולה שלו, בעלי מחקר זה מאמינים שהוספת מבדק Ki-67 לפרוטוקול הסטנדרטי של המבדקים האחרים הנהוגים בסוג סרטן זה, בהחלט סבירה.
Ki67 הוא סמן פרוגנוסטי יעיל של NSCLC, כאשר הרקמה הנבחנת נמצאת הטרוגנית
Tabata וחב' פרסמו ב- BMC Clin Pathol בשנת 2014 את תוצאות מחקרם על חולי סרטן ריאות (68 גברים ו-32 נשים) בטווח הגילים שבין 33 ו-88 שנה (גיל ממוצע 66.3 שנה). מתוך 100 משתתפי המחקר, נפטרו במחלה 44 משתתפים עם טווח הישרדות של 6-156 חודשים, עם משך הישרדות ממוצע של 44.6 חודשים). כמו כן 34 נותרו בחיים לאחר תקופת מעקב ממוצעת של 21.6 חודשים. שניים ממשתתפי המחקר נפטרו מסיבות אחרות, ונתוני 20 משתתפים אבדו, מחוסר שיתוף פעולה. נתוני השלב הפתולוגי של המחלה היו ידועים לגבי 91 מטופלים, שכללו 43 ב-stage 1A, בעוד ש-22 היו ב-stage IB, שני משתתפים ב-stage IIA, עוד 9 מהם ב-stage IIB, עוד 13 משתתפים ב-stage IIIA, אחד ב-stage IIIB ואחד ב-stage IV. בין 98 משתתפים, 5 טופלו באופן נאו-אדג'ובנטי לפני הניתוח, ואילו 31 מהם טופלו באופן אדג'ובנטי לאחר הניתוח.
הדירוג ההיסטולוגי היה כדלקמן: ב-61 מהמקרים אובחנה adenocarcinoma, ב- 30 מקרים squamous cell carcinoma, ב-3 מקרים small cell carcinoma, ב-4 מקרים large cell carcinoma, וב-2 מקרים adenosquamous cell carcinoma. כמו כן היו נתונים היסטופתולוגיים של pleural invasion, תהליכי גרורות פולמונאריות, חודרנות וסקולארית ופרמיאציה לימפטית.
המתאם בין רמת Ki-67 להישרדות הכללית בסרטן ריאות
על פי עוצמת הצביעה האימונו-היסטוכימית של Ki-67, נעשתה חלוקה ל-2 קטגוריות, של עוצמות צביעה 0 ו-1 לעומת עוצמות צביעה 2 ו-3. על ידי שימוש בעקומות Kaplan-Meyer נמצא שסך-ההישרדות (OS או overall survival) של מטופלים עם צביעת Ki-67 בדרגת צביעה 2-3, היה משמעותית קצר יותר, בהשוואה לאלה עם דרגת צביעה של 0-1, כאשר ההישרדות הממוצעת של אלה עם דרגת צביעה של Ki-67 מעל 2 הייתה 29.4 חודשים לעומת משך הישרדות ממוצעת של 56.6 חודשים באלה עם דרגת צביעה של Ki-67 הנמוכה מ-2, הבדל משמעותי סטטיסטית (p<0.001).
הערכה אוטומטית של Ki-67 בשאת נוירו-אנדוקרינית של בלוטת הלבלב
Xing וחב' פרסמו בשנת 2013 ב-Med Image Comput Assist Interv, את תוצאות מחקרם על הערכה אוטומאטית של רמת Ki-67 בשאת נוירו-אנדוקרינית של הלבלב. בשיטה אוטומטית זו של קביעת רמת Ki-67 לצורך אבחון תהליך סרטני בבלוטת הלבלב, נבחנו 101 דגימות בשיטת TMA או tissue microarray, ונמצא שמדידה אוטומטית של Ki-67 הייתה מאוד מדויקת בהשוואה להערכה של פתולוגים מיומנים.
בנוסף, ארגון הבריאות העולמי WHO)) המליץ לכלול את פעילות Ki-67 בין שאר המדדים הנלקחים בחשבון לצורך grading של גידולים נוירו-אנדוקריניים של בלוטת הלבלב ושל צינור העיכול. הנחיות אלה סוכמו על ידי Kloppel וחב' בשנת 2004 ב-Ann NY Acad Sci. גם Jamali ו-Chetty מחקרם משנת 2008 ב-Endocrn Pathol, קבעו שביטוי-יתר של Ki-67 כרוך בפרוגנוזה גרועה במטופלים עם גידולים נוירו-אנדוקריניים.
אינטרפרטציה של צביעת Ki-67 ואופן ההערכה (scoring) של תאים צבועים
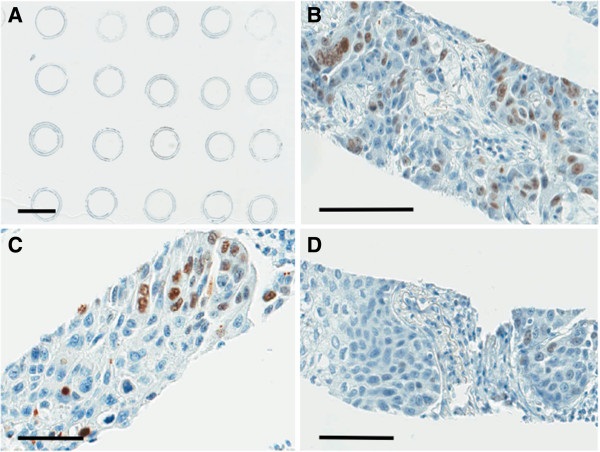
הביטוי של Ki-67 או ה-labeling index שלו, מוערך בדרך כלל כאחוז של תאי סרטן הנצבעים חיובית על ידי הנוגדן MIB1, כאשר צביעת הגרעין של תאים אלה היא הקריטריון המקובל ל"חיוביות" הצביעה. צביעת הציטופלזמה של התאים, ולעתים אף צביעה היקפית של ממברנת התאים, יכולה להופיע בחומר של סרטן השד במקרים של שינויים המוגדרים כ-squamous metaplastic, הכרוכים בסטאטוס של HER2 ו-ER בקרצינומה חודרנית של סרטן השד (עפ"י Faratian וחב' ב-Histopathlogy משנת 2009). הקפדה על הפרוטוקול הקדם-אנליטי, או אפילו שימוש בנוגדן SP6 עשויים להפחית באופן חלקי את הצביעה החוץ-גרעינית הזאת, אך כאשר היא מופיעה, יש להתעלם ממנה לצורך ה-scoring של Ki-67. על מנת להגביר את אמינות ה-IHC של Ki-67, רצוי להשתמש כביקורת בדגימות הנחשבות חיוביות לצביעה זו, כמו לדעת את הנתונים המיטוטיים של תאי סרטן השד, להשתמש כביקורת בחומר הנלקח מ-breast ducts נורמאליים, וכן להכיר את אופן הצביעה של לימפוציטים תקינים. במידה פחותה חיוני גם להכיר את אופן הצביעה של תאי אנדותל ותאי סטרומה.
שיטות להחלטה על רף נורמה עליון של תאים חיוביים ל-Ki-67, שיוכל להבדיל בצורה מהימנה בין תוצאה חיובית או שלילית, נידונו בהרחבה בספרות הרפואית (Hollander וחב' ב-Stat Med משנת 2004). לגבי IHC של Ki-67, נוסו cutoffs אחדים אם כי רוב המחקרים ממליצים על תחום של 10-20% כתואם ביותר על פי המטה-אנליזה של Stuart-Harris וחב' שהופיעה ב-Breast משנת 2008, ואשר הקיפה 85 מחקרים שכללו סך הכול 32,825 מטופלות עם סרטן השד.
סוגיות מתודולוגיות סביב מדידת Ki-67: תיקוף אנליטי
בשנות ה-80, הנוגדן המקורי כנגד Ki-67, יושם לצורך IHC בחומר טרי קפוא. מאוחר יותר, נוגדנים חד-שבטיים ממקור של עכבר פותחו והתקבלו תוצאות הדירות על ידי צביעת חתכים מקובעים בפורמלין ומשוקעים בפרפין. הנוגדן הפופולארי ביותר בשימוש היה ונותר ה-clone MIB1 שהוא בעל התכונה המיטבית של גילוי אפּיטוֹפּ אופייני ל-Ki-67 החוזר על עצמו 16 פעמים לאורך חלבון זה, מה שמגביר את רגישות הצביעה (Scholzen ו-Gerdesב-J Cell Physiol משנת 2000). יתרון נוסף של הנוגדן האמור, הוא יכולתו להיקשר ולצבוע Ki-67 בתנאים מגוונים (McCormick וחב' ב-Histopathology משנת 1993), בהשוואה לסמני פרוליפרציה אחרים כמו PCNA או Proliferating Cell Nuclear Antigen.
אך למרות שה-IHC של Ki-67 סובלנית למגוון של פרוטוקולים, מדגיש Boon ב- Eur J Morphol משנת 1996, שיש להימנע מפעילות פרוטאוליטית או מתנאים של pH נמוך. יש לציין שלמרות ש-MIB1 נחשב ל-"Gold standard", יש המשתמשים בנוגדן חד-שבטי ממקור ארנבת כנגד Ki-67, שסימונו SP6, המכיר את אותו אפּיטוֹפּ כמו MIB1, מה שבא לביטוי מהופעת פסים זהים ב-Western immunoblots (עפ"י Key וחב' ב-Lab Invest משנת 1993), ויש לו לכאורה רגישות גבוהה יותר (Wong וחב' ב-Arch Pathol Lab Med משנת 2007), ועל פי Zabaglo וחב' ב-J Clin Pathol יש לו אף יתרונות מסוימים באנליזה בחתכים של סרטן השד (על פי Niu וחב' ב-Clin Cancer Res משנת 2010).
השאיפה לכלול מדידת חלבון זה בשגרה הקלינית, חייבת קודם לכול להבטיח מתודולוגיה הדירה ועקבית , במלים אחרות התיקוף האנליטי (validation), חייב להיות בדרגת סטנדרטיזציה על פי עקרונות EGAPP אוEvaluation of Genomic Applications in Practice and Prevention (עפ"יTeutsch וחב' ב-Genet Med משנת 2009). למרות שבדיקת Ki-67 נחשבת פשוטה יחסית לביצוע כבדיקת IHC, ישנם מספר שלבים במהלך ביצוע הבדיקה שעלולים להכניס שוֹנוּת בתוצאות הבדיקה בין המעבדות המבצעות אותה.
מספר צעדים קדם-אנליטיים עלולים להשפיע ולפגום במדידת Ki-67. הם כוללים את סוג הביופסיה, את משך הזמן מלקיחת הרקמה עד לשלב הקיבוע, בסוג ה-fixative, משך הקיבוע, ובצורת האחסון של הדגימה לפרק זמן ממושך. מידע מ-2 מחקרים עדכניים מצביע על כך שבאופן כללי החלבון Ki-67 מגלה סובלנות גדולה יותר לשונות בצעדים הקדם-אנליטיים בהשוואה לרוב שיטות IHC האחרות להערכת סרטן השד (Pinhel וחב' ב-Breast cancer Res משנת 2010, ו-Bai וחב' ב-Modern Pathol משנת 2011). לדוגמה, הצביעה של Ki-67 של ביופסיות מליבת הנגע המבוצעת של חומר טרי לא הראתה כל שינוי בעוצמת הצביעה גם לאחר איחור של 20-80 דקות עד לקיבוע החומר, ולא הראתה כל שינוי באם המדידה של הצביעה התבצעה על כל חתך הביופסיה. לעומת זאת, הבדלים בצביעה של גרעיני התאים ניכרו לעתים קרובות במחקרים אלה מהסיבות הבאות:
נמצא שקישור הנוגדנים לחלבון זה תלוי בגורמים שונים כגון חוזק יוני או אפילו הקישור של Ki-67 לDNA שהוא פולימר אניוני. הועלתה לדוגמה טענה שמולקולות חדשות של החלבון Ki-67 המסונתזות בציטופלזמה אינן יכולות להתגלות בגלל מיסוך של השיירים האנטיגניים. כמו כן, שינויי קונפורמציה של Ki-67 עקב קישורו עם חלבונים אחרים, או עם חומצות גרעין, עלול להפריע לקישור הנוגדן ל-Ki-67. נמצא לדוגמה, שבנוכחות יוני סידן, המבנה של Ki-57 משתנה באופן שהפחית משמעותית את הקישור של הנוגדן MIB1 (עפ"י Shi וחב' ב-J Histochem Cytochem משנת 1999).
נתונים מעבדתיים לגבי ביצוע המבדק
השיטה האימונו-היסטוכימית טובה לקביעת השגשוג של תאי סרטן ברקמות משוקעת בפרפין, ומקובעת בפורמלין. ככל שחתכי הביופסיה מקובעים מהר יותר, כך גם צביעת Ki-67 בגרעין נראית אחידה יותר, אך אי הקפדה בתחום זה יכולה להתבטא באזורים עם עוצמת צביעה משתנה. אמנם שוֹנוּת זו אינה פוגעת בהערכת Ki-67 כאשר ההערכה נעשית ויזואלית על ידי הפתולוג, אך עלולה להיות מסובכת יותר כאשר האנליזה נעשית בשיטות imaging דיגיטאליות. שיטות הצביעה המקובלות לגבי Ki-67 בסרטן השד הן על ידי קיבוע עם neutral buffered formalin, ולאחר הדגרה על ידי הנוגדן החד-שבטי MIB1, המופיעה בצבע חום, מתבצעת צביעה נגדית עם Meyer's hematoxylin המופיעה בצבע כחול.
מספר מחקרים בחנו את ההדירות של צביעת IHC של Ki-67, ומצאו שגורמים קדם-אנליטיים עלולים להפחית באופן כזוב את ה-labeling index של החלבון הזה ויש להימנע מהם: מדובר בהשהיית קיבוע הדגימה למשך הלילה, הקפאת הדגימה לצורך אנליזה של frozen section לפני הקיבוע, או שימוש באתנול או בתמיסת Bouin במקום בבופר פורמלין ניטראלי, וכן שימוש ב-EDTA או בפרוטוקולים של acid decalcification (עפ"י Mengel וחב' ב-J Pathol משנת 2002, ו-Benini וחב' ב-Cell Prolif משנת 1997).
קיבוע בבופר פורמלין ניטראלי למשך 4-48 שעות נמצא מתאים (Munakata ו-Hendricks ב-J Histochem Cytochem משנת 1993), ו-Arber דיווח ב-Appl Immunohistochem Mol Morphol שקיבוע בפורמלין שנמשך אפילו 154 יום לא הפחית את עוצמת הצביעה של Ki-67. נראה בסיכום נקודה זו שקיבוע בפורמלין למשך 8-72 שעות הוא סביר בהחלט עבור Ki-67 (עפ"י Hammond וחב' ב-Arch Pathol Lab Med משנת 2010). כאשר הרקמה מקובעת היטב ומשוקעת בפרפין, האנטיגניות של Ki-67 יכולה להישמר שנים רבות (Cattoretti וחב' ב-J Pathol משנת 1992). יחד עם זאת, יש דיווח על אובדן של אימונו-ריאקטיביות של Ki-67, אם הבלוקים נחתכים והחתכים נשמרים על זכוכיות-נושא מזכוכית בטמפרטורת החדר למשך 3 חודשים או יותר (DiVitto וחב' ב-Lab Invest משנת 2004). ציפוי בפרפין של זכוכית הנושא תחת ייבוש בחנקן מגן אך באופן חלקי מפני אובדן האנטיגניות של Ki-67.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק