לקטופרין - Lactoferrin
הופניתם מהדף Lactoferrin לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| לקטופרין | |
|---|---|
| Lactoferrin | |
| מעבדה | כימיה בצואה, כימיה בדם וגסטרו |
| תחום | בדיקה מבדלת בין מחלת מעי דלקתית פעילה (IBD כגון Crohn’s או קוליטיס כיבית) לבין תסמונת מעי רגיז (IBS) |
| טווח ערכים תקין | פחות מ-7.25 מיקרוגרם למ"ל צואה. בדם: דגימת דם טבורי-804±35 מיקרוגרם לד"ל; בתינוקות (עד גיל 3 חודשים)26.7±3.5; במבוגרים-93.6-15.2 מיקרוגרם לד"ל. |
| יוצר הערך | פרופ' בן עמי סלע |
מטרת הבדיקה
מדידת רמת החלבון קושר הברזל בדגימות צואה נועדה לאבחנה מבדלת בין מחלת מעי דלקתית פעילה (IBD) כגון קוליטיס כיבית או מחלת קרוהן, לבין תסמונת מעי רגיז לא דלקתית (IBS) או קוליטיס כיבית לא פעילה.
מחלה דלקתית של המעי (IBD) כולל קוליטיס כיבית ומחלת קרוהן, מייצגת ספקטרום מחלות המאופיינות על ידי דלקת מעי כרונית ובדרך כלל אידיופאטית. בארה"ב סובלים לעומת זאת כ-30 מיליון איש מ-IBS שהיא תסמונת המתבטאת בכאבי בטן בעלי אופי כיווצי (crampy), נפיחנות (bloating), עצירוּת, ו/או שלשולים. אך תסמינים אלה או דומים להם יכולים לבוא לביטוי באנשים עם קולייס כיבית ומחלת קרוהן מהם סובלים כמיליון אמריקאים.
למרות שאלה הסובלים מ-IBS חשופים לאי-נוחות קשה ומטרידה ונדרשים להם פתרונות טיפוליים ספציפיים, אין ספק שמטופלים עם IBD עלולים לסבול מנזק מתמשך ותמידי למעיים העלול להתבטא בין השאר בדימום מהחלחולת, והם נזקקים לתרפיה לטווח ארוך. לכן קריטי להגיע לאבחון מבדיל מוקדם ואמין בין מקרי IBD למקרים של IBS.
בסיס פיזיולוגי
בשנת 1939 הופיע הפרסום הראשון על "חלבון אדום" המופיע בחלב בקר אך לא ניתן היה אז לנקותו במידה מספקת. רק בשנת 1960 הוא בודד מחלב אדם על ידי Johannson, ופוענחו נתוני המשקל המולקולארי שלו, הנקודה האיזו-אלקטרית, תכונות הבליעה האופטית, והעובדה שמולקולה אחת של חלבון זה יכולה לקשור 2 אטומי ברזל. החלבון שנוקה מחלב דומה במבנהו ל-transferrin המופיע בנסיוב, ומכאן שמו לקטופרין, אם כי בהמשך התברר שהוא לא מוגבל רק לחלב. כבר ב-1961 התברר אופיו האנטי-בקטריאלי של LF ותכונה זו יוחסה כבר אז ליכולת קישור הברזל שלו.
באדם, הגן המקודד לחלבון זה ידוע כ-LTF והוא ממוקם על כרומוזום 3 באזור 3q21-q23. במבנהו, LF הוא גליקופרוטאין גלובולארי עם משקל מולקולארי של כ-80 אלף דלטון, והוא מורכב מ-703 חומצות אמינו. מחקרים קריטלוגרפיים על ידי פיזור של קרני X, מגלים ש-LF מכיל שרשרת פוליפפטידית בודדה, שיוצרת 2 חלקים (domains) גלובולארים המכונים אונה N ואונה C. אונה N כוללת את רצף חומצות אמינו 1-338, ואונה C מכילה את רצף חומצות אמינו 345-703, כאשר קצות שני החלקים הללו מחוברים ביניהם על ידי גדיל (alfa-helix) קצר. כל אחת משתי האונות N ו-C מורכבת משני תת-חלקים N1 ו- N2 ,וכן C1 ו-C2, בהתאמה. כל אחת משתי האונות מכילה אתר קישור בודד לברזל, ואתר גליקוזילציה אחד. דרגת הגליקוזילציה עלולה להשתנות כך שמשקלו המולקולארי של LF נע בין 76 ל-80 אלף דלטון.
לקטופרין (להלן LF) הוא גליקופרוטאין הנוצר על ידי נויטרופילים, פגוציטים חד גרעיניים, ותאי אפיתל, ועשיר במיוחד בנוזלי הפרשה כדמעות, רוק, מיץ מרה, נוזל מהלבלב, נוזל הפרשה מהאף וחלב אם. תפקידו של LF למנוע צמיחת חיידקים על ידי הגבלת הזמינות של ברזל, ובכך נעזר LF על ידי אימונוגלובולינים מסוג IgA המופיעים בנוזלי הפרשה והמכוונים כנגד חיידקים אלה. ל-LF יש גם השפעה בקטריוצידית ישירה על ידי גרימת נזק לממברנות החיידקים. כאשר מתפתחת דלקת במעי, נויטרופילים ופגוציטים נודדים לאזור הדלקתי ומפרישים שם גרנולות המכילות LF, כאשר זה שומר על יציבותו בצואה וניתן לגילוי בשיטות אימונו-כימיות. ריכוזי LF בחלב נקבעו כ-7 גרם לליטר בקולוסטרום, 1 גרם לליטר בחלב אם בהמשך, ואילו בחלב בקר ריכוזו 150 מיליגרם לליטר. החלבון LF נמצא גם בגרנולות בתאים פולימורפונוקלארים (PMN) כנויטרופילים, ומופרש על ידי תאים אצינרים אחדים.
רמות לקטופרין אינן ניתנות לגילוי בנוזל מי השפיר עד לשבוע ה-20 להיריון, ואז הן מתחילות לעלות כאשר בסביבות השבוע ה-30 להיריון רמתן גבוהה במיוחד והיא נותרת כזו עד ללידה. רמת לקטופרין בדמה של האם עולות במקביל לרמות חלבון זה במי השפיר. יצירת לקטופרין על ידי העובר מתחילה בסביבות השבוע ה-13 להיריון. מייד לאחר הלידה רמות לקטופרין בדמו של היילוד גבוהות לפחות פי-10 מרמות חלבון זה במבוגרים.
כל מולקולת LF יכולה לקשור 2 אטומים של ברזל, או אבץ, נחושת או מתכות אחרות. בקישור ברזל נוצר קומפלקס בגוון אדום, כאשר הזיקה של ברזל ל-LF גדולה פי-300 מזו של זיקת ברזל לטרנספרין. זיקה זו גדלה בנוזל בעל pH חומצי במקצת, מה שמסייע לטרנספר של ברזל מטרנספרין ל-LF במצבי דלקת, כאשר ה-pH של הרקמות יורד בגלל הצטברות חומצת חלב וחומצות אחרות. הודגם ש-LF קשור לא רק לטרנספורט של ברזל, אבץ ונחושת, אלא גם לוויסות של ספיגת יוני מתכות אלה בדם.
לקטופרין הוא חלבון בסיסי עם נקודה איזואלקטרית (pI=8.7). הוא מופיע בשתי צורות: כאשר הוא נושא ברזל הוא מכונה hololactoferrin, וכאשר הוא חופשי מאטומי ברזל הוא ידוע כ-apolactoferrin. המבנה השלישוני של שתי צורות אלה שונה: ב- apolactoferrin לאונה N יש מבנה "פתוח" ואילו לאונה C יש מבנה מכונס. לעומת זאת, ב- hololactoferrin לשתי האונות N ו-C יש מבנה מכונס.
החלבון LF יכול להימצא בצורות פולימריות שונות הן בפלזמה והן בנוזלי ההפרשה השונים, ממצב מונומרי עד מצב טטרמרי. LF נוטה להתפלמר הן בגוף אך גם in vitro, במיוחד בריכוזים גבוהים, וכן בתלות בריכוז יוני סידן. אכן נמצא שברוב המצבים הפיזיולוגיים, בריכוז של 1 ננומול לליטר LF מופיע כטטרמר, כאשר היחס בין מצב זה למצב המונומרי הוא 4 ל-1. פעילויות שונות של LF תלויות בדרגת הפולימריזציה של החלבון, בעיקר LF במצב המונומרי אך לא הטטרמרי מסוגל להיקשר ל-DNA.
מטבוליזם של לקטופרין
לקטופרין מיוצר בעיקר בנויטרופילים ונאגר כחלבון נטול-ברזל בגרנולות מיוחדות. נראה שרמת לקטופרין מושפעת על ידי מערכת הורמונאלית, אך בניגוד לאנזימים ותוצרים אחרים של גרנולות, לקטופרין אינו מסונתז כחלבון קודמן (precursor) גדול המבוקע לחלבון פעיל, והוא אף אינו מזורחן. רמות לקטופרין בפלזמה עולות במצבי של עודף ברזל, במצבי דלקת, בהדבקות פתוגניות, ובמצבים סרטניים, כאשר בכל המצבים הללו יש גירוי לשחרור לקטופרין מהנויטרופילים.
בשחרורו מהנויטרופילים קושר לקטופרין יוני ברזל בעיקר, אם כי גם יוני מתכת אחרים. הפינוי של לקטופרין מהצירקולציה מתקיים באחת מ-2 דרכים: א. בתהליך של אנדוציטוזה לאחר הִקשרו לקולטנים שלו על פני מקרופאגים, מונוציטים ותאים אחרים של המערכת הרטיקולו-אנדותליאלית (RES), ובהמשך מעבר הברזל המשתחרר מלקטופרין לפריטין. אכן, בניסויים בחולדות ניתן היה להאריך את תקופת מחצית החיים בדם של לקטופרין קשור לברזל על ידי חסימת RES. ב. דרך נוספת לפינוי לקטופרין היא על ידי מעביר ישיר לכבד במנגנון הקשור לסידן, בו קשורים תאי Kupffer, תאי אנדותל בכבד וכן הפאטוציטים. גם הכליות משחקות תפקיד בפינוי לקטופרין מהצירקולציה. הראו שהביטוי לגן של LF עולה עם הגיל בתריסריון אך יורד עם הגיל ב-jejunum (המעי הדק האמצעי).
תפקידים ביולוגיים
LF מוכר בעיקר ביכולתו לשאת ברזל לתאים ולפקח על רמת הברזל החופשי בדם ובהפרשות הגוף. LF שייך למערכת ההגנה "הטבעית" (innate) של הגוף, בכך שהוא מגן מפני חיידקים, פטריות, נגיפים וטפילים, ויש אף מיחסים לו פעילות אנטי-סרטנית, אנטי-אלרגית וכן תפקיד בהגנה מפני קרינה. חיונית במיוחד ההגנה שמקנה LF מפני חיידקים בתינוקות. LF מגיב עם DNA דו גדילי (double stranded) ו-RNA, עם פוליסכרידים והפארין, וכמה מפעילויותיו הביולוגיות קשורות ליכולת קישור זו. כאשר ממצים LF מחלב אם, הוא מכיל בערך 3.3% RNA אליו הוא קשור בחוזקה.
פעילות בקטריוצידית של LF
הפעילות האנטי-בקטריאלית של LF נובעת מתכונות קישור הברזל של חלבון זה, באופן שמונע מפלורת חחיידקים את הברזל החיוני לשגשוגם. הפעילות האנטי בקטריאלית של LF מוסברת גם על ידי נוכחות של קולטנים ליפוסכרידים (LPS) ספציפיים על שטח פני החיידקים. כאשר LF נקשר ל-LPS שעל שטח פני החיידקים, חלק הברזל המחומצן של LF מחמצן את החיידקים על ידי יצירת פראוקסידים, מה שמשפיע על חדירות הממברנה של החיידקים וגורם לליזיס שלהם.
למרות ש-LF יכול לפגוע בחיידקים במספר מנגנונים אחרים שאינם קשורים לברזל, כגון על ידי סטימולציה של פגוציטוזה, האינטראקציה של LF עם הממברנה החיצונית של חיידקים היא הדומיננטית ביותר, כאשר לאחר הנזק הנגרם לממברנה חודר LF לתוך תא החיידק. קישור LF לדופן החיידק כרוך בפפטיד lactoferricin הממוקם על אונה N של LF, והנוצר על ידי ביקוע של LF על ידי טריפסין. הפעילות האנטי-מיקרוביאלית של LF היא על ידי פגיעה בפעילות האנזים H+-ATPase, והפרעה למעבר פרוטונים בממברנת החיידק, מה שגורם למותו.
פעילות אנטי-נגיפית של LF
לקטופרין פועל בעיקר in vitro על מגוון גדול של נגיפי אדם וחיות שונות, כולל נגיפי herpes simplex 1 & 2, נגיפי cytomegalo ,HIV, הפאטיטיס C, נגיפי Rota, פוליו type 1, נגיפי hanta, הנגיפים ממשפחת murine leukemia ו-human respiratory syncytial virus.
המנגנון הנחקר ביותר של הפעילות האנטי-נגיפית של LF, הוא יכולת ההורמון למנוע גישה של חלקיקי הנגיף אל תאי המטרה שלו. נגיפים רבים נוטים להיקשר לליפופרוטאינים על ממברנת תאי המטרה לפני חדירתם לתאים אלה. LF נקשר לאותם ליפופרוטאינים ובכך מעכב את הגישה של הנגיף לאותו יעד ממברנאלי. פעילות זו מתבצעת ביתר יעילות על ידי apolactoferrin חסר הברזל, מאשר על ידי ה- hololactoferrin המכיל ברזל.
פרט להתקשרות עם ליפופרוטאינים על פני התא, מסוגל LF להיקשר ישירות לחלקיקי נגיפים כגון הפאטיטיס ו-Rota. כמו כן מסוגל LF לדכא רפליקציה של נגיפים, גם לאחר שזה כבר חדר לתא היעד שלו. זאת הוא משיג על ידי גיוס תאי natural killer, גרנולוציטים ומקרופאגים, המשחקים תפקיד משמעותי בשלבים מוקדמים של הדבקות נגיפיות, כגון בתרחיש של SARS או severe acute respiratory syndrome.
פעילות אנטי-פטרייתית של LF
LF פועל כנגד Candida albicans כמו גם נגד מיני קנדידה אחרים כגון C. globrata, C. krusei, C .tropicalis הגורמים לזיהומים אופורטוניסטיים של הפה והמבושים באדם. הוספת LF למי שתייה של עכברים שמערכת החיסון שלהם הוחלשה והופיעו בהם כיבי aphtous, הביאה לירידה במספר זני קנדידה בפיהם של העכברים הללו, לירידה בגודל האפטוֹת ולהפחתת השטח הניזוק על פני הלשון.
הוספה פומית של LF לחיות הפחיתה את מספר הפטריות מסוג קנדידה במערכת העיכול. גישה זו הוכחה כיעילה באופן חלקי בנשאי HIV , שהיו עמידים לטיפולים עם תכשירים אנטי פטרייתיים אחרים. לא ברור עדיין מנגנון הפעולה האנטי-פטרייתית של LF אך יש רמזים לכך ש-LF מסוגל להרוס את דופן הפטרייה ולהיקשר לממברנה הפנימית של C. albicans.
מבדק לקטופרין בצואה
בשנת 2006 הוכנס לשגרת המעבדות מבדק חדש המודד בדגימות צואה את רמת לקטופרין שמקורו בנויטרופילים ותאי דם אחרים המכילים את החלבון האמור. רמה מוגברת של LF תואמת תרחיש של שלשולים הנגרמים ממצבי דלקת בנוסח של IBD. חיידקים דוגמת שיגלה, סלמונלה, קמפילובקטר, וקלוסטרידיום דפיסיל. שלשלולים על רקע דלקת שאינה מסיבה של הדבקה בקטריאלית, מוצאים גם בקוליטיס כיבית ובמחלת Crohn.
המבדק החדש משפר את הרגישות ואת הסגוליות של המבדקים הקודמים שהיו מבוססים על בדיקה מיקרוסקופית של דגימות צואה לגילוי וכימות כדוריות דם לבנות, מה שדורש מיומנות גבוהה ואף תלוי באופן קריטי במידת הטריות של דגימת הצואה, בטמפרטורה וב-pH שלה, מה שגורם להתפרקות והיעלמות הלויקוציטים. המבדק החדש מבוסס על שיטת אימונולגית תוך שימוש בנוגדנים ללקטופרין בשיטת אגלוטינציה של חלקיקי latex או בשיטת ELISA.
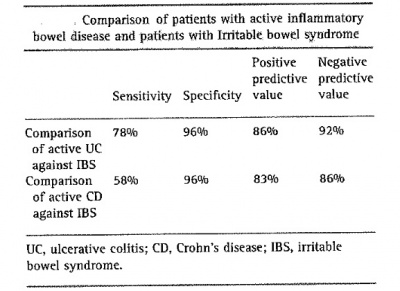
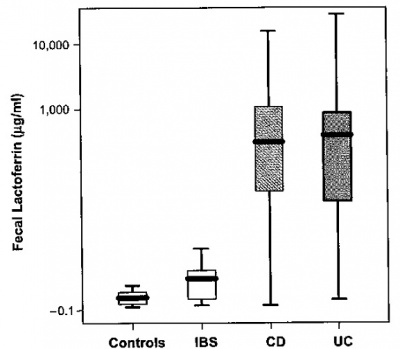
המבדק החדש נוסה במדגמים גדולים של מטופלים מאובחנים עם IBS, כאלה עם קוליטיס כיבית, כאלה עם מחלת קרוהן ומתנדבים בריאים. בתרשים ובטבלה באים לביטוי יתרונות מבדק זה.
לקטופרין בדמעות נמצא בריכוז נמוך במחלת עיניים יבשות כמו תסמונת סיוגרן. קיים מבדק ליד מיטת החולה המאפשר איסוף כמות מיקרו של דמעות וקביעת רמת LF כדי לסייע בשיפור האבחון של תסמונת סיוגרן או מפגעי עיניים יבשות אחרים.
הוראות לביצוע הבדיקה
הצואה צריכה להיאסף בכלי קיבול ללא חומרים משמרים (preservatives). אין לשמור את הצואה בקירור מעל 14 יום. תוצאות הבדיקה קשורות באופן הדוק לסטאטוס ההנקה של הנבדקת. חלב-אם עשיר במיוחד בלקטופרין, לכן דגימות צואה של אם מניקה עלולות לתת תוצאה חיובית כזובה (false positive). המבדק עלול לא להתאים לאלה עם מחלות של כשל או חסר חיסוני, שכן באלה מספר הלויקוציטים נמוך במיוחד.
למדידת רמת לקטופרין בדם חשובה מאוד צורת הדיגום של הדם. נמצא שמבחנות הפארין אינן טובות לבדיקה זו, ויש להשתמש רק במבחנת ספירת-דם (EDTA, פקק סגלגל). חיוני להימנע מהידוק יתר של חוסם העורקים למניעת עימדון-דם (stasis) ממושך, יש לסרכז את הדם במהירות האפשרית, ואם יש עיכוב בסרכוז יש לשמור את מבחנת הדם בקירור.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק