Macrophage Inflammatory Proteins
| מדריך בדיקות מעבדה | |
| Macrophage Inflammatory Proteins | |
|---|---|
| שמות אחרים | MIP |
| מעבדה | כימיה בדם |
| תחום | כמוקין המעורב בתהליכים אימונו-פתולוגיים מגוונים בגוף. |
| טווח ערכים תקין | בנסיוב: 8-23 פיקוגרם/מ"ל; בנוזל השדרה: 8-11 פיקוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
MIP שייכים למשפחה של ציטוקינים כימוטקטיים הידועים ככימוקינים. באדם ישנן 2 צורות עיקריות, MIP-1α ו-MIP-1β, הקרויות CCL3, ו-CCL4, בהתאמה (Zlotnik ו-Yoshie ב-Immunity משנת 2000). חלבונים נוספים בהגדרה של MIP כוללים את MIP-3, MIP-2 ו-MIP-5. הגן המקודד ל-MIP ממוקם בכרומוזום 17 בעמדה q21-q23. MIP-1 התגלה לראשונה על ידי Stephen Wolpe בדווח שהופיע ב-J Exp Med משנת 1988. הוא דיווח על חלבון קושר-הפארין המיוצר בעכברים על ידי מקרופאגים בתגובה לגירוי עם אנדוטוקסין. הדיווח המקורי של הפרדת MIP-1 על ג'ל פוליאקרילאמיד-SDS תואר על ידי Sherry וחב' ב-J Exp Med משנת 1988. הממצאים הצביעו על כך ש-MIP-1 היה מורכב משני פפטידים וריצוף חלקי שלהם גילה 2 חלבונים: MIP-1α ו-MIP-1β. אף על פי ששני חלבונים אלה היו בעלי שינויים קלים ברצף חומצות האמינו שלהם בקצה ה-N-טרמינלי, הם בעלי הומולוגיה של 56.7% ברצף הכללי שלהם. רצף הנוקלאוטידים הגנומי של MIP-1α מעכבר הומולוגי מאוד לזה של האדם (Widmar וחב' ב-J Immunol משנת 1991). MIP-1α/CCL3 מסונתז כקודמן (precursor) עם 92 חומצות אמינו. החלבון הבלתי-בשל נחתך במספר מקומות, ליצירת חלבון בשל ופעיל ביולוגית. כמוקינים מפגינים זיקה גבוהה לפרוטאו-גליקנים. הנטייה המוגברת של MIP-1α/CCL3 להיקשר להפארין, מחישה את הפעילות שלו.
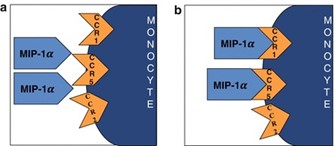
MIP-1α ו-MIP-1β הם 2 גורמים עיקריים המיוצרים על ידי מקרופאגים ומונוציטים לאחר גירוי תאים אלה על ידי אנדו-טוקסינים בקטריאליים (Sherry וחב' ב-J Exp Med משנת 1988), או על ידי ציטוקינים מקדמי-דלקת כגון IL-1β (על פי Menten וחב' ב-Cytokine & Growth Factor Reviews משנת 2002). אך מסתבר ש-MIPs יכולים גם להיות מבוטאים על ידי כל התאים ההמטופויאטיים ואף על ידי מספר תאים רקמתיים כגון פיברובלסטים, תאי אפיתל, תאי שריר חלק וסקולריים או על ידי טסיות דם משופעלות. MIPs קריטיים לתגובות של מערכת החיסון כנגד הדבקות או מצבי דלקת (Ren וחב' ב-EMBO J משנת 2010). CCL3 ו-CCL4 יכולים להיקשר לפרוטאוגליקנים חוץ-תאיים, מה שיכול להגביר את פעילותם הביולוגית (Ali וחב' ב-J Biol Chem משנת 2000). השפעתם הביולוגית מתבצעת דרך ליגציה לקולטנים של כימוקינים, שהם CCR1 שהוא הליגנד של CCL3 ו-CCR5 שהוא הליגנד של CCL3 ו-CCL4, מה שמאפשר העברת איתות לתוך התא (Murphy ו-Weaver ב-Janeway's Immunobiology משנת 2017). ההשפעה העיקרית היא chemotaxis ונדידה דרך שכבת האנדותל, אך תאים יכולים גם להיות משופעלים ולהפריש מספר מולקולות ביו-אקטיביות. כימוקינים אלה משפיעים על לימפוציטים מסוג T, על תאים דנדריטים, על תאי NK ועל טסיות-דם. הם משפעלים כמו כן גרנולוציטים, נוירופילים, איאוזינופילים ובזופילים שיכולים לגרום לדלקת נויטרופילית חריפה. הם יכולים גם להשרות סינתזה והפרשה של ציטוקינים מקדמי-דלקת אחרים כגון IL-1, IL-6 ו-TNF-α, מפיברובלסטים וכן ממקרופאגים. הגנים המקודדים ל-CCL3 ול-CCL4 ממוקמים באדם על כרומוזום 17 (על פי Irving וחב' ב-Nucleic Acids Res משנת 1990) ובמכרסמים הגן ממוקם על כרומוזום 11.
MMPs מיוצרים על ידי תאים רבים ובעיקר על ידי מקרופאגים, תאים דנדריטים ולימפוציטים (Maurer ו-von Stebut ב-Int J Biochem & Cell Biol משנת 2004). מעבר להשפעותיהם הכימוטקטיות ומעודדות הדלקת, MIPs תומכים גם בהומאוסטזיס. בחינה ביופיזיקלית מראה ש-MIPs יכולים ליצור באופן הפיך פולימרים דמויי-מוט בתמיסה. כיוון שהפולימריזציה חוסמת את אתרי הקישור של MIPs לקולטנים שלהם, מוטציות המונעות פולימריזציה מעודדות קשירה של מונוציטים על פני אנדותליום משופעל באדם.
MIP-1γ הוא MIP נוסף המסומן כ-CCL9, המיוצר בעיקר על ידי תאי אפיתל של הזקיק, ואחראי לכימוטקסיס של תאים דנדריטים ושל מקרופאגים לתוך Peyer's patches על ידי קישורם לקולטן CCR1. הלוחיות על שם Peyer הם ריכוז מבנים לימפטיים לאורך כל רירית המעי הדק כקשרים לימפטיים; לוחיות אלה, המצויות במעי העקום (ileum, שהוא החלק האחרון של המעי הדק) גדולות עד כדי כך שניתן לראותן בעין בלתי מזוינת. MIP נוסף הוא MIP-1δ (או CCL15) נקשר אף הוא לקולטנים CCR1 ו-CCR3. MIP-2 (הקרוי גם CXCL2) שייך למשפחת הכימוקינים CXC והוא פועל על ידי קישור לקולטנים CXCR1 ו-CXCE2. הוא מיוצר בעיקר על ידי מקרופאגים, מונוציטים ותאי אפיתל, והוא אחראי לכימוטקסיס למקור הדלקת ולשפעול נויטרופילים (Qin וחב' ב-World J Gastroenterol משנת 2017).
בקבוצת MIP-3 ישנם שני כימוקינים: MIP-3α או CCL20 ו-MIP-3β או CCL19. MIP-3α נקשר לקולטן CCR6 (Elhousiny וחב' ב-Clinical & Experimental Metastasis משנת 2019). MIP-3α מיוצר ברירית ובעור על ידי תאי אפיתל משופעלים והוא מגרה תאי Th17 להגיע למוקד הדלקת. MIP-3α מיוצר גם בתאי Th17 עצמם (Murphy ו-Weaver ב-Janeway's Immunobiology משנת 2017), והוא מגרה גם תאי B, תאי זיכרון T ו-דנדריטים לא-בשלים, ונוטל חלק בנדידה של תאים אלה באיברים לימפואידים שניוניים (Caux וחב' ב-Springer Semin Immunopathol משנת 2000, ו-Lee וחב' ב-Immunobiol משנת 2019). דנדריטים בשלים מפחיתים את כמות הקולטנים מסוג CCR6, ומגבירים את כמות הקולטנים מסוג CCR7 שהם הקולטנים של ה-IP-3β המיוצר על ידי תאי סטרומה באזורי תאי T באיברים לימפואידים שניוניים, והוא נקשר לקולטן CCR7 ובכל הוא מגרה נדידה של תאים דנדריטים בשלים לבלוטות הלימפה. MIP-3β מיוצר גם על ידי דנדריטים ומגרה תאי T נאיביים ולימפוציטים מסוג B להגיע לבלוטות הלימפה (Yan וחב' ב-Front Cell Develop Biol משנת 2019). MIP-5 (הידוע גם כ- MIP-1δ או כ-CCL15 נקשר לקולטנים CCR1 ו-CCR3. הוא נמשך כימוטקטית למונוציטים ולאיאוזינופילים והוא מבוטא על ידי מקרופאגים, בזופילים ומספר תאי רקמה. סבורים שיש לו תפקיד בפתולוגיה של אסתמה (Shimizu ו-Dobashi ב-Mediators Inflamm משנת 2012).
Rheumatoid arthritis ו-MIP-1alfa/CCL3
RA היא מחלה אוטואימונית דלקתית כרונית המשפיעה בעיקר על המפרקים הסינוביאליים. היא כרוכה גנטית עם אנטיגן ה-HLA הידוע כ- DR4 (Gran וחב' ב-Ann Rheum Dis משנת 1983). במהלך התפתחות מחלה זו מסתננים לתוך מפרקים מודלקים תאים דלקתיים כגון מקרופאגים, לימפוציטים ותאי פלזמה. התאים המשופעלים יוצרים ציטוקינים קדם-דלקתיים כגון TNF-α המסייע ליצירת דלקת בסינוביום ומעודד מטלו-פרוטאינאזות במשתית (matrix) של התאים לעודד הרס של סיבי קולאגן. מקרופאגים הם בעלי תפקיד חשוב בהפרשת כמוקינים הכרוכים בפתוגנזה של RA. ביטוי של MIP-1α/CCL3 מוגבר בנוזל הסינוביום ובנסיוב של חולי RA יותר מאשר בנוזלים אלה של מטופלים עם אוסטאו-ארטריטיס (Koch וחב' ב-J Clin Invest משנת 1994). רמות מוגברות של החלבון MIP-1α/CCL3 ושל ה-mRNA שלו, מוצאים במקרופאגים מרקמת הסינוביום של חולי RA. באופן דומה, ביטוי מוגבר של הקולטן של MIP-1α/CCL3 ושל CCR5 מוצאים גם כן בחולי RA (Patel וחב' ב-Clin Immunol משנת 2001).
תסמונת Sjögren ו-MIP-1α/CCL3
הפתוגנזה של תסמונת זו אינה ברורה, אך היא מאופיינת על ידי דלקת כרונית של בלוטות הרוק, הנגרמת על ידי דיס-רגולציה הקשורה לאינטרפרון, ובעקבותיה נזק לבלוטות אלו ולהפרשה מוגברת של רוק (Lessard וחב' ב-Nature Genet משנת 2013). קלינית חולים אלה סובלים מיובש בעיניים ובפה, אך גם איברים אחרים עלולים להיות קשורים. דגימות ביופסיה של חולי Sjögren מראים ריכוזים מוגברים של MIP-1α/CCL3 ושל MIP-1β/CCL4. מחקרים אלה מצאו שתאי אפיתל בצנרירים של בלוטות הרוק מבטאים יותר MIP-1β/CCL4 מאשר MIP-1α/CCL3 (Cuello וחב' ב-Br J Rheumatol משנת 1998). הוצע שגורם מנגנוני עיקרי בהתפתחות של Sjögren הוא או גיוסם של לויקוציטים לתוך האפיתליום הדוקטאלי על ידי כמוקינים, או הפרשת ציטוקינים קדם-דלקתיים על ידי תאים אלה.
מחלות קרדיו-וסקולריות ו-MIP-1α/CCL3
מחקרים מצביעים על תפקיד פתוגני של βchemokine (הידוע גם כ-c-c chemokine) בהתפתחות של מספר מחלות קרדיו-וסקולריות כמו טרשת עורקים (de Jager וחב' ב-Arteriosclr Thromb Vasc Biol משנת 2013, ו-Braunersreuther וחב' ב-Thromb Hemost משנת 2007), אי-ספיקה של שריר הלב (de Jager וחב' ב-J Mol Cell Cardiol משנת 2008), וכשל-לב גדוש (Aukrust וחב' ב-Circulation משנת 2008). זאת כתוצאה משפעול ונדידה של לויקוציטים לאזורי דלקת. מחקרים קליניים זיהו רמות מוגברות של כמוקינים כמוטקטיים בצירקולציה, מה שמרמז שהם יכולים לשמש סמנים לתחלואה קרדיו-וסקולרית. לדוגמה, הרמות בנסיוב של MCP-1/CCL2 ,MIP-1alfa/CCL3 ו-RANTES/CCL5, מוגברות במטופלים עם כשל-לב גדוש. במטופלים עם אוטם חריף של שריר הלב ותפקוד לקוי של חדר הלב השמאלי, מוצאים בצירקולציה רמות מוגברות של MIP-1α/CCL3, בהשוואה לנבדקים בריאים (Parissis וחב' ב-J Interferon Cytokine Res משנת 2002). יתרה מכך, קיים מתאם חזק בין אוטם שריר לב ו-MIP-1α/CCL3, מה שמקנה לאחרון פוטנציאל פרוגנוסטי בזיהוי חולים עם סיכון גבוה (de Jager וחב' ב-PLoS One משנת 2012).
עיכוב שגשוגם של תאי גזע המטופויאטיים
MIP-1α/CCL3 נכרך בעיכוב השגשוג של תאי גזע המטופויאטיים. תפקיד זה לא התגלה עד שמולקולה שמקורה במקרופאג המסומנת כמעכבת של תא גזע (להלן SCI) התגלתה על ידי Graham וחב' ב-Nature משנת 1990. נמצא בהמשך ש-SCI זהה ל-MIP-1α/CCL3 על פי רצף חומצות האמינו שלו. יתרה מכך, MIP-1α/CCL3 יכול לשחק תפקיד מרכזי בהגנה על תאי גזע המטופויאטיים מההשפעות השליליות המושרות על ידי תרופות ציטוטוקסיות במהלך טיפול בסרטן.
ממאירות, נדידת תאי סרטן וגרורות סרטניות
MIP-1α/CCL3 נכרך בוויסות של גרורות סרטניות. בקרצינומה של תאי קשקש בפה (להלן OSCC), מטופלים עם גרורות לקשרי הלימפה הם בעלי ביטוי מוגבר של MIP-1α/CCL3 mRNA, בהשוואה לחולים עם OSCC ללא גרורות לקשרי הלימפה, לפיכך סבורים שיש למולקולה זו תפקיד אפשרי בנדידת תאי סרטן (Silva וחב' ב-Oncol Rep משנת 2007). MIP-1α/CCL3 מיוצר גם על ידי שורות תאי לויקוציטים משופעלים או על ידי לימפובלסטים מילדים מטופלים עם ALL או עם AML (Struyf וחב' ב-Am J Pathol משנת 2003). במחקר שעשה שימוש בתא מיקרו-המוטקסיס, תאי NCF-7 ממקור סרטן השד הגיבו ל-MIP-1α/CCL3 וכן ל-MIP-1β/CCL4, מה שמרמז לתפקיד שני אלה בנדידת תאי סרטן שד (Youngs וחב' ב-Int J Cancer משנת 1997). מחקר של Wu וחב' ב-J Immunol משנת 2008, מציע שהציר CCL3-CCL5 יכול לשחק תפקיד חשוב בעידוד של תפקודי תאי סרטן רבים כולל יצירת גרורות. מחקר זה מצא ביטוי מוגבר של הקולטן ל-CCR5, אך לא של הקולטן ל-CCR1, בעכברים שהוזרקו עם תאי קרצינומה כלייתית, סרטן השולח גרורות לעצמות. המחקר מציע גם שהציר CCL3-CCL5 תורם לנאו-וסקולריזציה על ידי העידוד הביטוי של MMP-9 שיכול להרוס את המשתית (matrix) החוץ תאית. יתרה מכך, ציר זה יכול לסייע להתקדמות הסרטן על ידי הגברת הביטוי בפיברובלסטים של הגורם האנגיוגני HGF. נדידת תאי סרטן מבוססת על היכולת של כמוקינים לגרות תאי סרטן לנדידה לאתרים שניוניים.
גיוס תאי T
MIP-1α/CCL3 פועל כ-chemoattractant של תאי T, והוא מגייס תאים אלה במהלך תגובה חיסונית תאית (Taub וחב' ב-Science משנת 1993, ו-Cook וחב' ב-J Immunol משנת 1999). שתי תת-קבוצות עיקריות של לימפוציטים מסוג T הן CD4 (helper T cells) ו-CD8 (תאי T ציטוטוקסיים). תאים אלה ידועים ביצירת כמויות ניכרות של ציטוקינים המוגדרים כ-Th-1-type cytokines ו-Th-2-type cytokines. הציטוקינים מסוג Th-1 הם תווכים מקדמי דלקת פוטנטיים והם אחראיים לשמר את התגובות האוטו-אימוניות, אך הם גם עלולים בכמות גדולה לגרום לנזק רקמתי. לכן יש צורך בגורם מאזן ואכן, הציטוקינים מסוג Th-2 משרים תגובה אנטי-דלקתית המנטרלת את פעילות Th-1. באופן כללי, MIP-1α/CCL3 ו-MIP-1β/CCL4 קובעים את התגובות של הלימפוציטים. לדוגמה, MIP-1βCCL4 באופן בררני משרה פעילות של תאי T משופעלים מסוג +CD4 שהם תאי helper ואילו MIP-1α/CCL3 משרה באופן מועדף פעילות של תאי T ציטוטוקסיים משופעלים מסוג +CD8.
אפליקציות פוטנציאליות לאבחון, הערכת סיכון, וקביעת פרוגנוזה במצבי מחלה
MIP-1α/CCL3 כרוך בשפעול ונדידה של לויקוציטים, וכתוצאה מכך הוא נכרך בפתוגנזה של מחלות דלקתיות רבות כגון RA, תסמונת Sjögren ותחלואה קרדיו-וסקולרית. דווח על קשר בין תאים חיוביים ל-MIP-1α/CCL3, והגברת חלקם של תאי T ציטוטוקסיים מסוג +CD8 ותאי B בהגברת דלקות. מבחני מיקרוהמוטקסיס הראו ש-MIP-1α/CCL3 הוא בעל נטייה מוגברת לגרות תאי T ו-B (Schall וחב' ב-J Exp Med משנת 1993). אכן, כבר דיווחים מוקדמים הציעו שתווכים דלקתיים יכולים לשנות באופן זמני את ביטוי הגנים בתת-קבוצה של תאים.
תאים המפרישים MIP-1α/CCL3
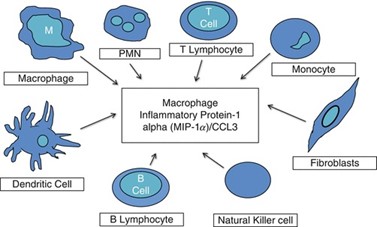
רוב התאים ההמטופויאטיים הבשלים יכולים להשרות סינתזת MIP-1α/CCL3 ו-MIP-1β/CCL4. מונוציטים, לימפוציטים מסוג T ו-B, נויטרופילים, תאים דנדריטים ותאי NK, מפרישים MIP-1α/CCL3 (Menten וחב' ב-J Leukoc Biol משנת 2002) (ראו תמונה).
במצבים נורמליים הסינתזה של MIP-1α/CCL3 מצומצמת ביותר, אך לאחר גירוי של תאים עם אנדו-טוקסינים כגון LPS (Suzuki וחב' ב-Blood משנת 2000), גירוי על ידי חלבוני נגיפים (Melchjorsen וחב' ב-J Leukoc Biol משנת 2003), או על ידי ציטוקינים דלקתיים כגון IL-1β (Standiford וחב' ב-Am J Respir Cell Mol Biol משנת 1993), גורמים לשפעול של אירועי איתות בתאים ולהגדלת הייצור של MIP-1α/CCL3. רמות MIP-1α מווסתות על ידי גורמי שעתוק אחדים. לדוגמה, MIP-1α nuclear protein (להלן MNP) הוא גורם שעתוק המשרה את השעתוק של הגן המקודד ל- MIP-1α/CCL3 (Ritter וחב' ב-Mol Cell Biol משנת 1995). עם זאת, prostaglandin E2 (להלן PGE2) מעכב את הביטוי של MIP-1α/CCL3 בתאים דנדריטים שנחשפו קודם לכן ל-LPS (Jing וחב' ב-J Leukoc Biol משנת 2003). תאים לא-המטופויאטיים כגון אוסטאובלסטים (Kukita וחב' משנת 1997) ו-ותאי אפיתל (Ryu וחב' משנת 2007) גם כן מסוגלים להפריש MIP-1α/CCL3 לאחר גירוי.
MIP-1α/CCL3 ושפעול של אוסטאוקלסטים
MIP-1α/CCL3 מסייע לנדידה ולאוריינטציה של אוסטאוקלסטים (Fuller וחב' ב-J Immunol משנת 1995). החלבון מעודד את התהליך של אוסטאוקלסטוגנזה על ידי שפעול ישיר של אוסטאוקלסטים (Watanabe וחב' ב-J Endocrinol משנת 2004). ביטוי מוגבר של MIP-1alfa/CCL3 mRNA התגלה באדם במייאלוציטים של מח עצם, ובעצם עצמה. יתרה מכך, CCR3, CCR1 ו-CX3CR1 הם אחדים מהקולטנים המבוטאים על ידי תאים אוסטאוקלסטים (Lean וחב' ב-J Cell Biochem משנת 2002). נראה ש-MIP-1α/CCL3 משחק תפקיד מפתח ב-remodeling של העצם, כיוון שהוא נקשר לקולטן CCR1, המבוטא באופן בולט על ידי אוסטאוקלסטים.
MIP-1α/CCL3 ומיאלומה נפוצה
מיאלומה נפוצה (להלן MM) מאופיינת על ידי תאי פלזמה ממאירים במח העצם וכרוכה בפעילות אוסטאוקלסטית מוגברת. MIP-1α/CCL3 נקשר ל-CCR1 או ל-CCR5, להשרות יצירת אוסטאוקלסטים, והנטרול של נוגדנים כנגד CCR1 ו-CCR5 מעכב את ספיגת העצם המושרית על ידי אוסטאוקלסטים על ידי פעילות של MIP-1α/CCL3 (Oba וחב' ב-Exp Hematol משנת 2005). קיים מתאם חיובי חזק בין סמנים של ספיגת עצם כגון deoxypyridinoline בשתן, alkaline phosphatase ספציפי לעצם בנסיוב, ורמות MIP-1 בנגעי עצם של מטופלים עם MM. בנוסף לכך, רמות MIP-1α/CCL3 בנסיוב נמצאות במתאם עם חומרת MM והפרוגנוזה של המחלה (Terpos וחב' ב-Br J Hematol משנת 2003, וב-Leuk Lymphoma משנת 2005). המסקנה היא שהרס עצם ב-MM הוא תהליך מאוד כרוך עם MIP-1α/CCL3.
התפקיד של MIP-1α/CCL3 בהדבקות נגיפי
MIP-1α/CCL3 חיוני בהשריית תגובה דלקתית כנגד נגיפים. לדוגמה, כאשר רקמת ריאה נחשפת ל-respiratory syncytial virus (להלן RSVC), תגובה דלקתית חזקה מושרית על ידי MIP-1α/CCL3 על ידי גיוס ונדידה של אאוזינופילים ובזופילים. נמצא בעכברים טרנסגניים החסרים את הגן של MIP-1α/CCL3, ירידה חזקה בתגובה הדלקתית כאשר הם מודבקים עם RSV (Haeberle וחב' ב-J Virol משנת 2001). רמה מוגברת של MIP-1α/CCL3 התגלתה בנוזל ה-lavage הברונכו-אלבאולרי (BALF) שלמטופלים עם מחלות ריאה שונות, כגון אסתמה הנגרמת מאלרגנים (Holgate וחב' ב-Am J Respir Crit Care Med משנת 1997), ב-acute respiratory distress syndrome (להלן ARDS) (Goodman וחב' באותו כתב עת משנת 1996), ובפיברוזיס ריאתי (Ziegenhagen וחב' ב-J Investig Med משנת 1998). נתונים אלה מצביעים על תפקיד משמעותי של MIP-1α/CCL3 בסיוע לתגובה דלקתית במקרים שונים של הדבקות נגיפיות.
הדבקה והעברת הנגיף HIV נמצאת תחת פיקוח ניכר של כמוקינים והקולטנים של כמוקינים/ בה בשעה שלימפוציטים מסוג +CD4 מהווים יעד עיקרי של הנגיף, קולטנים לכמוקינים מסוג CCR5 ו-CXCR4, פועלים כקו-קולטנים ראשוניים לחדירת הנגיף (Alfano ו-Poli ב-Mol Immunol משנת 2005). כיוון ש- MIP-1α/CCL3 נקשר לקולטן CCR5, הוא יכול לשחק תפקיד חשוב בפתוגנזה של הדבקה עם HIV. פרט ללימפוציטים מסוג T, ידוע שמקרופאגים גם כן תאי יעד המודבקים על ידי HIV, ומוצאים בהם ביטוי מוגבר של MIP-1α/CCL3, הנמצא במתאם עם הרפליקציה של חלקיקי הנגיף (Canque וחב' ב-Blood משנת 1996). כמוקינים שונים כגון MIP-1α/CCL3, MIP-1β/CCL4 ו-RANTES/CCL5, מפגינים פעילות המדכאת את HIV (Cocchi וחב' ב-Science משנת 1995). יתרה מכך, ניסויים הראו שנוגדנים כנגד שלושת הכמוקינים האחרונים, יכולים לחסום בשלמות את פעילותם בדיכוי פעילות HIV. ממצאים אלה תומכים בהשערה שכמוקינים הם בעלי תפקיד פוטנציאלי בעיכוב וטיפול בהדבקות HIV.
MIP-1α/CCL3 וריפוי פצעים
באתרי פציעה, יש למקרופאגים תפקידים רבים בסיוע לריפוי פצעים. תאים אלה מפרישים גורמי גדילה שונים המעודדים את שגשוג תאים כגון פיברובלסטים, תאי אנדותל, וקרטינוציטים. מקרופאגים יוצרים גם חלבונים המסייעים ל-remodeling של אנזימים כ-collagenase ופרוטאזות. מקרופאגים יכולים לייצר מספר אנזימים המפרקים פתוגנים מדבקים או משרים פגוציטוזה (ראו תמונה). עיכוב בריפוי פצעים ופעיליות פגוציטיות מופחתות מוצאים כאשר מספרי המקרופאגים והמונוציטים מופחתים (Leibovich ו-Ross ב-Am J Pathol משנת 1975). תווכים כגון MIP-1α/CCL עשויים לסייע בפעילות ריפוי פצעים על ידי גיוס של מקרופאגים לאזור הרקמה הפצועה. מחקר in vitro הראה עלייה בביטוי MIP-1α/CCL3 mRNA ורמת החלבון לאחר גרימת חיתוך ברקמה (DiPietro וחב' ב-J Clin Invest משנת 1998). חוקרים אלה הראו שנטרול של MIP-1α/CCL3 על ידי נוגדנים ספציפיים מפחית את פעילות סינתזת קולאגן, מפחית פעילות אנגיוגנית וכן את מספר המקרופאגים העוברים הסננה לאזור הפציעה. ממצאים אלה משקפים את חשיבות MIP-1α/CCL3 בתיווך של נדידת מקרופאגים לאזורי פציעה.
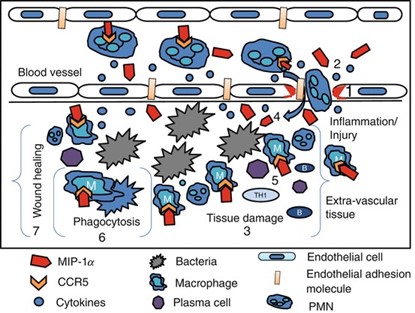
(1) שפעול של תאי אנדותל;
(2) מספר ציטוקינים וכמוקינים משתחררים בתהליך;
(3) יצירה בלתי מוגבלת של שלציטוקינים וכמוקינים גורמים להרס רקמתי;
(4) מולקולות ספיחה אנדותליאליות מייצרות MIP-1α/CCL3, ומגייסות תאים פולי-מורפו-נוקלאריים (PMN) לאזור הפציעה;
(5) MIP-1α/CCL3 מסייע לגיוס מקרופאגים ולימפוציטים לאזור הדבקה בקטריאלית;
(6) ו-(7) מקרופאגים משרים פגוציטוזה להשמדת חיידקים ומיצרים גורמי גדילה המסייעים לריפוי הפציעה.
הוראות לביצוע הבדיקה
מדידת MIP מתבצעת בשיטת ELISA: פלטת 96 בארות צופתה בנוגדן חד שבטי מעכבר הספציפי ל-MIP-1 α. הדגימה הנמדדת מוספת לבארות להדגרה של 8–12 שעות בקירור. לאחר שטיפה ב-PBS או בבופר tris, מוסיפים נוגדן פוליקלונלי ממקור עז שעבר ביוטינילציה שהוא ספציפי כנגד MIP-1 α לתקופת הדגרה של 2 שעות בטמפרטורת החדר, שלאחריה שוב שלב שטיפת הבארות עם PBS או TBS. כעת מוסף קומפלקס avidin-biotin-peroxidase ולאחריו שטיפה עם PBS או עם TBS להרחקת הקוניוגאט הבלתי קשור. TMB ('tetramethylbenzidine ,5,5,’,3,3) שהוא המצע של horseradish peroxidase (HRP), משמש לזהות את ריאקציית HRP על ידי יצירת צבע כחול המשתנה לצבע צהוב עם הפסקת הריאקציה בהוספת תמיסה חומצית. עוצמת הצבע הצהוב הנמדדת באורך גל של 405 ננומטר, פרופורציונית לריכוז MIP-1α.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק