כריתת בלוטות הלימפה בסרטן השד - Lymph node dissection in breast cancer
הופניתם מהדף Sentinel lymph node לדף הנוכחי.
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | כירורגיה של השד | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן השד
כריתה מלאה של בלוטות הלימפה
כיום אין ערעור על כך, שנוכחות בלוטות לימפה נגועות מהווה גורם פרוגנוסטי גרוע בחולות סרטן השד. לעצם קיום בלוטות נגועות, וגם למספרן, משמעות פרוגנוסטית חשובה. היו שחשבו, בהתאם לגישה של Halsted, שסילוק רדיקאלי של בלוטות הלימפה מהווה טיפול טוב יותר מכיוון שמסלקים רקמה שאתית מהגוף. כיום, כאשר הגישה של פישר קנתה לה מקום מכובד בתפיסתנו את השאת הממארת בשד, סילוק בלוטות הלימפה חשוב יותר להערכת שלב המחלה ולמניעת חזרות מקומיות בחולות בעלות בלוטות נגועות. בעבר פורסמו עבודות המראות כי חולות שלא עברו כריתה של בלוטות הלימפה נוטות יותר לפתח חזרה מקומית וגרורות מרוחקות, והן נותרות בחיים פחות מאלה שעברו כריתה.
העובדות הללו עוררו את השאלה בדבר הצורך בכריתה נרחבת (רדיקאלית) של הבלוטות בבית השחי. השאלה הנשאלת היא, האם על-ידי כריתת בלוטות מוגבלת ניתן לצפות לחיזוי טוב של דרגת השאת, ולקבל החלטה על אופן הטיפול הנדרש.
אין כל התאמה בין הבדיקה הקלינית של בלוטות לימפה נגועות לבין הממצאים הפתולוגיים של בלוטות אלה. ב-38% מהנשים, שבהן נעשתה הערכה קלינית של בלוטות שליליות, נמצאו גרורות בפרפרטים ההיסטולוגיים. לעומת זאת, ב-27% מהחולות עם חשד קליני לגרורות בבלוטות הלימפה, לא נמצאה כל עדות לכך בבדיקה הפתולוגית. המסקנה המתבקשת היא שההערכה הקלינית של קביעת שלב המחלה אינה יעילה דיה על מנת לקבוע את מדיניות הטיפול בהמשך, ולכן יש צורך בבדיקה היסטולוגית של בלוטות הלימפה.
בהשוואת מספר הבלוטות הנבדקות ביחס לתוצאות המתקבלות בתשובות הפתולוגיות, מתקבל הרושם שמספיק לבצע כריתת בלוטות לימפה ב-1 Level בלבד על מנת לקבל דירוג מדויק של המחלה (טבלה 12.12).
| טבלה 12.12: היחס בין מספר הבלוטות הנבדקות לשכיחות הנגיעות בבלוטות | ||
|---|---|---|
| מספר-בלוטות שהוצאו | בלוטות שליליות קלינית - % בלוטות חיוביות היסטולוגית | בלוטות חיוביות קלינית - % בלוטות חיוביות היסטולוגית |
| 5 - 3 | 36 | 67 |
| 10 - 6 | 35 | 61 |
| 20 - 11 | 35 | 73 |
| 20< | 39 | 85 |
ב- Danish breast cancer cooperative group בדקו בצורה פרוספקטיבית את שיעורי החזרה המקומית בבית השחי ביחס למספר הבלוטות שהוצאו, במעקב שנמשך שנתיים בממוצע. הם דיווחו כי די בהוצאת 5 בלוטות על מנת להעריך האם קיימות גרורות בבלוטות הלימפה או לא.
Steele חילק 314 חולות בצורה אקראית לחולות שעברו כריתת שד שלמה וכריתת כל הבלוטות בבית השחי ולחולות שעברו כריתת שד שלמה ודגימה של בלוטות בבית השחי. הקבוצה האחרונה חולקה לתת קבוצה נוספת של כאלה שעברו דגימה ולאחר מכן כריתה שלמה של הבלוטות בבית השחי. הממצאים הראו שכריתת כל הבלוטות לא הוסיפה כל מידע על זה שהתקבל מהדגימה של הבלוטות, כאשר הבלוטות היו שליליות (טבלה 13.12). לדעתו, מספיקה דגימה של בלוטות הלימפה בבית השחי.
| טבלה 13.12: מידע המתקבל מכריתת בלוטות בהשוואה לדגימת בלוטות | |||
|---|---|---|---|
| מספר חולות | אחוז הבלוטות החיוביות | תוספת* | |
| כריתת שד ובלוטות | 100 | 40 | |
| כריתת שד + דגימת בלוטות | 68 | 38 | |
| כריתת שד + דגימת בלוטות + כריתת בלוטות | 67 | 39 | 0 |
(*) תוספת חולות עם בלוטות חיוביות לאחר ניקוי בית השחי.
Steele ערך השוואה אקראית בין 3 קבוצות של חולות, כאשר בכל קבוצה ניתן טיפול שונה:
- בקבוצה הראשונה היו חולות שבהן לא נמושו בלוטות לימפה, והן עברו כריתת שד פשוטה והקרנות, ללא בדיקת בלוטות הלימפה וללא דגימה של הבלוטות.
- בקבוצה השנייה עברו החולות כריתת שד פשוטה ודגימה של בלוטות הלימפה ללא הקרנות.
- בקבוצה השלישית עברו החולות כריתת שד רדיקאלית.
לא נמצא כל הבדל בהיוותרות בחיים בין קבוצות 1 ו-3. לעומת זאת ההיוותרות בחיים של חולות שלא קיבלו הקרנות היתה קצרה יותר.
מכל האמור לעיל ברור שגם לצורכי קביעת שלב מחקרית של השאת ייתכן שמספיק לבצע כריתת בלוטות הלימפה באזורים I ו-II של בית השחי ואין צורך לבצע כריתה רדיקאלית של הבלוטות. הוצאת בלוטות הלימפה מאזורים I ו-II תקטין את שיעור החזרות המקומיות. לכן, לאור המידע מהספרות, די לבצע כריתת בלוטות הלימפה באזורים I ו-II. לעת עתה, לא ניתן להסתפק בדגימה של בלוטות לימפה נגועות, עקב שיעור החזרות המקומיות הגבוה אצל חולות בעלות בלוטות לימפה נגועות.
טכניקה
הגישה לכריתת בלוטות הלימפה מבית השחי תלויה בניתוח המתוכנן לחולה. בחולות העוברות כריתת שד (Mastectomy), הכניסה לבית השחי היא דרך אותו חתך של המסטקטומי. בחולות המתוכננות לעבור כריתת שד מקומית (Lumpectomy), הכניסה לבית השחי היא דרך חתך רוחבי בבית השחי, בקו השער שבין שריר החזה (Pectoralis) לשריר הגב הרחיב (Latissimus dorsi).
ההפרדה בין החתכים בעור נועדה ליצור הפרדה בין החללים של בית השחי והשד. הפרדה זו חשובה מכיוון שאת חלל בית השחי רצוי לנקז ואת החלל הנוצר בשד לאחר הלמפקטומיה אסור לנקז. לעיתים, כאשר חתך הלמפקטומיה הוא קרוב לבית השחי ויש אפשרות להגיע לבלוטות דרכו, לאחר הוצאת הבלוטות יש להפריד בין החללים על ידי תפירת החיתולית (Fascia) של בית השחי לשריר הפקטורלי. לאחר פתיחת הפאציה המחברת את השריר הפקטורלי אל הפאציה התת-עורית, נכנסים לשומן של בית השחי ומזהים את הווריד האקסילרי שמתחתיו יש לבצע את כריתת השומן. מנתקים את הוורידים ההולכים מהווריד האקסילרי לבית השחי, כאשר בחלק המדיאלי של הווריד מזהים ושומרים על מקלעת העצבים וכלי הדם של השריר הפקטורלי. מפרידים את השומן מדופן החזה - שריר המשור הקדמי (Serratus anterior) - ומזהים בשומן מאחור את ה- Long thoracic nerve, מפרידים אותו ומרחיקים אותו משדה הניתוח. לאחר מכן ממשיכים בהפרדת השומן מדופן החזה לכיוון השד ואז מזהים את ה- Intercostobrachial nerve היוצא מדופן החזה, חוצה את האקסילה לרוחבה ונכנס ליד. מבודדים את העצב מהשומן ומהבלוטות ושומרים עליו. מזהים את הלטיסימוס דורזי בגבול הלטרלי של בית השחי ואת מקלעת ה-Thoracodorsal המורכבת מהעצב וכלי הדם ללטיסימוס-דורזי, שאותם מפרידים מהשומן ושומרים. כל השומן שהופרד והבלוטות מאזורים I -II מוצאים מבית השחי. הניתוח מסתיים בהשארת נקז בבית השחי ותפירת התת-עור והעור.
דגימה של בלוטות בית השחי מתבצעת באותה גישה אלא שהפעם נכנסים לאזור I, מוציאים כ-10 דגימות מבית השחי וסוגרים את הפצע.
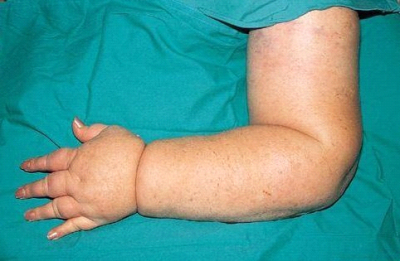
ב-70% מהחולות עם סרטן שד בדרגה 1 ו-2 לא נמצא בלוטות נגועות בגרורות של סרטן השד. חולות אלה עברו כריתת בלוטות נרחבת שלמעשה לא הועילה להן בהחלטה הטיפולית מחד גיסא, אולם יתכן והזיקה להן באחד הסיבוכים הקשורים לכריתת בלוטות כמו: לימפאדמה (תמונה 51.12א'), הפרעה תפקודית של חגורת הכתף ועוד. לכן, החוקרים חיפשו דרך שתאפשר זיהוי קבוצת החולות הזקוקות לכריתת בלוטות הלימפה ובהן לבצע את הכריתה, ולשאר המנותחות לשמר את הבלוטות. אמינותה של הבדיקה הקלינית היא נמוכה, ולכן אינה משמשת כמדד טוב להפרדה זו. בדיקות הדמיה שונות כמו: CT, מיפוי וכו', גם לא נמצאו אמינות דיו להפריד בין הקבוצות. ה-US, שבשנים האחרונות שיפר את יכולת הרזולוציה שלו, מאפשר כיום להגדיר בלוטות פתולוגיות (קורטקס מעובה והעלמות ההילוס של הבלוטה) ולבצע ביופסיה מחטית מונחת US של הבלוטה. גם בשיטה זו, תשובה חיובית מתקבלת, ואילו תשובה שלילית אינה מחייבת ולכן דורשת הוצאת בלוטות. ה-PET-CT גם הוא בדיקה טובה לבלוטות הלימפה. כשרואים קליטה בבלוטות במקביל לקליטה בשד, הרי הסבירות שהבלוטה נגועה קרובה ל-100%. אולם, הבעיה היא שרק 50% מהחולות עם סרטן השד קולטות FDG ולכן במחצית החולות בדיקה זו אינה יעילה. פתרון כירורגי המאפשר דגימה מצומצמת מאוד של בלוטות וקבלת מידע באמינות גבוהה מאוד הוא כריתת בלוטת הזקיף.
בדיקת בלוטת הזקיף - Sentinel lymph node biopsy
כריתת בלוטות הלימפה בבית השחי בחולות סרטן השד היא חלק בלתי נפרד מהטיפול הניתוחי בסרטן השד. מטרתה העיקרית של כריתה זו היא זיהוי של בלוטות נגועות כמדד פרוגנוסטי וכקריטריון למתן טיפול כימי-הורמונותרפי. כריתת הבלוטות הלא נגועות אינה משנה את מהלך סרטן השד. המחיר שהחולות משלמות - תופעות לוואי — שונה ותלוי ברדיקאליות הכריתה של הבלוטות. בכריתה הכוללת את כל שלושת האזורים של הבלוטות (Level I, II, III) שיעור הבצקות בגף (Lymphedema) הוא כ-30%, מהם כ-5% בצקות חמורות. בכריתות המקובלות כיום של אזורים II- I, שיעור הבצקות יורד לכ-10%, רובן בצקות קלות. זיהומים ביד לאחר כריתת הבלוטות בבית השחי מעלה את שכיחות הלימפאדמה. הפרעות תחושתיות בחלק הפנימי של היד עקב נזק ל- Intercostobrachial nerve וגיבנת (עקשת, Kyphosis) עקב פגיעה ב-Long thoracic nerve הם סיבוכים נוספים ששכיחותם תלויה במיומנות המנתח. סרומות בבית השחי, זיהומים, פיברוזיס של בית השחי עם תפיסת גידים וכו' מדווחים אחר כריתת בלוטות בבית השחי.
דגימה של בלוטות בית השחי (לפחות 10 בלוטות) מתבצעת על- ידי הוצאת 10 בלוטות ושליחתן לבדיקה. אם התוצאות שליליות, ההסתברות שכל הבלוטות שליליות היא 97%-95%. שיטה זו דורשת מיומנות גבוהה של המנתח בזיהוי הבלוטות וברוב המקרים מסתיימת בסילוק השומן ובלוטות בית השחי של אזור I.
Morton, בניסיון להגדיר קריטריונים לכריתת בלוטות הלימפה בחולי מלנומה עורית, פיתח את שיטת Lymphatic mapping and sentinels lymphadenectomy. ההנחה המונחת ביסודה של שיטה זו היא כי נגע מלנוטי המתנקז לבלוטות הלימפה עושה זאת באופן צנטריפוגלי ולכן זיהוי הבלוטות שאליהן אזור השאת מתנקז מאפשר להעריך את מצב שאר הבלוטות. אם בלוטות זקיף (Sentinels) אינן נגועות הסיכוי של בלוטות אחרות להיות נגועות שואף ל-0.
בשיטה זו מזריקים חומר צבע לאזור השאת וכעבור כ-20-15 דקות ניגשים אל בלוטות הלימפה האזוריות, מזהים את הבלוטות הצבועות וכורתים אותן. אם הבלוטות הללו לא נגועות, ההסתברות שקיימות בלוטות אחרות נגועות היא 1%-0%, ולכן ניתן להימנע מכריתת שאר הבלוטות. אם ה-Sentinel lymph node נגועות, קיימת הוריה לביצוע כריתה של בלוטות הלימפה האזוריות. שיטה זו הפכה כיום לשיטה סטנדרטית בקביעת הצורך לכריתה של בלוטות הלימפה האזוריות במלנומה עורית.
גוליאנו וחבריו בחנו שיטה זו גם ב- 174 חולות סרטן השד. הם דיווחו על זיהוי של ה- Sentinel lymph node ב-65% מהחולות, כאשר שיעור הזיהוי עולה עם הניסיון. ב-100%-96% מהחולות בלוטות הזקיף הציגו את המתרחש בבלוטות האחרות. ב-38% מהחולות בלוטות הזקיף היו הבלוטות הנגועות היחידות.
שיטה נוספת לזיהוי של בלוטות השומר היא הזרקה של חומר מסומן (רדיואקטיבי) לאזור השאת יום לפני הניתוח ובדיקת הבלוטות המנקזות את השאת. אם הן מתנקזות לבית השחי יש מקום להזריק חומר רדיואקטיבי סביב השאת כשעתיים לפני הניתוח ולבדוק באמצעות מצלמת קרני גמא את מקום הפליטה של הקרינה בבלוטות הלימפה בבית השחי. אזור הקרינה המירבי הוא זה שבו נמצאת בלוטת הזקיף. השילוב של הזרקת הצבע והחומר המסומן מגדיל את שיעור הזיהוי של בלוטות הזקיף לכדי 97%-95%.
הוצאת בלוטת הזקיף כתחליף להוצאת מכלול בלוטות הלימפה בבית השחי הפכה לשיטה מקובלת כיום בכירורגיה של סרטן השד. בין היתרונות הנמנים בשיטה זו נמצא: תחלואה נמוכה של חגורת הכתף, נדירות הופעת בצקת ביד, אין מגבלות שימוש ביד כפי שהן מומלצות בכריתה מלאה של בלוטות הלימפה, והבדיקה הפתולוגית שבודקת בלוטה בודדת או מספר בלוטות ולא מכלול בלוטות, היא יותר אינפורמטיבית ויותר קפדנית.
מבחינה טכנית יש מספר נקודות עליהם עלינו לעמוד:
- היכן להזריק?
- ישנן ארבע שיטות עיקריות:
- סביב השאת;
- באיזור העטרה מול השאת;
- בעור מעל השאת;
- בתוך רקמת השאת.
- כל השיטות הללו מקובלות ומוליכות במרבית המקרים אל אותה קבוצה של בלוטות לימפה. הסיבה לכך נעוצה כנראה בהתפתחות השד הנוצר מנבט (Bud) רקמתי קטן שלו מרכז התנקזות לימפתית מצומצם. עם התפתחות השד התפתחה רשת ענפה של צינורות ובלוטות בתוך וסביב השד המוליכה אל אותה קבוצה מצומצמת של בלוטות ומשם לבלוטות לימפה אחרות.
- מה להזריק?
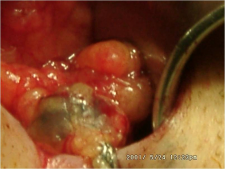
- ניתן להזריק חומר צבע הנספג במערכת הלימפתית וצובע את הבלוטות או חומר רדיואקטיבי המסמן את הבלוטות. בכל מקרה, החומר צריך להיות סגולי, כלומר להיספג רק למערכת הלימפתית. חומר הצבע מוזרק כעשר דקות לפני הניתוח סביב השאת ובניתוח ניתן לראות היטב את כלי הלימפה הצבועים ואת הבלוטות הצבועות (תמונה 51.12).
|
|
|
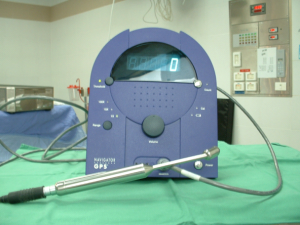
החומר הרדיואקטיבי מוזרק כארבע שעות עד 24 שעות לפני ניתוח. לאחר הזרקתו בעזרת מיפוי אפשר להדגים את מקום הבלוטה ולסמן את מיקומה על העור. ניתן להדגים גם בלוטות הקולטות חומר בשרשרת האינטרנל ממרי. בחדר ניתוח ניתן לאתר את הבלוטה בעזרת מונה גייגר על העור ובשדה הניתוח (תמונה 52.12).
|

|
חומרי צבע כאלה הם: Patent blue, Lymphozorin ו- Isosulfan blue. החומר הרדיואקטיבי הוא ננוקולואיד (ריניום) מסומן בטכנציום 99. יתרון הצבע הוא: מחירו הנמוך, זמינותו והיכולת להזריקו כ-10 דקות לפני הניתוח ולקבל צביעה של הבלוטות. חסרונותיו הם: בכ-14% מהמוזרקות לא ניתן לזהות את בלוטת זקיף, הצבע המוזרק מפריע בזמן ניתוח השד מכיוון שצובע את שדה הניתוח ותגובה אלרגית לחומר המדווחת ב-1 ל-1000 הזרקות הגורמת לשוק אנפילקטי חמור. יתרונות החומר הרדיואקטיבי הם: אמינותו הגבוהה יחסית לצבע בזיהוי בלוטות - 93%, היכולת לזהות בלוטות בשרשרת באינטרנל ממרי ושדה ניתוח נקי יחסית. חסרונותיו הם: מחירו הגבוה, הצורך במכשור יעודי יקר ומשך ההמתנה מההזרקה ועד מועד הסימון של הבלוטה.
רבים ממליצים על השימוש בשתי השיטות בו זמנית במטרה להגדיל שיעור הזיהוי של בלוטות הזקיף. אחרים נוקטים בגישות סלקטיביות של הזרקת חומר רדיואקטיבי, ובחדר ניתוח - במידה והקריאות על העור אינן טובות - הוספת חומר צבע. היתרון בשיטה הסלקטיבית היא הפחתת החשיפה לתופעות אלרגיות של חומר הצבע ושדה ניתוח נקי יותר. בדיקת בלוטת הזקיף יכולה להתבצע בכל חולות סרטן השד באמינות גבוהה והוריות נגד שנמנו בעבר כמו: שאת רב מוקדית, חולות חשודות קלינית לבלוטות נגועות, סרטן שד בשלב 3, אינן מהוות כיום הוראת נגד. רק בחולות בהן הוכחה נגיעות בבלוטות הלימפה על ידי ביופסיה מחטית יש לבצע כריתת בלוטות מקובלת ולא הוצאת בלוטת זקיף.
מספר הבלוטות המוגדרות כבלוטות זקיף הוא שונה. יש הגורסים שרק בלוטה אחת היא בלוטת הזקיף ויש הגורסים שמכלול הבלוטות הצבועות או אלה עם הקריאות עליהן הן בלוטות הזקיף. משמעות הגישה השנייה היא הוצאה מספר רב יחסית של בלוטות. עבודות הראו שהוצאת 4-3 בלוטות מגדילה בצורה משמעותית את אמינות הבדיקה הפתולוגית בזיהוי בלוטות נגועות.
הטיפול המקובל בחולות עם בלוטות זקיף נגועות הינו כריתה של שאר הבלוטות בבית השחי. ב-50% מהחולות עם בלוטת זקיף נגועה זוהי הבלוטה הנגועה היחידה. הסיכוי למצוא בלוטות נוספות נגועות הוא גבוהה יותר בחולות עם: בלוטות זקיף שלהן מאקרו-גרורה, גרורה שפרצה מעבר לקופסית הבלוטה, חולות עם שאת ראשונית גדולה וחדירה לימפו-וסקולרית.
סוגיית החתך הקפוא של בלוטת הזקיף בזמן הניתוח נדונה רבות בספרות. יתרון החתך הקפוא הוא האפשרות לזהות גרורה בזמן הניתוח ולהמשיך לכריתת מכלול הבלוטות ובכך למנוע את הצורך בניתוח חוזר. החיסרון הוא, שבחתך קפוא, אם קיימות גרורות קטנות הן יכולות להיהרס ולא ניתן יהיה לזהותם. היכולת לזהות גרורות קטנות בבלוטות בחתך קפוא שגרתי היא כ-50% בלבד. לכן, ההמלצה המתגבשת היא בדיקה פתולוגית של הבלוטה במאקרו. אם היא חשודה, יש לבצע חתך קפוא, ואם הבלוטה אינה חשודה, יש לבצע בדיקה רק לאחר שיקוע בפרפין.
מחקרים ראשונים אקראיים המבוצעים במספר מרכזים מראים, שלמרות הדיווחים על בדיקות שליליות כוזבות בשיעור של 10%-3%, שיעור ההישנות המקומית בבית השחי אינו שונה מזה של כריתת מכלול הבלוטות בבית השחי, והיוותרות בחיים ללא מחלה לשלוש שנים זהה בשתי הקבוצות. עדיין מוקדם להסיק מסקנות דומות לטווח הארוך. במספר מרכזים נבדק גם הצורך בהשלמה של כריתת הבלוטות בחולות עם בלוטת זקיף נגועה. במחקר של ה-Z0011 שפורסם ב-2011, הראו החוקרים בעבודה בה חילקו אקראית חולות עם בלוטה זקיף נגועה לכאלה שלא עברו כריתת בלוטות נוספת ולכאלה שעברו, שלא נמצא במעקב של 6 שנים הבדל ביניהם. מסקנת המאמר היא שבשאתות קטנות אין צורך להמשיך לכריתת מכלול הבלוטות בבית השחי גם אם בלוטת הזקיף נגועה.
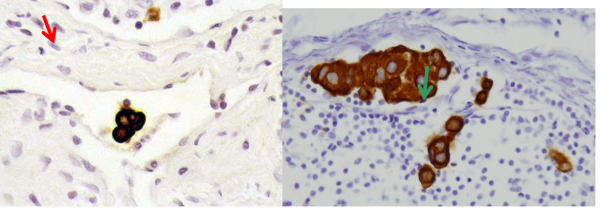
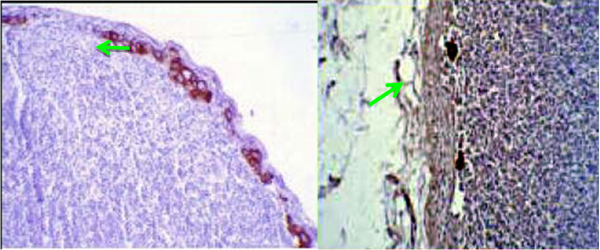
שיטת בלוטת הזקיף מאפשרת לפתולוג לעבד את הבלוטה בצורה טובה יותר (יותר חתכים) מה שגרם לזיהוי של יותר בלווטת כנגועות. בעיקר עלה שיעור הבלוטות הנגועות המאובחנות כבעלות מיקרו-גרורה (קבוצת תאים שגודלם בין 0.2-2 מ"מ) או על ידי תאים בודדים (קבוצות הקטנות מ- 0.2 מ"מ). הכנסת שיטות אימונוהיסטכימיות לזיהוי תאי אפיתל בבלוטה (צביעות ציטוקרטין – CK) העלה עוד יותר את שיעור הבלוטות הנגועות המאובחנות (תמונה 53.12 ו- 54.12). הסוגיה של המשמעות של תאים בודדים בצביעת ציטוקרטין אינה ברורה, כי הוכח שתאי אפיתל מתים יכולים להמצא גם בבלוטות תקינות, ולכן בשלב זה בלוטות עם גרורות הנראות רק ב-CK - ההתיחסות אליהם היא כאילו אין גרורות. בחולות עם מיקרו–גרורות נמצא שעם המיקרו-גרורה היא בבלוטה אחת, הסיכוי שנמצא עוד בלוטות נגועות הוא כ-15% , אולם ברובם תהייה זו בלוטה עם מיקרו–גרורה. לכן, מוסכם כיום שבחולות עם מיקרו-גרורות אין צורך להמשיך לכריתת מכלול הבלוטות בבית השחי.
ראו גם
- לנושא הקודם: סרטן השד - טיפול - היבטים כירורגיים - Breast cancer - treatment - surgical aspects
- לנושא הבא: שאתות ממאירות לא פולשניות - (Non-invasive breast cancer - (LCIS ,DCIS
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של הטחול
- לפרק הבא: בקעים
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן, מומחה בכירורגיה, מנהל היחידה לבריאות השד, מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק