טנאסין סי - Tenascin C
הופניתם מהדף Tenascin C לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| טנאסין סי | |
|---|---|
| Tenascin C | |
| שמות אחרים | TN-C |
| מעבדה | כימיה בדם ובנוזל סינוביאלי |
| תחום | מדד למצבים ממאירים ולתרחישים ראומטיים |
| טווח ערכים תקין | במבוגרים-רמה ממוצעת של TN-C בנסיוב-8.8±30.9 ננוגרם/מ"ל; רמה ממוצעת של TN-C בנוזל סינוביאלי-98.0±13.2 ננוגרם/מ"ל. בילדים-רמה ממוצעת של TN-C בנסיוב-21.3±15.2 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
Tenascin C (להלן TN-C) הוא גליקופרוטאין המקודד באדם על ידי הגן TNC (Nies וחב' ב-J Biol Chem משנת 1991, ו-Siri וחב' ב-Nucleic Acid Res משנת 1991). חלבון זה מבוטא במשתית החוץ-תאית (ECM) של מגוון רקמות במהלך ההתפתחות, מחלה או פציעה, וכן באזורים נוירוגניים מוגבלים של מערכת העצבים המרכזית (Midwood וחב' ב- Cell Mol Life Sciences משנת 2011, ו-Wiese וחב' ב-Front Pharmacol משנת 2012). TN-C הוא החבר "המייסד" של משפחת חלבוני tenascin. בעובר הוא נוצר על ידי תאים נודדים כגון אלה ברכס העצבי (neural crest), והוא גם שכיח ברקמות מתפתחות של גידים, עצם וסחוס. אכן, במקור TN-C התגלה בצומת גיד-שריר. משפחת חלבוני tenascin מורכבת מ-TN-C, TN-R, TN-X ו-TN-Y (Chiquet-Ehrismann ב-Experientia משנת 1995, ו-Hagios וחב' ב-Cell Res משנת 1999).
הגן TN-C ממוקם על הזרוע הארוכה של כרומוזום 9 במיקום 9q33. כל משפחת tenascin מקודדת על ידי אזור בכרומוזום 9 שאורכו 80kb המתורגם ל-2,203 חומצות אמינו (Gulcher וחב' ב-Proc Natl Acad Sci USA משנת 1991). הביטוי של TN-C משתנה מתקופת העוברות לתקופת הבגרות, כאשר בשלב האמבריוגני TN-C מבוטא מאוד, בעיקר בשלב האורגנוגנזה. לעומת זאת באיברים מפותחים, TN-C לא מבוטא או שהוא מבוטא בכמויות זעירות (Chiquet-Ehrismann ב-Int J Biochem משנת 2004). נמצא ש-TN-C משודרג מבחינת התבטאותו במצבים פתולוגיים הנגרמים על ידי דלקות, זיהומים, תהליכים סרטניים, או באזורים הנמצאים תחת לחצים ביו-מכניים (Webb וחב' ב-J Bone Miner Res משנת 1997).
הרגולציה של TN-C מושרית או מדוכאת על ידי מספר גורמים שונים הבאים לביטוי ברקמה עוברית, או בגורמים ברקמות מפותחות המושפעים מפציעה, ממאירות או מתהליכי remodeling (Jones & Jones ב-Matrix Biol משנת 2000). בין הגורמים הפעילים ברגולציה של TN-C ניתן לציין את TGF-β1, TNF-α, IL-1, nerve growth factor ו-keratinocyte growth factor (Rettig וחב' ב-Brain Res משנת 1989). מרכיבים אחרים של ECM כגון אינטגרינים גם הם לעיתים קרובות מבוטאים בו-זמנית עם TN-C (Akhurst וחב' ב-Development משנת 1990). בשלב ההתפתחות של ה-CNS, TN-C כרוך בשגשוג של תאים אסטרוציטים וכן של תאים קודמנים (precursors) של אוליגו-דנדטרוציטים. הביטוי של TN-C על ידי תאי גליה רדיאליים מקדים את תחילת ה-gliogenesis, כאשר בפרק זמן זה יש כנראה השפעה ל-TN-C על החשת ההתמיינות (דיפרנציאציה) של אסטרוציטים במוח הבוגר, הביטוי של TN-C פוחת פרט לאזורים בהם מתרחשת נוירוגנזה וכן בהיפותלמוס. TN-C נמצא גם בפציעה של ה-CNS וכן בגידולים מסוג glioma.
המבנה של tenascin C
TN-C הוא גליקופרוטאין בעל מבנה של hexamer המורכב משישה פוליפפטידים עם משקלים מולקולריים הנעים בין 180-300,000 דלטון. ארבעת החברים במשפחת tenascin הם בעלי מבנה דומה. המבנה כולל heptad, רצפים-חוזרים דמויי-EGF, מספר משתנה של מקטעים (domains) משומרים של fibronectin type III (בין 8–14), מקטע של fibronectin type III שעבר splicing באופן חלופי ומקטע C-טרמינאלי גלובולרי דמוי-פיברינוגן (Jones וחב' ב-Proc Natl Acad Sci USA משנת 1989).
מודולים חלבוניים אלה מחוברים ביניהם באופן היוצר מולקולות ארוכות. בקצה ה-N-טרמינאלי כל מולקולת tenascin מכילה מקטע הגורם לאוליגומריזציה, מה שיוצר את המבנה ההקסמרי האופייני. האיזופורמים TN-C ו-TN-R ידועים ככאלה הנתונים ל-alternative splicing. ב-TN-C באדם, קיימים בנוסף ל-repeats הקבועים, גם repeats נוספים החשופים ל-alternative splicing, מה גורם להבדלים המשמעותיים במשקל המולקולרי של המכלול שיכולים כאמור לנוע בין 180,000 ל-300,000 דלטון.
הרצפים של ה-heptad repeat מסייעים ליצירה של הֶקסמרים, שזו הצורה בה TN-C משוקע ברקמות (Chiquet-Ehrismann וחב' ב-Perspect Dev Neurobiol משנת 1994), ודרכם מגיב TN-C עם מולקולות נוספות ב-ECM כגון integrins, קולאגן, פרוטאוגליקנים, הפארין, syndecan ופיברונקטין. TN-C הוא בעל תפקיד חיוני בספיחת תאים, בנדידתם, בשגשוגם ובאיתות בינתאי (Midwood ו-Orend ב-J Cell Commun Signal משנת 2009). בנוסף, TN-C פועל כחלבון אלסטי שמסוגל להימתח מספר פעמים מגודלו ברגיעה, על ידי יכולת הקיפול של המקטעים דמויי-פיברונקטין type III שלו (Oberhauser וחב' ב-Nature משנת 1998).
התפקוד של TN-C
TN-C הוא חלבון מאוד רבגוני המסוגל לייצר פעילויות שונות באותו סוג תאים. שפע תפקודים אלה מושג על ידי alternative splicing של mRNA כמו גם על ידי השפעול של מסלולי-איתות ו/או גנים בשלבים השונים של גדילה והתמיינות. TN-C מסווג כחלבון האחראי למודולציה של ספיחה, כיוון שהוא נמצא כמעכב של ספיחה תאית לפיברונקטין. רבים מהמחקרים התפקודיים התבצעו במודלים שונים של עכברים knockout של TN-C. חלבון זה משחק בבירור תפקיד באיתות התאי, זאת על ידי יכולתו להיות מושרה במהלך אירועים כמו טראומה, דלקת והתפתחות תהליך סרטני. כמו כן, TN-C חשוב ברגולציה של שגשוג והתפשטות תאים, במיוחד בעת התמיינות תאם וריפוי של פציעה (Imanaka-Yoshida ב-J Pathol משנת 2002).
תגובות פיזיולוגיות ופתולוגיות המתווכות על ידי TN-C
TN-C מייצר השפעות שונות בסוגי תאים שונים ומסוגל לעודד איתותים מגוונים בעת ובעונה אחת. לעיתים שני סוגי תאים אף יגיבו בצורה הפוכה ל-TN-C. אחד התיאורים המוקדמים ביותר על פעילות TN-C התייחס ליכולתו לגרום למודולציה של ספיחת תאים למרכיבים אחדים של ה-ECM (Chiquet-Ehrismann ב- Cell משנת 1986). לדוגמה, הוא חוסם את ספיחת התאים המתווכת על ידי פיברונקטין, וכן הוא חוסם את התפשטות התאים על ידי התחרות עם syndecan-4 (Huang וחב' ב-Cancer Res משנת 2001). TN-C כשלעצמו יכול להיות מצע ספיחה חלש עבור תאים, והשפעול של איתות נוגד-ספיחה בתיווך annexin-II המושג דרך FNIII repeats A-D של TN-C, גורם לאיזופורמים הגדולים של TN-C להיות פחות ספיחים בהשוואה לאיזופורמים הקטנים של TN-C (Giblin ו-Midwood ב-Cell Adh Migr משנת 2015). התכונות נוגדות הספיחה של TN-C יכולות להיות מתוגברות או פחותות או אפילו להיעלם כליל על ידי איתותים נוספים בהם משתתפים LPAR או lysophosphatidic acid receptor, PDGFR או platelet-derived growth factor receptor, EDNRA ו-EDNRB או endothelin type A receptor ו-endothelin type B receptor, וכן על ידי ביקוע TN-C על ידי פרוטאזות (Ambort וחב' ב-Matrix Biol משנת 2010, Gunderson וחב' ב-J Immunol משנת 1997, ו-Lange וחב' ב-Cancer Res מהשנים 2007 ו-2008).
מרשתות ECM העשירות ב-TN-C הן בעלות יכולת פיקוח על תנועת תאים. לדוגמה, TN-C מעודד תנועת תאים ברכס העצבי (neural crest) (Akbareian וחב' ב-Dev Biol משנת 2013, ו-Tucker ב-Dev Dyn משנת 2001), כמו גם מעודד את נדידת תאי סרטן והתפתחות גרורות (Lowy ו-Oskarsson ב-Cell Adh Mig משנת 2015, ו- Saupeוחב' ב-Cell Rep משנת 2013). עם זאת, נמצא ש-TN-C מסוגל גם לעכב נדידת תאים, בעיקר במקרה של ה-growth cones או קודקודי הצמיחה (המכוונים את צמיחה האקסון והתארכותו לעבר מטרתו) (Faissner ב-Cell Tissue Res משנת 1997). TN-C הממוקם בסיבים הרטיקולריים של התימוס, מפקח על חדירת לימפוציטים לבלוטה זו, ונראה שהוא משתתף בהגדרת ההבשלה של לויקוציטים (Drumea-Mirancea וחב' ב-J Cell Sci משנת 2006). TN-C הוא מרכיב של המשתית החוץ-תאית הרכה יותר (Chiquet-Ehrismann ו-Chiquet ב-J Pathol משנת 2003), מה שמרמז לכך שפעילות מרכיב זה של המשתית פעילה במודולציה של תכונות מכניות של ה-ECM (Miroshnikova וחב' ב-Nat Cell Biol משנת 2016). TN-C משתתף במודולציה של מתח תאי על ידי שהוא פוגם בסיבי העקה של actin (Midwood ו-Schwarzbauer ב-Mol Biol Cell משנת 2002 ו-Ruiz וחב' ב-Cancer Res משנת 2004).
TN-C מעודד הישרדות של תאים קודמנים (precursors) של אוליגו-דנדרוציטים, על ידי שהוא מעודד את האיתות דרך FGFR אוfibroblast growth factor receptor, ובכך שהוא חוסם את BMP4 או bone morphogenic protein (Garcion וחב' ב-Development משנת 2004), במקביל נמצא ש-TN-C יכול להשרות אפופטוזיס בתאי שריר חלק על ידי ה-repeats דמויי-EGF שלו (Wallner וחב' ב-Artersclr Thromb Vasc Biol משנת 2004). TN-C גם מסייע או בולם את השגשוג של תאי סרטן ושל פיברובלסטים (Orend וחב' ב-Oncogene משנת 2003), תהליך בו TN-C ופיברונקטין מתחרים על הקישור ל-syndecan-4. בתאי גזע סרטניים, TN-C מסייע לשגשוג (Fukunaga-Kalabia וחב' ב-Oncogene משנת 2010) או להתמיינות לתאים עם תכונות אנדותליאליות (Pezzolo וחב' משנת 2011).
אינטראקציות של TN-C
נמצא ש-TN-C מגיב עם פיברונקטין (Chung וחב' ב-J Biol Chem משנת 1995 ו-Jones וחב' באותו כתב עת משנת 1997). אינטראקציה זו היא בעלת פוטנציאל לשנות את יכולת הספיחה של תאים (Tremble וחב' ב- Mol Biol Cell משנת 1994). אינטראקציית solid-state בין TN-C ופיברונקטין גורמת להגברת הביטוי של אנזימים ממשפחת ה-matrix metalloproteinase (Yokosaki וחב' ב-J Biol Chem משנת 1996). TN-C גם מגיב עם אחד או יותר קולטנים שלו על תאים באופן המשפעל או מדכא את אותו מסלול של העברת איתותים. דוגמה של אינטראקציה זו היא הספיחה של תאי SW80 carcinoma ל-repeat פיברונקטין השלישי של TN-C דרך הקולטן של αvβ3 integrin, המוליך להתפשטות התא, לפוספורילציה של מולקולות כגון paxillin, focal adhesion kinase ו-ERK2 MAPK, ולשגשוג תאי סרטן אלה (Erickson ב-Curr Opin Cell Biol משנת 1993). בניגוד לכך, כאשר אותם תאים עושים שימוש ב - α9β1 integrins או ב- αvβ6 integrins להיספח לאותו type III repeat של פיברונקטין, יש החלשה של התפשטות התא, ולא מתרחש שפעול של תווכים מאותתים אלה או שגשוג התאים.
משמעות קלינית של TN-C
TN-C ממשיך להיחקר כסמן פוטנציאלי של מספר מחלות כגון myocarditis ומספר סוגי סרטן. המעורבויות השונות של TN-C עם תפקוד תאי ואיתותים תאיים הופכים את TN-C לחלבון פופולרי ללימוד של תרפיות שונות. מחקר עדכני הראה ש-TN-C מעכב הדבקה עם HIV על ידי קישור לאתר chemokine co-receptor על פני חלבון המעטפת של HIV-1, ועל ידי כך חסימה של הנגיף לתאי הפונדקאי (Fouda וחב' ב-Proc Natl Acad Sci USA משנת 2013).
TN-C מבוטא בשפע ברקמות שריריות-שלדיות, במהלך האמבריוגנזה ואורגנוגנזה, בעוד שהביטוי שלו ברקמות בריאות מצומצם ביותר. TN-C מופיע בצורת וריאנט עם משקל מולקולרי גבוה בתהליכי ריפוי פצעים, במצבי דלקת, או בממאירות (Chiquet-Ehrismann וחב' ב-Cell משנת 1986, ו-Yoshida וחב' ב-Wirchows Arch משנת 1989). TN-C כרוך ביצירה של סחוס ארטיקולרי, אך ביטויו מופחת באופן בולט בעת תהליך ההבשלה של כונדרוציטים (Mackie ו-Murphy ב-Microsp Res Tech משנת 1998, ו-Pacifici וחב' ב-Dev Dyn משנת 1993), וכמעט נעדר בסחוס הבשל (Chevalier וחב' ב-Arthritis Rheum משנת 1994, ו-Veje וחב' ב-Osteoarthritis Cartilage משנת 2003). TN-C מבוטא שוב בחוזקה בסחוס ובסינוביום של מפרקים דלקתיים או פצועים (Salter ב-Br J Rheumatol משנת 1993, Pfander וחב' ב-J Rheumatol משנת 1999, ו-Goh וחב' ב-J Immunol 2010 משנת 2010).
השפעת TN-C על תאי סרטן
TN-C נכרך עם מספר סוגי סרטן שונים כגון osteosarcoma (על פי Tanaka וחב' ב-Int J Mol Med משנת 2000), וכן chondrosarcoma (על פי Ghert וחב' ב-Oncology משנת 2001), סרטן שלפוחית השתן (Brunner וחב' ב-J Clin Pathol משנת 2004), ו-glioblastoma (על פי Herold-Mende וחב' ב-Int J Cancer משנת 2002). בתאי גליובלסטומה הביטוי של TN-C הוא בעל משמעות קלינית ותפקודית במושגים של התפשטות הנגע הסרטני והפרוגנוזה של התהליך. המאגר האנדוגני של האיזופורמים של TN-C בגליומות, תומך בשגשוג התאים הסרטניים ונדידתם. כיוון ש-TN-C חיוני להישרדות של סוגי התאים הסרטניים השונים, הביטוי שלו עשוי להוות סמן לגילוי סוגי סרטן אלה. כמו כן, נוגדנים כנגד TN-C שימשו לאבחן ולייצר תרפיות לסוגי סרטן רבים (Daniels וחב' ב-Proc Natl Acad Sci USA משנת 2003, ו-Orend ו-Chiquet-Ehrismann ב-Cancer Lett משנת 2006).
הביטוי המוגבר של TN-C בסטרומה של סוגי סרטן שונים נסקר בהרחבה על ידי Midwwood ו-Orend ב-J Cell Commun Signal משנת 2009). התקדמות מרשימה הושגה באפיון האיזופורמים השונים של TN-C כתוצאה מ-splicing, המופיעים ברקמות סרטניות ספציפיות שונות ובהבנת תפקידם בתהליכים גרורתיים (Pezzolo וחב' ב-Cell Res משנת 2011).
מעורבות TN-C בתהליך ה-angiogenesis הסרטני
על מנת לסייע להתפשטות הגידול הסרטני, הגידול צריך לגרות יצירת כלי-דם צעירים בפריפריה של הגידול הסרטני, לצורך אספקת חומרי הזנה חיוניים לתאי הסרטן אנגיוגניות יכולה להיות מגורה על ידי היפוקסיה, ואלמנטים במשתית החוץ-תאית (ECM) במיקרו-סביבה של הגידול (Baeriswyl ו-Christofori ב-Semin Cancer Biol משנת 2009). מחקרים רבים הוקדשו לפתח גישות אנטי-אנגיוגניות "להרעבת" הגידול הסרטני ולהביא להתכווצותו. אחד התכשירים בתחום זה הוא bevacizumab (שם מותג Avastin), אלא שטיפולים אנטי-אנגיוגניים היו רק בעלי יעילות חלקית, במספר סוגי סרטן עמידים, וכן מוּכּרים תהליכי "הימלטות" מפעילות תכשירים אלה, מה שאף מגביר את התהליך הגרורתי.
בעבר אותר TN-C במיקום סב-וסקולארי של glioblstoma multiforme (להלן GBM) (על פי Herold-Mende וחב' ב-J Cancer משנת 2002). עלתה ההשערה שאיזופורמים שונים של TN-C יכולים להיות ממוקמים סביב כלי-דם המספקים חומרים חיוניים לגידולי-סרטן (Neri ו-Bicknell ב-Nar Rev Cancer משנת 2005, ו-Brack וחב' ב-Clin Cancer Res משנת 2006). בגליומות לדוגמה, אושר המיקום של TN-C בכלי-דם (Martina וחב' ב-FASEB J משנת 2010). הוצע שתאים פּריציטים עשויים להיות המקור של TN-C, בגין המיקום הזהה של תאים אלה עם תאים יוצרי desmin. באופן עקבי, הודגמה צביעה אימונו-ריאקטיבית חזקה של TN-C בקרצינומות של תאי כליה וכן בסרטן ריאות, בקרבה רבה לתאי-אנדותל חיוביים ל-CD31 (על פי Berndt וחב' ב-Histochem Cell Biol משנת 2010).
שני מחקרים עדכניים בלתי-תלויים הוקדשו להבנת הסביבה הסב-גידולית של כלי-דם בגישות פרוטאומיות (Borgia וחב' ב-Cancer Res משנת 2010, ו-Hill וחב' ב-J Proteome Res משנת 2011). המחקר הראשון היה מבוסס על מודל סינגני-הטרוטרופי של גרורות של סרטן המעי הגס לכבד. נמצא שדגימות מהכבד המכיל גרורות שנבחנו והושוו עם אלה של חיות בריאות, הכילו באופן ספציפי איזופורמים גדולים של TN-C (שבהרכביהם נמצאים מקטעים A4, A2, A1 ו-B). המחקר השני היה מבוסס על טכנולוגיית laser הקוטעת פיסות מיקרוסקופיות של מבנים וסקולאריים מרקמה של ductal breast carcinoma חודרנית, ומלווה על ידי מס-ספקטרומטריה. במחקר זה, גידולים עשירים בכלי-דם, הושוו לרקמה הלא- ממאירה הסמוכה, ונמצא שכלי הדם הקטנים הסמוכים לשאת הסרטנית, הכילו 86 חלבונים מבוטאים-ביתר, כולל את TN-C. ניסויים אלה מדגישים את חשיבות TN-C כסמן חזק של כלי-דם המזינים את הגידול, ויכול אם כך לשמש להדמיה של גידולים, וכן כיעד קליני התערבותי.
רמות TN-C בנוזל הסינוביום מוגברות לאחר פציעה במפרק והן תואמות סמני דלקת ופירוק המשתית הסחוסית
קיים מתאם בין רמות TN-C בנוזל המפרקי לבין דרגת הפירוק של הסחוס הפגוע (Schmidt-Rohlfing וחב' ב-Scand J Rheumatol משנת 2002), וכן עם החומרה של osteoarthritis (על פי Hasegawa וחב' ב-J Rheumatol משנת 2004). ל-TN-C תפקיד בגירוי של יצירת ציטוקינים דלקתיים במקרופאגים באדם, ובפיברובלטים ב-synovium בעת השפעול של TLR4 (או toll-like receptor-4) (על פי Midwood וחב' ב-Nat Med משנת 2009). קולטני TLR4 נמצאים בממברנות תאים והם בעלי תפקיד מרכזי בתגובה החיסונית המורשת. קולטני TLR4 מזהים מבנים על דפנות חיידקים, ומאתחלים רצף של תהליכים תוך-תאיים המייצרים תגובה חיסונית.
בשנת 2013 התפרסם ב-Osteoarthritis & Cartilage מחקרם של Chockalingam וחב', שעקבו אחר ההפרשה של TN-C לתוך נוזל הסינוביום של הברך לאחר פציעה חמורה או כתוצאה ממחלת המפרק, ובחנו האם קיים מתאם בין רמות הפרשה זו לבין סמנים מקובלים של הרס סחוס מפרקי או מצבי דלקת במפרק. במחקר זה נאספו 164 דגימות נוזל מסינוביום הברך ממספר משתתפים במצבים דלהלן: אנשים ללא כל פגיעה בברך, מקרים של קרע ברצועה הצולבת הקדמית של הברך, עם או ללא נגעים בו-זמניים במניסקוס, מקרים של פגיעה מבודדת במניסקוס הברך, מקרים חריפים של ארתריטיס דלקתית, ומקרים של אוסטאו-ארתריטיס של הברך. רמות TN-C נמדדו בשיטת ELISA. תוצאות המחקר הראו רמות מוגברות של TN-C באופן משמעותי סטטיסטית בכל המצבים הפתולוגיים שהוזכרו, בהשוואה לנוזל של קבוצת הביקורת הנורמלית. כמו כן נמצא מתאם טוב בין רמות TN-C לבין שני סמנים דוגמת מקטעים של Ala-Arg-Gly-aggrecan ו-MMP-1 ו-MMP-3. מסקנת בעלי המחקר היא שרמת TN-C בנוזל מפרק הברך לאחר פציעה או מצבי דלקת יכולה לשמש מדד ראוי בדומה לסמנים המקובלים.
רמות TN-C ב-Juvenile Idiopathic Arthritis
Juvenile Idiopathic Arthritis (להלן JIA) הוא מפגע דלקתי-כרוני עם התבטאויות ארטיקולריות וחוץ-ארטיקולריות מגוונות. JIA פוגע ב-1 מחוך 1,000 ילדים, והוא מהווה סיבה מובילה למגבלות נרכשות בקרב ילדים (Ravelli ו-Martini ב-Lancet משנת 2007). ל-JIA יש 7 קטגוריות, ולמרות שברחבי העולם הקטגוריה הנפוצה ביותר היא האוליגו-ארטיקולרית, הרי שבדרום-מזרח אסיה הקטגוריה הנפוצה ביותר היא ה-enthesitis-related arthritis (להלן ERA) על פי Kunjir וחב' ב-J Rheumatol משנת 2010). הפתוגנזה של ERA אינה ברורה, אך בניגוד למחלות ראומטיות אחרות, לא זוהו ב-ERA אוטו-נוגדנים או תאי T אוטו-פעילים, זאת למרות קשר חזק עם HLA-B27.
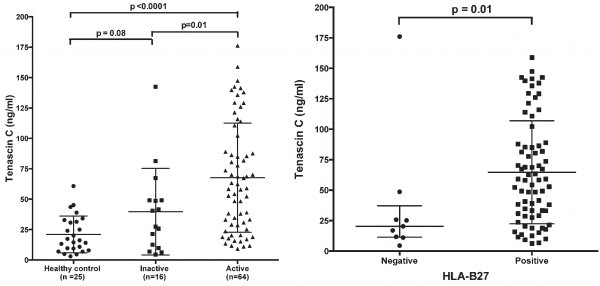
Shukla וחב' ב-J Rheumatol משנת 2015, בחנו את רמות TN-C בנסיוב ובנוזל הסינוביאלי של ילדים עם ERA. זאת כיוון שמונוציטים של ילדים עם ERA מראים ביטוי-יתר של הקולטן TLR4, וידוע ש-TN-C הוא גליקופרוטאין חוץ-תאי המגיב כליגנד של TLR4 אנדוגני. במחקר השתתפו 80 ילדים עם ERA, מתוכם 15 ילדים היו במעקב בהיותם מטופלים עם תכשירים נוגדי-דלקת לא סטרואידליים (NSAIDs), ורמות TN-C בהם נמדדו 3 חודשים מתחילת הניסוי. מדגם הניסוי כלל 25 דגימות נסיוב שהתקבלו מילדים בריאים, וכן 17 דגימות של נסיוב מילדים מאובחנים עם ERA. תוצאות הניסוי היו כדלקמן: רמה ממוצעת בנסיוב של TN-C בילדים עם מחלה פעילה נקבעה כ-67.1±44.9 ננוגרם/מ"ל, שהייתה גבוהה משמעותית מהרמה הממוצעת שלו בילדים עם מחלה לא-פעילה (40.6±36.7 ננוגרם/מ"ל, p=0.01), או ברמה הממוצעת של TN-C בילדים בריאים (21.0±15.2 ננוגרם/מ"ל, p<0.001). הרמה הממוצעת של TN-C הייתה גבוהה יותר בדגימות נסיוב של נבדקים חיוביים ל-HLA-B27 (58.4 ננוגרם/מ"ל) בהשוואה לאלה שנמצאו שליליים ל-HLA-B27 (20.4 ננוגרם/מ"ל, p=0.001).
רמות TN-C נמצאו במתאם מתון עם פעילות המחלה: המתאם לגבי הערכת הרופא (r=0.4); המתאם לגבי early morning stiffness (r=0.34); המתאם לגבי מפרקים רגישים (r=0.4); המתאם לגבי מפרקים נפוחים (r=0.46); המתאם לגבי שקיעת דם מוחשת (r=0.42); המתאם לגבי C-reactive protein מוגבר (r=0.32). טיפול של 3 חודשים ב-NSAIDs לירידה משמעותית ברמות TN-C בנסיוב (p=0.0003). רמת TN-C בנוזל הסינוביאלי ירדה אף היא לרמה ממוצעת של 17.39 ננוגרם/מ"ל הנמוכה משמעותית מרמת מדד זה בנוזל סינוביאלי שמקורו בילדים שלא טופלו (p=0.01). (תרשים למטה):
השימור הגבוה של TN-C במהלך האבולוציה והביטוי המאוד מוקפד שלו, מצביעם על תפקידו הפיזיולוגי החשוב. עם זאת TN-C מבוטא גם באופן עקבי במספר גדול של מצבים פתולוגיים כולל דלקות כרוניות וסרטן. המעורבות של TN-C במחלות דלקתיות כרוניות, תורמת לחומרת מחלות אלו באדם ובעכבר (Udalova וחב' ב-Crit Rev Immunol משנת 2011). מאות מחקרים שהתפרסמו מצביעים על תפקידו של TN-C בסיוע להתפשטות גידולים סרטניים ויצירת גרורות. לדוגמה, במודל של עכבר בו הגידולים מכילים שפע של TN-C או שאינם מכילים אותו כלל, נמצא שנוכחות TN-C עודדה הישרדות של תאי סרטן, שגשוגם, כושר החדירות שלהם ויצירת גרורות, זאת בהשוואה לעכברים שלא הכילו TN-C. גם באדם יש הסכמה על תפקידו של TN-C בעידוד התהליך הסרטני (Lowy ו-Oskarsson ב-Cell Adh Mig משנת 2015). הביטוי הבולט של TN-C בתהליך האנגיוגני מחמיר את הישרדות החולים (Langlois וחב' ב-Oncotarget משנת 2014). אחת הדוגמאות הבולטות היא ההשפעה התומכת באנגיוגניות בתאי גליובלסטומה (Rupp וחב' ב-Cell Rep משנת 2016). TN-C יכול לסייע להישרדות של תאי סרטן השד והגעתם לתאי הפרנכימה של הריאות. TN-C מסייע לנדידת התאים הסרטניים במנגנון הידוע כ-EMT או endothelial –to-mesenchymal transition וכן על ידי שפעול של EGFR על ידי ה-EGF-like repeats (Shao וחב' ב-Cell Adh Migr משנת 2015).
הוראות לביצוע הבדיקה
אין צורך בהכנות מוקדמות של הנבדק או בצום. נטילת הדם במבחנה כימית (פקק צהוב או אדום) וסרכוז ללא שיהוי בצנטריפוגה מקוררת. אחסון הנסיוב בקירור יציב למשך 14 יום, ואחסונו בהקפאה תשמור על יציבות הדגימה עד 60 יום. לגבי נוזל סינוביאלי יש להקפיד ככל הניתן על מניעת הכתמתו בדם, ובכל מקרה יש לסרכז מיד להרחקת כדוריות אדומות. יש לאחסן לא למעלה מ-14 יום בקירור. הקפאה פחות רצויה. הבדיקה מתבצעת בשיטת ELISA.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - מחלות ריאומטיות
- בדיקות מעבדה - נוזל שדרה
- בדיקות מעבדה - סמנים סרטניים
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק