Ubiquitin carboxy-terminal hydrolase L1
| מדריך בדיקות מעבדה | |
| Ubiquitin carboxy-terminal hydrolase L1 | |
|---|---|
| שמות אחרים | UCH-L1, NEURON-SPECIFIC PGP9.5 |
| מעבדה | כימיה בדם |
| תחום | הערכת נזקים מוחיים ונוירודגנרציה; אפשרות להערכת ממאירות. |
| טווח ערכים תקין | פחות מ-0.5 ננוגרם/מ"ל. |
| יוצר הערך | פרופ' בן-עמי סלע |
תפקיד פיזיולוגי
האנזים UCH-L1 הוא חבר במשפחת גנים שתוצריהם מבצעים הידרוליזה של תלכידים C-טרמינאליים קטנים של ubiquitin, ליצירת מונומרים של ubiquitin. הביטוי של UCH-L1 מאוד ספציפי לנוירונים ולתאים של המערכת הנוירו-אנדוקרינית הדיפוזית ולגידולים הסרטניים שלהם. האנזים UCH-L1 נמצא בכל הנוירונים ומהווה 1-2% מכלל החלבון המוחי המסיס (Wilkinson וחב' ב-Science משנת 1989), ומופיע גם בתאי האשך/שחלה (Doran וחב' ב-J Neurochem משנת 1983). שלושת חומצות האמינו המהוות את ה"טריאדה הקטליטית" של האנזים האחראית לפעילותו ההידרוליטית, הן שייר ציסטאין בעמדה 90, חומצה אספרטית בעמדה 176 והיסטידין בעמדה 161 (על פי Das וחב' ב-Proc Natl Acad Sci USA משנת 2006). האנזים UCH-L1 יציב בפני פעילות פרוטאוליטית. הגן המקודד ל-UCH-L1 ממוקם על הזרוע הקצרה של כרומוזום 4 בעמדה 4p13.
המבנה של האנזים
ל-UCH-L1 יש משקל מולקולרי של 24,000 דלטון (Martens ב-Acad Emerg Med משנת 1996, Jackson ו-Thompson ב-J Neurol Sci משנת 1981 ו-Wilkinson וחב' ב-Biochem Soc Trans משנת 1992). Day ו-Thompson שיבטו את ה-UCH-L1 cDNA וקבעו שהחלבון אותו כינו PGP9.5 מכיל 212 חומצות אמינו (FEBS Lett משנת 1987). האנזים האנושי UCH-L1 כמו גם החלבון המקורב אליו UCH-L3 הם בעלי המבנה ה"עניבתי" המסובך ביותר לגבי חלבון כלשהו, עם 5 קשרי "עניבה". קיימת השערה שמבנה רב-קשרים זה מגביר את עמידות החלבון לפירוק ב-proteasome (על פי Peterson ב-Science News משנת 2003, ו-Virnau וחב' ב- PLoS Computational Biology משנת 2006). הקונפורמציה של החלבון UCH-L1 יכולה כמו כן לשמש ראיה חשובה להגנה שהוא מעניק למערכת העצבים, או הסיוע לפתולוגיה שלה כאשר אנזים זה חסר או פגום. לדוגמה, נמצא שהדימר UCH-L1 יכול להפגין פעילות של ligase שהיא בעלת פוטנציאל פתולוגי מה שעלול להוליך להגברת הצימות (aggregation) של α-synuclein (על פי Liu ב-Cell משנת 2002).
למרות ש-UCH-L1 מכיל רק 223 חומצות אמינו, הוא אחד החלבונים עם הקונפיגורציה התלת-ממדית המסובכת ביותר. מעבר לביטוי שלו בנירונים, מבוטא UCH-L1 רק באופן מוגבל ביותר ברקמות בריאות אחרות, אך הוא מבוטא באופן נמרץ במספר סוגי סרטן. למרות ש-UCH-L1 מוגדר כ-deubiquitinating enzyme (להלן DUB) התפקודים הישירים שלו עדיין אניגמטיים, וכך הוצעו לו מספר תפקודים חלופיים.
אינטראקציות של האנזים
האנזים UCH-L-1 נמצא מגיב עם COP9 constitutive photomorphogenic homolog subunit 5, ואף חשוב מכך עם α-synuclein החלבון המשתתף בפתולוגיה של מחלת פרקינסון. פעילות זו נובעת כתוצאה מפעילות ה-ubiquityl ligase שלו, שעלולה להיות קשורה עם המוטציה הפתוגנית I93M. הודגם ש-UCH-L1 מגיב עם ה-E3 ligase, פרקין (parkin). ידוע ש-parkin נקשר וגורם ל- ubiquitinylation של UCH-L1 ובכך מסייע לפירוק הליזוזמלי של האנזים (McKeon וחב' ב- Cell Mol Life Sci משנת 2015).
התְּפוּצָה של UCH-L1
התפוצה הרקמתית של UCH-L1 היא בעיקר בתוך המוח, אך ניתן לגלותו גם בבלוטות המין, וכמות מועטה עוד יותר תחת מצבים ייחודיים בפיברובלסטים במהלך ריפוי פצעים. חשוב ביטוי חלבון זה בתאים סרטניים, שמקורם ברקמות שבדרך כלל אינן מבטאות אותו, כולל סרטן הלבלב, המעי הגס והחלחולת, וסרטן שד מפושט (Tezel וחב' ב-Cancer Res משנת 2000, Yamazaki וחב' באותו כתב עת משנת 2002, ו-Miyoshi וחב' ב-Cancer Sci משנת 2006). ברמת הריכוז התאי, UCH-L1 נצבע באופן חזק ואחיד בציטופלזמה של נוירונים על פני המוח כולו (Day ו-Thompson ב-Prog Neurobiol משנת 2010), והוא גם נצבע בתאים תחושתיים ומוטוריים גדולים (Wilson וחב' ב-Br J Exp Pathol משנת 1988).
UCH-L1 ממוקם בעיקר בגופי התאים של נוירונים בכל המוח, מה שהופך אותו סמן אטרקטיבי לנזק עצבי, והוא מזוהה כסמן היסטולוגי עצבי והווה 5-10% מכלל החלבונים הציטופלזמטיים בנוירונים ובתאים נירו-אנדוקריניים (Day ו-Thompson ב-Prog Neurobiol משנת 2010, ו-Larsen וחב' ב-Biochemistry משנת 1998). ברמה התפקודית, UCH-L1 הוא חלבון נפוץ רב-תפקודי, הכרוך עם הישרדות תאים, טרנספורט אקסונלי, ומודולציה של מסלול ה-ubiquitin-proteasome בנוירונים (Coulombe וחב' ב-Front Aging Neurosci משנת 2014, Gong וחב' ב-Cell משנת 2006, Lombardino וחב' ב-Proc Natl acad Sci USA משנת 2005, Poon וחב' ב-J Biol Chem משנת 2013, Setsuie ו-Wada ב-Neurochem Int משנת 2007, Shen וחב' ב-Apoptosis משנת 2006 ו-Zhang וחב' ב-J Neurochem משנת 2012).
ביטוי אקטופי של האנזים
למרות שהביטוי של UCH-L1 ספציפי לנוירונים ולרקמת האשך/שחלה, הוא נמצא גם באחדים משורות התאים שבודדו מסרטן הריאות (Liu וחב' ב-Chem Biol משנת 2003). ביטוי בלתי-נורמאלי זה של UCH-L1 נכרך בתהליך הסרטני, והוביל להתייחסות אל UCH-L1 כאל אונקוגן (Hussain וחב' ב-Leukemia משנת 2010). יתרה מכך, יש ראיות לכך ש-UCH-L1 יכול לשחק תפקיד בפתוגנזה של המפגע הכלייתי membranous glomerulonephritis, שכן ביטוי de novo של UCH-L1 בפודוציטים נמצא ב-post herpatic neuralgia, שהוא המודל בחולדות של membranous glomerulonephritis באדם (Meyer-Schwesinger ב-J Pathol משנת 2009). משערים שביטוי זה של UCH-L1 משרה לפחות באופן חלקי היפרטרופיה של הפודוציטים (Lohmann וחב' ב-Biochim Biophys Acta משנת 2014).
הערכת מפגיעה מוחית טראומטית על ידי מדידת רמת UCH-L1
פגיעה טראומטית מוחית (להלן TBI) מייצגת תרחיש גלובלי חמור. בארצות הברית מדי שנה מדווחים על 1.7 מיליון TBIs, מתוכם 52,000 מסתיימים במוות (Faul וחב' בדו"ח של ה-CDC משנת 2010). חומרת ה-TBI מדורגת על ידי ה-Glasgow Coma Scale, (להלן GCS) כקלה (GCS 13-15), מתונה (GCS 9-12), או חמורה (GCS 3-8). אך דרוג GCS עלול לתת הערכת-יתר או חסר לגבי חומרת הפגיעה הנירולוגית במקרי TBI, שכן במהלך 24 שעות לאחר הפגיעה דרוג זה עלול להיות שגוי בהשפעת הרדמה, מתן משככי כאבים, שיתוף פעולה לקוי עם המטופל, וריתמיוּת פיזיולוגית צירקדיאנית (Yue וחב' ב-Neurobiol Sleep Circadian Rhythms משנת 2016, La Rosa וחב' ב-Spinal Cord משנת 2004).
בפברואר 2018, נתן ה-FDA אישור לבדיקת הדם הראשונה שעשויה לסייע להעריך את חומרת מקרי זעזוע מוח במבוגרים. זעזועי מוח, המוגדרים גם כפגיעה מוחית מתונה עד טראומטית, יכולים להיגרם מחבטה, חבלה או מפציעה חודרנית, ועלולה להסתיים בפגיעה בתפקוד המוחי, כדוגמת איבוד הכרה, איבוד זיכרון, רגישות-יתר לאור או לרעש, או איבוד שיווי משקל. את חומרת זעזוע המוח קשה לעיתים קרובות להעריך, כיוון שהסימנים והתסמינים עלולים להופיע תוך שעות או אף ימים לאחר הפגיעה ועלולים להתבטא באופן שונה מאדם לאדם. אלה הנבדקים בחשש של זעזוע מוח עוברים בחינה נוירולוגית להערכת גורמים כגון כאבי ראש, כאבי צוואר, תחושת טשטוש, בחילות והקאות. בהמשך, בדיקת CT של הראש עשויה להתבצע לבחון אפשרות של דימום מוחי, או פגיעה רקמתית שדורשים טיפול התערבותי הולם, ואפילו פרוצדורה ניתוחית.
בדיקת הדם האמורה שאושרה על ידי ה-FDA, קרויה BTI או Brain Trauma Indicator, מסייעת לקבוע האם יש צורך בבדיקת CT באנשים החשודים לזעזוע מוח. בבדיקה זו נמדדים 2 חלבונים ספציפיים למוח, GFAP או glial fibrillary acidic protein ו-UCH-L1 או ubiquitin C-terminal hydrolase, המופרשים במהירות לדם על ידי המוח תוך 12 שעות לאחר פגיעה מוחית חמורה. תוצאות הבדיקה עשויות להתקבל תוך 3–4 שעות, כאשר רמות נמוכות של 2 מדדים אלה בדם, מצביעות על כך שגם יש נזק מוחי הוא קטן מדי מכדי שיתגלה ב-CT. לעומת זאת, אם רמות 2 מדדים אלה בדם גבוהות, יש אינדיקציה לביצוע CT. על פי מפתחי בדיקת BTI, יש בה למנוע בדיקות CT מיותרות בשיעור של 33%, ובכך להימנע מחשיפה מיותרת של הנבדקים לקרינה הכרוכה ב-CT.
ה-FDA ביצע הערכה של נתונים ממחקר שכלל 1,947 דגימות דם של מבוגרים החשודים לזעזוע מוח. בהשוואת נתוני בדיקות CT מצאו אנשי ה-FDA שבדיקת BTI זיהתה באופן נכון את דרגת הנזק המוחי שנגרם ב-97.5% מהנבדקים, וזיהתה באופן נכון את אי הנזק ב-99.6% מהנבדקים. תקופת ההערכה של בדיקה מוצעת זו על ידי אנשי ה-FDA נמשכה פחות מ-6 חודשים שכן הבדיקה הוגדרה כ-Breakthrough Devices Program, וזכתה לטיפול מואץ.
מטה-אנליזה להערכת הערך האבחוני של UCH-L1 במקרים של TBI
ההנחיות העכשוויות הם לביצוע בדיקת CT ללא חומר ניגוד כהערכה אבחונית של קו-ראשון, וחזרה על מבחני הדמיה כאשר התוצאות המתקבלות אינן סדירות. יש ראיות לכך שבדיקת CFT מתבצעת בתדירות מוגזמת ביחידות טיפול נמרץ, ויש צורך דחוף למדד זמין, בלתי מזיק, פשוט וזול לביצוע, שיהיה רגיש דיו לאבחן מטופלים עם TBI המועמדים להתערבות נירו-כירורגית. מדד זה אמור להצביע על תוצאים ארוכי-טווח של הפגיעה, ולספק ראיות על התאוששות המוח. הוכנסו לשגרת המעבדה סמנים ביוכימיים אחדים, כמו החלבון הבסיסי של מיאלין (MBP), וכן neuron-specific enolase (או NSE), ו-glial protein S-100β ו-synaptotagmin, ו-αII/βII spectrins, וכן UCH-L1 (על פי Pineda וחב' ב-J neurotrauma משנת 2006, ו-Ringger וחב' באותו כתב-עת משנת 2004).
לפיכך ערכו Shahjouei וחב' מטה-אנליזה שהקיפה 13 מחקרים שכללו 1,606 מקרי TBI ו-11,419 מתנדבים כביקורת. חלק ממחקרים אלה מדדו רמת UCH-L1 בנסיוב, ואחרים מדדו רמה זו בפלזמה או אף ב-CSF או בשיטת ELISA או על ידי ECA-IA (או electro-chemiluminiscence immunoassay). מטה-אנליזה זו מצביעה על UCH-L1 כמדד בעל רמת דיוק גבוהה בניבוי תוצאות CT במקרים של TBI קל-עד-מתון. רמת UCH-L1 בפלזמה הייתה בעלת דיוק מתון כאשר הוערכה בכל הרמות של GCS. עם זאת, כיוון שהמחקרים השונים שנכללו במטה-אנליזה זו הניבו דרגות שונות של דיוק אבחוני של מדד זה, יש צורך במחקרים נוספים שיידרשו על מנת להמליץ עליו כחלופה לסריקת CT.
מחקר רב-מוסדי לבדיקת המשמעות שלUCH-L1 בהערכת TBI פורסם על ידי Papa וחב' ב-Crit Care Med משנת 2010. במחקר זה נמדדה רמתUCH-L1 בנוזל השדרה של 66 מטופלים (מתוכם 41 עם TBI חמור או GCS 8≥, ו-25 נבדקי ביקורת בריאים. דגימות CSF נלקחו מכל נבדק לאחר 6, 12, 24, 48, 72, 96, 120, 144 ו-168- שעות לאחר ה-TBI, ובוצעו בהם גם בדיקות CT של המוח. נמצא שבאלה עם TBI, רמות UCH-L1 ב-CSF היו גבוהות משמעותית בכל נקודת זמן בהשוואה לדגימות מאנשים בריאים. הרמה הכללית הממוצעת של UCH-L1 ב-CSF בפגועי-TBI הייתה 44.2±7.9 ננוגרם/מ"ל, בהשוואה ל-0.7±2.7 ננוגרם/מ"ל בדגימות הביקורת (p<0.001). היה מתאם טוב בין הרמות הנמדדות לחומרת TBI.
במחקר נוסף של Papa וחב' ב-J Trauma Acute Care Surg משנת 2012, השתתפו 295 מטופלים מהם נלקחו דגימות נסיוב: מתוכם 96 מטופלים עם TBI (כאשר ל-86 מתוכם נקבע 13–15 GCS, ול-10 נקבע 9–12 GCS). כמו כן היו 199 נבדקי ביקורת. הגיל הממוצע של משתתפי המחקר היה 39 שנה ו-60% מתוכם היו גברים. דגימות הנסיוב נלקחו במהלך 4 שעות ממועד התאונה/פגיעה גולגולתית, הרמה הכללית הממוצעת שלUCH-L1 בכל נפגעי TBI (בננוגרם/מ"ל) נקבעה כ-0.955 (תחום של 0.015-19.25( לעומת 0.083 (תחום של 0.015-0.490) בנבדקי הביקורת.
במקור זוהה UCH-L1 בשיטה מס-ספקטרומטית-פרוטאומית כמוגבר בקליפת המוח הפגועה של מודל חולדה של TBI, תוך 48 שעות לאחר הפגיעה היזומה (Kobeissy וחב' ב-Mol Cell Proteomics משנת 2006). מאז, UCH-L1 זוהה הן בנוזל השדרה ובדם של מודל חולדה לפגיעה קליפתית, ותוך 4–24 שעות לאחר פגיעה בליסטית חודרנית בשלושה מודלים של חולדה (Liu וחב' ב-Eur J Neurosci משנת 2010, ו-Mondello וחב' ב-J Neurotrauma משנת 2016).
ל-UCH-L1 מייחסים גם תפקיד בהרחקה או בהוספה של ubiquitin מחלבונים הנועדים לפירוק והשמדה במסלול ה-proteasome התלוי ב-ATP. לפיכך הוא עשוי להיות סמן מבטיח של נזק עצבי (Brophy וחב' ב-J Neurotrauma משנת 2011, Papa וחב' ב-JAMA Neurol משנת 2016, Zhang וחב' ב-Int J Med Sci משנת 2015, Huang וחב' ב-J Neurotrauma משנת 2015, Douglas-Escobar וחב' ב-Front Neurol משנת 2014, ו-Mondello וחב' ב-BMC Neurol משנת 2012). החלבון UCH-L1 שהוא חלבון קטן יחסית משתחרר מהר מנוירונים פגועים ונכנס ל-CSF ולדם. מחקרים קודמים הציעו את השימוש בו במפגעים כמו שטף-דם תת-עכבישי (SAH) על פי Lewis וחב' ב-J Neurosci Res משנת 2010), באנצפלופתיה על רקע היפוקסי-איסכמי (Douglas-Escobar ב-Pediatr Res משנת 2010, וסמן במקרים חמורים של TBI (על פי Mondello וחב' ב-Neurosurgery משנת 2012, Blyth וחב' ב-J Neurotrauma משנת 2010, ו-Berger וחב' באותו כתב עת משנת 2012).
מחקר רב-מוסדי רב-לאומי של Bozarian וחב' נערך בין השנים 2014 ל-2014 ברוצ'סטר NY, מינכן, דטרויט, סנט לואיס מיזורי, Szeged הונגריה, וירג'יניה, סן דייגו ומרילנד, על מנת לבחון את הערך של UCH-L1 בניבוי התוצאה של הדמיית CT לאבחון של TBI. משתתפי המחקר היו מעל גיל 18 שנה, שהגיעו לחדרי מיון עם חשש ל-TBI בלתי חודרני ו-GCS של 9–15. המשתתפים היו ראויים להיכלל במחקר אם הם עברו בדיקת CT כחלק מההתנהלות השגרתית בחדר מיון, וגם נלקחה מהם דגימת דם במהלך 12 מהפציעה הגולגולתית. ערך ה-cutoff לגבי UCH-L1 נקבע כ-0.327 ננוגרם/מ"ל. מחקר זה כלל 1,959 משתתפים, מתוכם ב-125 (6%) נמצאו חיוביים לפגיעה תוך מוחית בבדיקת CT, כאשר בשמונה מהאחרונים (1%>), הנזק הצדיק התערבות נוירוכירורגית. כאשר מדידת UCH-L1 נעשתה במשולב עם מדידת רמת GFAP, תוצאת הבדיקה המשולבת הייתה חיובית ב-1,288 נבדקים (66%), ולגבי 671 מהנבדקים (34%) תוצאת הבדיקה המשולבת הייתה שלילית. הבדיקה המשולבת הייתה בעלת רגישות של 0.976, וערך ניבוי שלילי (NPV) של 0.996. רק בשלושה מהנבדקים (1%>) תוצאת CT לגבי נזק מוחי הייתה חיובית כאשר תוצאת הבדיקה המשולבת של UCH-L1 ו-GFAP התקבלה שלילית.
הריכוזים בנסיוב של UCH-L1 ושל GFAP לאחר פגיעה מוחית טראומטית בילדים
מחקרים שנעשו במבוגרים הראו עלייה ברמת UCH-L1 בנסיוב לאחר נזק מוחי טראומטי (Brophy וחב' ב-J Neurotrauma משנת 2011, Mondello וחב' ב-Neurosurg משנת 2012, ו-Berger וחב' ב-Neurotrauma משנת 2012). ילדים, מטבע הדברים מרבים לסבול מחבלות ראש, לכן חיוני במיוחד החיפוש אחר סמנים לחבלות טראומטיות בהם, שיסייעו בהתנהלות הטיפולית הדחופה. Mondello וחב' פרסמו ב-Sci Reports משנת 2016 את מחקרם בו נכללו 45 ילדים עם אבחון קליני של טראומה מוחית (GCS 3-15), ו-40 ילדים בריאים, שנמדדה בנסיוב שלהם רמת UCH-L1. ניסוי זה מצא עלייה משמעותית ברמת חלבון זה, ויתרה מכך התברר ש-UCH-L1 מוגבר בנסיוב גם במקרי טראומה מוחית שלא ניתנת לגילו בבדיקת CT. כן נמצא ש-UCH-L1 טוב יותר לאבחון פגיעה מוחית מאשר מדדים דוגמת S100B ו-myelin basic protein.
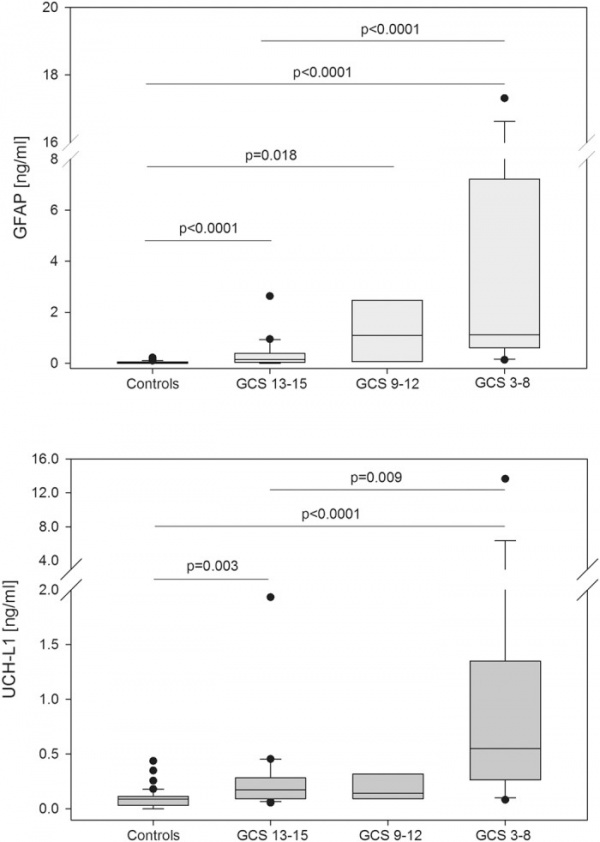
Mondello וחב' במחקרם Sci Rep משנת 2016, מדדו את רמות UCH-L1 ו-GFAP במדגם של 45 ילדים עם אבחון קליני של TBI עם GCS 3-15, ושל 40 ילדים תואמי-גיל בריאים, תוך הערכת משמעות רמות אלו עם האפיונים הקליניים והתוצאים, והשוו את ביצועיהם עם אלה של 2 מדדים ותיקים, S100B ו-MBP. מחקר זה מצא רמות גבוהות של GFAP ושל UCH-L1 בילדים עם פגיעה חוחית בהשוואה לביקורת, אף רמות אלה היו במתאם עם חומרת TBI, והיו טובות יותר מאשר רמות S100B ו-MBP.
להלן ממצאי המחקר: הגיל הממוצע של הילדים הנבדקים עם TBI היה 3.8 שנה והגיל הממוצע בקבוצת הביקורת היה 3.7 שנה, כאשר 62% מכלל הנבדקים עם TBI היו בנים, בעוד 58% מקבוצת הביקורת היו בנים. בקבוצת הפגיעה המוחית ב-19 ילדים (42%) ה-TBI היה חמור, 6 ילדים (13%) נקבעו עם TBI מתון, וב-20 ילדים (45%) ה-TBI היה קל. בין 45 המקרים, ב-10 (22%) התקבלו תוצאות CT שליליות, וב-6 מתוכם (13%) נקבע שבר בגולגולת ללא פגיעה מוחית. הטבלה למטה מראה את חציוני הרמות של ארבעת הסמנים של TBI.
| מקרים (n = 45) | ביקורת (n = 40) | P value | |
|---|---|---|---|
| GFAP (ng/ml) | 0.48 (0.12–1.67) | 0.01 (0.00–0.05) | <0.0001 |
| UCH-L1 (ng/ml) | 0.23 (0.12–0.55) | 0.09 (0.03–0.11) | <0.0001 |
| S100B (ng/ml) | 0.03 (0.02–0.06) | 0.02 (0.015–0.023) | <0.0001 |
| MBP (ng/ml) | 0.15 (0.03–0.21) | 0.17 (0.08–0.21) | 0.39 |
הדיוק האבחוני של UHC-L1 ושל GFAP להבדיל בין נפגעי TBI לבין ילדי קבוצת הביקורת היה טוב (AUC של 0.86 ו-0.89, בהתאמה). הרגישות של UHC-L1 ושל GFAP נקבעה כ-100% ו-89%, בהתאמה, אם כי הספציפיות הייתה נמוכה יחסית (20% ו-63%, בהתאמה).
מגמה בעלת משמעות סטטיסטית גבוהה (0.0001p<) לגבי הגברת הריכוזים של UCH-L1 ושל GFAP בהתאמה לחומרת TBI. בעיקר ילדים עם TBI חמור היו בעלי רמות מוגברות משמעותית של UCH-L1 ושל GFAP בהשוואה לילדים עם TBI קל (חציון GFAP נקבע כ-1.12 לעומת 0.15 ננוגרם/מ"ל, p<0.0001, וחציון UCH-L1 נקבע כ-0.55 לעומת 0.18 ננוגרם/מ"ל, P=0.009), יתרה מכך רמות UCH-L1 ו-GFAP היו גבוהות משמעותית בילדים עם TBI קלה, בהשוואה לילדים הבריאים.
רמת UCH-L1 עם הגעת הילד הפגוע למיון עם תוצאים לא טובים, הייתה משמעותית גבוהה יותר מאשר בילדים שתוצאי ה-TBI שלהם היו אופטימיים (חציון UCH-L1 נקבע כ-0.92 לעומת 0.18 ננוגרם/מ"ל, בהתאמה, P=0.0005. הדיוק האבחוני של UCH-L1 לגבי תוצאי הפגיעה היה 0.86. ערך cutoff של 2.22 ננווגרם/מ"ל הביא לספציפיות אבחונית של 100%, אך עם רגישות נמוכה של 22%.
ubiquitinating enzymes (או BUBs)
Ubiquitin מורחק מחלבוני המצע שלו על ידי DUBs. בגנום האנושי ישנם בערך 90 DUBs, שמתוכם קבוצת ה-UCH מכילה 4 חלבונים. כל אחד מה-UCHs מכיל מקטע peptidase בקצה ה-N-טרמינלי שלו, הארכה של הקצה ה-C-טרמינלי, וכן לולאה המווסתת את זמינות המצע לאתר הקטליטי. ניסויים in vitro מראים שה-UCH DUBs מבקעים את התוספות הפפטידיות של הקצה ה-N-טרמינלי כמו גם את ה-ubiquitin הקשור לקצה ה-N-טרמינלי מחלבוני המצע שלו (Bett וחב' ב-Biochen J משנת 2015, וכמו כן הוצע ש-HCHs יכולים לגרום ל-deubiquitination של נוקלאופילים קטנים דוגמת גלוטתיון (GSH), העובר שינוי בציטופלזמה (Rose ו-Warms ב-Biochemistry משנת 1983, ו-Wing ב-J Biochem Cell Biol משנת 2003).
משפחת ארבעת ה-ubiquitinating enzymes (או BUBs)
- לקוח מ-Bishop וחב' ב-Biochem J משנת 2016
| UCH DUB | מס' חומצות אמינו | הארכת ה-C terminal | תפקיד |
|---|---|---|---|
| UCH-L1 | 223 | קצרה | כרגע ספקולטיבי. מבוטא בעיקר במוח, באשכים ובשחלות. |
| UCH-L3 | 233 | קצרה | בעל הומולוגיה של 52% עם UCH-L1, אך נפוץ ברקמות גוף רבות. |
| UCH-L5 | 329 | מקטע סיבי המגיב עם תת-היחידה Rpn13 של 26S proteasome | החבר היחיד במשפחת UCH בעל תפקיד ישיר בתפקוד הפרוטאזום, ואחראי לפעילות Lys48 ubiquitin isopeptidase |
| BAP1 | 729 | תוספת ארוכה המכילה Nuclear locaizaion Signal | משחק תפקיד ב-ubiquitination של היסטון, ב-remodeling של כרומטין, ובוויסות פעילות BRCA1 |
UCH-L1 ותחלואה
תאים פיתחו מספר מנגנונים על מנת להתמודד עם חלבונים פגומי-מבנה, בעיקר על ידי שימוש במנגנון דגרדציה של חלבונים אלה על ידי מערכת ubiquitin כולל יצירה של aggresomes ואִתחוּל של מסלולים אוטופאגים (Kesidou וחב' ב-Neural Regen Res משנת 2013). אך כאשר תהליכים אלה נכשלים כפי שהדבר קורה בנוירונים במצבים מתמשכים של עקה, הם עלולים לתרום לפּתוגנזה של המפגע (Larsen ו-Sulzer ב-Histopathol משנת 2002, ו-Rami ב-Appl Neurobiol משנת 2010). צברי החלבונים הנוצרים במחלות נירו-ניווניות רבות עשירים ב-ubiquitin שכן חלבונים אלה סומנו על ידי ubiquitination כמועמדים להשמדה (Yao ב-Cancer משנת 2010, ו-Ross ו-Poirier ב-Nat Med משנת 2004).
מוטציה ב-UCH-L1 באדם
זוהתה מוטציה נקודתית, Glu7Ala, ב-UCH-L1, כגורם לניוון עצבי מוקדם בשלושה אחאים שנראו נורמליים בלידתם, אך התעוורו בגיל 5 וסבלו מתפקוד עצבי לקוי ומתקדם כמו גם מ-cerebellar ataxia שמנעה מהם אפשרות לעמוד בהגיעם לגיל 30 שנה (Bilguvar וחב' ב-Proc Natl Acad Sci USA משנת 2013). לא נצפתה אצלם כל פגיעה מחוץ למערכת העצבים. שייר Glu7 ב-UCH-L1, חיוני לקישור ל-ubiquitin (על פי Das וחב' ב-Proc Natl Acad Sci USA משנת 2006). פנוטיפ האטקסיה באנשים עם פגם בהתקשרות UCH-L1 ל-ubiquitin מרמזת לכך שהדגנרציה האקסונלית הנצפית במודלים של עכברים, נובעת מאובדן התקשרות זו.
הרלוונטיות של UCH-L1 למפגעים נוירו-ניווניים
מוטציה נקודתית (I93M) בגן המקודד לאנזים זה, נצפתה כסיבה למחלת פרקינסון במשפחה גרמנית אחת, אם כי ממצא זה שנוי במחלוקת שכן לא נמצא חולה פרקינסון נוסף הנושא מוטציה זו (Leroy וחב' ב-Nature משנת 1998, ו-Harhangi וחב' ב-Neurosci Lett משנת 1999). יתרה מכך, פולימורפיזם (S18Y) בגן זה נמצא קשור לסיכון מופחת למחלת פרקינסון (Wang וחב' ב-Movement Disorders משנת 2002). פולימורפיזם זה נמצא באופן ספציפי להיות בעל פעילות נוגדת-חמצון (Kyratzi וחב' בכנס על אנזים זה משנת 2008). פעילות נוספת עם פוטנציאל הגנתי של UCH-L1 היא יכולתו לייצב את ה-monoubiquitin שהוא מרכיב חשוב במערכת ה- ubiquitin proteasome. סבורים שעל ידי ייצוב המונומרים של ubiquitin ועל ידי כך מניעת פירוקם, מגדיל UCH-L1 את הזמינות של מאגר ה-ubiquitin לסימונם של חלבונים כמועמדים לפירוק ב-proteasome (על פי Osaka וחב' ב- Hum Mol Genet משנת 2003).
הגן הזה כרוך גם במחלת אלצהיימר, והוא נחוץ לתפקוד סינפטי וקוגניטיבי תקין (Gong וחב' ב-Cell משנת 2006). האיבוד של UCH-L1 מגדיל את הרגישות של תאי-β בלבלב לאפופטוזיס, מה שמצביע על כך שאנזים זה ממלא תפקיד הגנתי על תאים נוירו-אנדוקריניים ומדגיש את הקשר בין סוכרת לבין מחלות נוירו-ניווניות (Chu וחב' ב-Diabetologia משנת 2012). חולים עם הופעה מוקדמת של מפגעים נוירו-ניווניים בהם המוטציה הסיבתית הייתה בגן ל-UCH-L1 ובעיקר בקטע E7A הנקשר ל-ubiquitin, עלולים לסבול מעיוורון, אטקסיה צרבראלית, ניסטגמוס, פגיעה בתפקוד של המסילה הדורזאלית, ופגיעה בתפקוד הנוירוני-מוטורי (Bilguvar ב-Proc Natl Acad Sci USA משנת 2013).
UCH-L1 ומחלות נירו-ניווניות
ניתוחים פרוטאומיים הצביעו על כך ש-UCH-L1 עובר מודיפיקציה חמצונית הן במחלת אלצהיימר כמו גם במחלת פרקינסון. המסיסות של UCH-L1 פוחתת על ידי החמצון של שיירי ציסטאין ומתיונין, ויצירת קרבוניל (Choi וחב' ב-J Biol Chem משנת 2004, ו-Castegna וחב' ב-Free Rad Biol Med משנת 2002). כן נמצא שהגדלת חוסר המסיסות של UCH-L1 נמצאת במתאם עם מספר ה-tangles האימונו-פעילים של tau (על פיde Vrij וחב' ב-Prog Neurobiol משנת 2004, ו-Donovan וחב' ב-Proteomics Clin Appl משנת 2012). המודל APP/PS1 בעכברים של אלצהיימר, מייצר בעודף Aβ, מראה פיזור דומה של UCH-L1 מסיס ובלתי מסיס, לזה שמוצאים במוח אנשים חולי אלצהיימר, עם ירידה מדווחת של 20% בפעילות ההידרוליטית in vitro (על פי Gong וחב' ב-Cell משנת 2006). מבחינה מנגנונית, סביר שהמעבר מהצורה המסיסה לצורה הבלתי-מסיסה של UCH-L1 ואובדן הפעילות ההידרוליטית נגרמים ממודיפיקציה חמצונית ההורסת את צורתו המקורית, וגורמת לנטייתו לעבור צימות (Kim וחב' ב-PLos One משנת 2014, ו-Kohardin וחב' ב-Proc Natl Acad vSci USA משנת 2010).
UCH-L1 ומחלת פרקינסון
לפני אובדן של נירונים דופמינרגיים בפרקינסון יש יצירה של גופי Lewy, שהם חלקיקים חלבוניים בלתי-מסיסים זעירים, העשירים בצברים שעברו ubiquitination, וכן מבטאים מודיפיקציה חמצונית נרחבת (Spillantini וחב' ב-Proc Natl Acad Sci USA משנת 1997). רוב המקרים של פרקינסון מתרחשים באופן אקראי, אם כי קיימות מספר צורות של המחלה בעלות נטייה משפחתית, ואחדות מצורות אלו יוחסו למוטציות גנומיות ספציפיות, כולל אלה ב-UCH-L1 (על פי Tofaris ו-Spitallini ב-Mov Disord משנת 2005).
הנוכחות של UCH-L1 בגופי Lewy ותפקידו במסלול הפרוטאזום, מרמזים למעורבותו במחלת פרקינסון. במשפחה גרמנית עם מחלת פרקינסון טיפוסית, זוהתה מוטציית missense בגן של UCH-L1, מוטציה בה שוחלף איזולאוצין בעמדה 93 על ידי מתיונין (Leroy וחב' ב-DNA Res משנת 1998). מוטציה זו גרמה לאיבוד חלקי של הפעילות הקטליטית של UCH-L1. חוקרים אלה הציעו שמוטציה זו עלולה לגרום לצימות של חלבונים, אם כי Healy וחב' שוללים אפשרות זו בכך שתוצאותיהם של Leroy וחב' לעולם לא זכו לאישור של מעבדה אחרת (Ann Neurol משנת 2006). ריצוף של כל האזור המקודד של הגן של UCH-L1 ב-11 משפחת עם מחלת פרקינסון בהן נצפתה תורשה אוטוסומאלית-דומיננטית, גילה פולימורפיזם באזורים שאינם מקודדים, כאשר השינוי היחיד בחומצות האמינו היה S18Y או Ser18Tyr (על פי Licoln וחב' ב-Neuroreport משנת 1999). אך הסתבר שהאלל S18Y מופיע בכ-20% של הכרומוזומים של האוכלוסייה הלבנה, לכן לא סביר שיש ל-S18Y קשר לפתוגניות, מסקנה שהתבססה על מספר מטה-אנליזות שכללו במקובץ 6,594 פרטים.
פעילות UCH-L1 כמווסת של טומורוגניות
למרות ש-UCH-L1 בא לביטוי כמעט אקסקלוסיבי בתאי עצב, הולך ומתברר שחלבון זה נמצא גם בגידולים שונים באדם כגון אדנוקרצינומה (Shen וחב' ב-Clin Cancer Res משנת 2002), וכן ductal carcinoma של הלבלב (Tezel וחב' ב-Clin Cancer Res משנת 2000), ב-osteosarcoma (Liu וחב' ב-Cancer Invest משנת 2002), קרצינומה של ה-parathyroid (Adam וחב' ב-Oncologist משנת 2000), וקרצינומה של תאי הקשקש (Mastoraki וחב' ב-Int J Surg Pathol משנת 2009). בדומה, בשיטת microarray נמצא ש-mRNA של UCH-L1 מוגבר במספר סוגי סרטן שד (Miyoshi וחב' ב-Cancer Sci משנת 2006), ובקרצינומה מֶדוּלרית של התירואיד (Takaco וחב' ב-Eur J Cancer משנת 2006). נמצא ש-mRNA של UCH-L1 מוגבר גם בגידולים של כיס המרה ובסרטן המעי הגס והחלחולת כתוצאה מהיפּו-מתילציה של ה- UCH-L1 promoter (Li וחב' ב-Cancer Sci משנת 2006, ו-Mizukami וחב' ב-Anticancer Res משנת 2008).
הנוכחות של UCH-L1 ברקמות סרטניות לא עִצבּיות ובשורות תאים שמקורן בגידולי ריאה, ערמונית שלפוחית השתן ואוסטאוסרקומה, מעידות על כך שרמות גבוהות של UCH-L1 יכולות לעודד התמרה אונקוגנית בפתוגנזה של סרטן. התפקיד האונקוגני הפוטנציאלי של UCH-L1, נתמך על ידי מספר מחקרים המראים שרמה זו נמצאת במתאם עם הישרדותם של החולים (Akishima-Fukasawa וחב' ב-Am J Clin Pathol משנת 2010), וכך לדוגמה, mRNA מוגבר של UCH-L1 בגידולים של המעי הגס והחלחולת כרוכים בשיעור גבוה יותר של הִישנוּת הגידול ועם משך הישרדות קצר יותר. כדי לקבוע האם בּיטוי-יתר של UCH-L1 הוא תוצאה של ההתמרה הסרטנית, או שמא הוא עצמו הכוח המניע של טומורוגניות, בוצעו מחקרים in vitro שהראו ש- UCH-L1מעודד התמרה סרטנית וחוֹדרנוּת ב-NCLC (Kim וחב' ב-Oncogene משנת 2009) ובסרטן המעי הגס, כלומר החלבון האחרון יכול לפעול כאונקוגן בסוגי סרטן אלה. יתרה מכך, Hussain וחב' הראו ב-Leukemia משנת 2010, שעכברים טרנסגניים המבטאים UCH-L1 תחת בקרה של הפרומוטר CAGGS, יוצרים גידולים ספּורדיים בכל הרקמות, כאשר מבין גידולים אלה הלימפומות הן השכיחות ביותר.
הוצע ש-UCH-L1 תומך בתנועה ובחודרנוּת של תאי סרטן, וביטוי-יתר של חלבון זה בתאי HCT8 שמקורם בסרטן המעי הגס, הגביר את התנועתיוּת של תאים אלה (Ma וחב' ב-J Cell Biochem משנת 2010). גם Kim וחבר במאמרם משנת 2009, הראו שפגיעה ב-UCH-L1 בתיווך של siRNA, הפחיתה in vitro את הנדידה של תאי H157 שמקורם בקרצינומה של הריאה. בנוסף, נמצא ש-UCH-L1 מעודד את הנדידה של תאי סרטן הערמונית (Jang וחב' ב-cancer Lett משנת 2011). באופן דומה, תאי LNCaP ו-RWPE1 שמקורם בסרטן הערמונית, והם מאופיינים על ידי נדידה איטית, אינם מכילים ,UCH-L1 בעוד שתאי DU145, אף הם מסרטן הערמונית, הנחשבים גרורתיים ביותר מכילים בעודף את UCH-L1.
UCH-L1 מספק אסטרטגיה אנטי-גרורתית הודות להשפעתו על-deubiquitination של HIF-1α
מחקרם של Goto וחב' ב-Nat Commun משנת 2014, בחן את הקשר בין UHC-L1 לבין HIF-1α (או hypoxia-inducible factor 1 שהוא גורם המשחק תפקיד בתהליכים ממאירים גרורתיים. לא זוהו הגנים המשפעלים את HIF-1 ומעודדים יצירת גרורות. במחקרם זה הראו Goto וחב' ש-UCH-L1 מבטל את ה-von Hippel-Lindau mediated ubiquitination של HIF-1alfa, שהיא תת-היחידה הרגולטורית של HIF-1, ועל ידי כך מעודדת יצירת גרורות. ביטוי-יתר שגוי של UCH-L1 מקל על יצירת גרורות באיברים רחוקים, באופן התלוי ב-HIF-1, במודלים במכרסמים של גרורות לריאות. בשלב זה, חסימת הציר UCH-L1-HIF-1α מדכאת את יצירת הגרורות. רמות הביטוי של UCH-L1 תואמות את אלו של HIF-1α, והן כרוכות בחוזקה עם פרוגנוזה גרועה במאובחנים עם סרטן השד וסרטן הריאות. תוצאות אלו מצביעות על UCH-L1 כמעודד גרורות, בתוקף היותו אנזים הגורם ל-deubiquitination של HIF-1α, מה שמצדיק ניצול UCH-L1 כסמן פרוגנוסטי וגם כיעד טיפולי במחלות סרטניות.
UCH-L1 כנוגד חמצון
המורפולוגיה המורכבת של נוירונים מכתיבה יחס גבוה של ממברנה לציטופלזמה, והסינפסות מחייבות יחס גבוה של חומצות שומן בלתי-רוויות המווסתות את הנזילות של הממברנה (Treen וחב' ב-Biochim Biophys Acta משנת 1982). אלא שחומצות שומן בלתי-רוויות רגישות לפראוקסידציה של ליפידים (Imre וחב' ב-Stroke משנת 1994), מה שמחייב את הנוירונים למנגנונים נוספים לוויסות המטבוליזם של ליפידים ולהגביל את הנזק החמצוני. אכן, UCH-L1 הוצע כנוגד חמצון בנוירונים על ידי Spillantini וחב' במחקר המצוטט למעלה משנת 1997. תפקיד זה עשוי להסביר את המציאות של UCH-L1 בלתי מסיס בעל קונפורמציה פגומה במחלות נוירו-ניווניות רבות (Nagamine וחב' ב-Neurochem Int משנת 2010). השערה אחת היא שהשייר המשומר Cys152 פועל כבופר redox בנוירונים ומגיב וקושר רדיקאלים חופשיים כדי לשמר תפקוד תאי לזמן קצר.
ברוח השערה זו, תאי N2a המטופלים עם antisense UCH-L cDNA, על מנת לשכך את הביטוי של UCH-L1, היו רגישים יותר למוות כתוצאה מחסר חמצן וגלוקוזה (Shen וחב' ב-Apoptosis משנת 2006). באופן כללי, ההשערה האחרונה מציעה שעודף ב-UCH-L1 המסיס בציטופלזמה, מאפשר את הקישור והנטרול של מולקולות עתירות חמצן (ROS) במצב של נזק חריף לנוירונים, מה שמאפשר לתאים אלה להמשיך לתפקד.
הוראות לביצוע הבדיקה
דגימת הדם צריכה להישמר בקירור (עד 96 שעות) או בהקפאה (עד 14 יום). אין להשתמש בדגימות נסיוב מאוד ליפמיות. המדידה נעשית בשיטת ELISA או על ידי electro-chemiluminiscence immunoassay.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - בדיקות ביוכימיות
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
- בדיקות מעבדה - סמנים סרטניים
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק