אלפא דפנסין - Alpha defensin
| מדריך בדיקות מעבדה | |
| אלפא דפנסין | |
|---|---|
| Alpha defensin | |
| שמות אחרים | α Defensin, ALDEF |
| מעבדה | כימיה בנוזל סינוביאלי |
| תחום | זיהוי אלפא-דפנסין בנוזל המפרק לאבחון של prosthetic joint infection (להלן PJI). |
| טווח ערכים תקין | שלילי במדידת PJI |
| יוצר הערך | פרופ' בן-עמי סלע |
הפיזיולוגיה של אלפא-דפנסין
defensins α היא משפחה של פפטידי defensin של תת-משפחת α. ביונקים פפטידים אלה ידועים גם כ-cryptdins, ומיוצרים בתוך המעי הדק. ה-defensins הם פפטידים קטיונים קצרים עם משקל מולקולרי של 2–6 קילו-דלטון, בעלי תכונות מיקרובצידיות כנגד חיידקים רבים גראם-חיוביים וגראם-שליליים, והם פועלים גם כנגד פטריות ונגיפים בעלי מעטפת (Selsted וחב' ב-Curr Opin Struct Biol משנת 1995). חלבונים אלה מכילים 3 זוגות קשרים דיסולפידיים תוך-מולקולריים ( Hill וחב' ב-Science משנת 1991). על בסיס גודלם והמבנה של קשרים דיסולפידיים, דפנסינים ביונקים מתחלקים לשלוש קטגוריות: β, α ו-θ. אלפא-דפנסינים שזוהו באדם, בקופים ובמספר מיני מכרסמים, השכיחים במיוחד בנויטרופילים, באוכלוסיות מקרופאגים מסוימות ובתאי Paneth במעי הדק. דפנסינים מיוצרים באופן קונסטיטוטיבי או בתגובה לתוצרים חיידקיים או לציטוקינים פרו-דלקתיים. מספר דפנסינים קרויים גם crticostatins, כיוון שהם מעכבים יצירת קורטיקו-סטרואידים המושרים על ידי corticotropin. מנגנוני ההרג או האינאקטיבציה של מיקרו-אורגניזמים על ידי דפנסינים אינם ברורים במלואם. עם זאת מקובל שהרג זה הוא תוצאה של הרס הממברנה של החיידקים.
הטופולוגיה הקוטבית של דפנסינים, עם ההפרדה המרחבית של אזורים טעונים והידרופוביים, מאפשרת לדפנסינים לחדור לתוך ממברנות פוספוליפידיות באופן שהאזורים ההידרופוביים שלהם תקועים בתוך החלק הפנימי של הממברנה הליפידית, ואילו החלק הטעון (בעיקר קטיוני) שלהם מגיב עם קבוצות "הראש" האניוניות של הפוספוליפידים ועם מים. כתוצאה מכך, מספר דפנסינים יכולים לעבור אגרגציה ליצירה של פתחים "דמויי-תעלות", ואחרים עשויים להיקשר ולכסות את ממברנות החיידקים באופן דמוי-שטיח, ולגרום בסוף התהליך להתמוססות הממברנה החיידקית (Lehrer וחב' ב-Immunol Rev משנת 2012, Kagan וחב' ב- Proc Natl Acad Sci USA משנת 1990, ו-Lehrer וחב' ב-J Clin Invest משנת 1989), וכן על ידי עיכוב הסינתזה של דופן החיידק (de Leeuw וחב' ב-FEBS Lett משנת 2010, Munch ו-Sahl ב- Biochim Biophys Acta משנת 2015, ו-Schneider וחב' ב-Science משנת 2010). חלק מהדפנסינים מסונתזים כפרו-פפטידים.
HNP-2, HNP-1 ו-HNP-3 מקודדים על ידי 2 גנים: DEFA1 ו-DEFA3, הממוקמים בכרומוזום 8 באתר p23.1.8.DEFA1 ו-DEFA3 מקודדים לפפטידים זהים פרט להמרה של חומצת האמינו הראשונה מ-alanine לחומצה אספרטית ב-HNP-3; HPN-2 הוא איזופורם שעבר truncation בקצה ה-N טרמינלי שלו ולפיכך הוא חסר את חומצת האמינו הראשונה. דפנסינים בנויטרופילים באדם מופיעים בעורקים טרשתיים באדם, ומעכבים מטבוליזם של LDL ופיברינוליזה, ומסייעים לקישור של Lp(a) (Nassar וחב' ב- Atherosclerosis משנת 2007). בדומה ל-α-דפנסינים אחרים, cryptdins הם פפטידים קטיוניים קטנים המכילים 32–36 חומצות אמינו. הם מכילים 6 ציסטאינים משומרים היוצרים שלושה קשרים דיסולפידיים בדומה לאלפא-דפנסינים. Cryptdins הם בעלי מבנה שניוני ושלישוני הנשלט על ידי שלושה גדילים של β-sheet. הטופולוגיה הנובעת ממבנה זה היא גלובולרית אמפיפתית, בה הקצוות מורכבים מצברים של שיירים קטיוניים (Satchell וחב' ב-J Biol Chem משנת 2003). הגנים המקודדים ל-cryptdins ממוקמים בזרוע הפרוקסימלית של כרומוזום 8 בעכברים. גנים אלה דומים לגנים המקודדים ל-α-דפנסינים אחרים בכך שיש להם 2 אקסונים, שהראשון מביניהם מקודד ל-signal peptide N-טרמינלי ההולם את התנאים המקובלים, וכן ל-proregion הנמצא בקודמן precursor) ) של ה-cryptdin . הדפנסין הבשל מקוּדד על ידי האקסון השני המופרד מהאקסון הראשון על ידי intron באורך של 500bp בערך Ouellette) וחב' ב-Infect Immun משנת 1999). ה-cryptdines מסונתזים כקודמנים המכילים proregion אניוני -N טרמינלי, והם נארזים אל תוך גרנולות מפרישות של תאי Paneth. במהלך זה הקודמנים של cryptdines עוברים ביקוע על ידי metalloproteinase-7 (או ( MMP-7 וכתוצאה מפרוטאוליזה זו הצורה הבשלה של הקצה ה-C טרנינלי משתחררת מה-proregion (על פי Wilson וחב' ב-Science משנת 1999).
מאפיינים תפקודיים
עם היכולת להרוג חיידקים גראם חיוביים ושליליים, פטריות, ומספר נגיפים בעלי מעטפת, ה-cryptdines מסווגים כפפטידים אנטי-בקטריאליים עם ספקטרום פעילות רחב. אף על פי ש cryptdine-4 מבוטא פחות מששת האיזופורמים האחרים, הוא נחשב לבקטריוצידי ביותר. בתגובה לאנטיגנים בקטריאליים, משחררים תאי Paneth את הגרנולות המפרישות שלהם לתוך הנהור (lumen) של קריפטות המעי. שם, cryptdins בשילוב עם פפטידים אנטי-בקטריאליים נוספים המבוטאים על ידי תאי Paneth, תורמים לחסינות הטבעית (innate immunity) של רירית המעיים, על ידי פינוי הקריפטות האנטריות מפתוגנים פולשים פוטנציאליים (Ayabe וחב' ב-Nat Immunol משנת 2000).
דפנסינים אנושיים
לראשונה אלפא-דפנסינים אנושיים בודדו מנויטרופילים וכונו אז פפטידים נויטרופיליים אנושיים (Tang וחב' ב-Science משנת 1999). אלפא דפנסינים אנושיים ממקור של נויטרופילים (או HNP-1) מסוגלים להגביר פגוציטוזה על ידי מקרופאגים של עכברים. HNP1-3 דווחו כמגבירים את היצירה של TNF וכן של הציטוקין IL-1, כמפחיתים את היצירה של IL-10 על ידי מונוציטים.
דפנסינים בפלזמה אנושית
HNPs נחקרו באופן אינטנסיבי כסמן בפלזמה של מגוון תחלואות כגון טרשת-עורקים, מחלות ראומטיות ( Vordenbäumen וחב' בClin Exp Rheumatol- משנת 2012, מחלות זיהומיות (Panyutich וחב' ב-J Lab Clin Med משנת 1993, סרטן (Droin וחב' ב-J Proteom משנת 2009), פראקלמפסיה (Prieto וחב' ב-J Reproduct Med משנת 1997), וסכיזופרניה (Craddock וחב' ב- Mol Cell Proteom משנת 2008). נוגדנים המכוונים כנגד HNP-1 נראים כבעלי זיקה נמוכה לפרופפטידים (ProHNPs). מחקר עדכני עשה שימוש בנוגדנים כנגד proHNPs כדי להראות שהצורות השולטות של α-דפנסינים בפלזמה, הן אמנם proHNPs (Glenthø וחב' ב European J Clin Invest משנת 2013). ProHNPs מסונתזים באופן אקסקלוסיבי על ידי קודמנים של נויטרופילים במח העצם, ומצטיירים כסמנים מאוד ספציפיים של granulopoiesis.
ביטוי דפנסינים במעיים
Cryptdins הם התוצרים החלבוניים של משפחה של גנים פולימורפיים המבוטאים באופן ספציפי על ידי תאי Paneth בעכברים, בבסיס של הקריפטות במעי (Ouellette ב-Gastroenterology משנת 1997). בתחילה תוארו cryptdins כתוצרים של cDNAs ממקור של RNA מהמעי הדק בעכברים. תוארו כבר מעל 25 שעתוקים המקודדים ל-cryptdins. למרות הביטוי של מספר גדול יחסית של איזופורמים של cryptdins, רק 6 מתוכם בודדו ברמה של חלבונים. ששת cryptdins אלה מראים הומולוגיה גבוהה ביניהם, וההבדלים העיקריים הם בזהות שיירי חומצות אמינו בקצוות N או C.
דפנסינים בהדבקת נגיפים
דפנסינים גורמים ישירות לאינקטיבציה ולעיכוב של הרפליקציה של מגוון נגיפים, ומנגנון פעולה זו נלמד במספר מחקרים (Klotman ו-Changi ב-Nat Rev Immunol משנת 2006, ו-Holly וחב' ב-Ann Rev Virol משנת 2017). מנגנון הפעולה של דפנסינים במהלך האינטראקציה של נגיפים ותאי המאחסן מורכב ביותר, כפי שהדבר מודגם בהדבקה עם HIV-1: מחקרים מוקדמים הדגימו שדפנסינים מסוגלים להפחית את האינפקטיביות של נגיפים בעלי או חסרי מעטפת. HNP1-3 ו-HD5 חוסמים ביעילות את הספיחה של הנגיף בעל המעטפת herpes simplex virus-2 (להלן (HSV-2 לתאי המאחסן על ידי מניעת האינטראקציה של HSV-2 gB עם הקולטן שלו-HSPG (Yasin וחב' ב-J Virol משנת 2004, Hazrati וחב' ב-J Immunol משנת 2006, ו-Wang וחב' ב-J Virol משנת 2013). דפנסינים גם מעכבים איחוי של virions של מספר נגיפים בעלי מעטפת עם תאי המאחסן שלהם. Retrocyclin-2 ו-HBD3 מעכבים גם את האיחוי הנגיפי המתווך על ידי hemagglutinin של נגיף influenza וחלבוני נגיפים אחרים כגון baculovirus gp64 או Sindbis virus E1 protein (Leikina וחב' ב-Nat Immunol משנת 2005). בה בשעה ש-HNP-1 מוּכר היטב בגין פעילותו הישירה כנגד HIV-1 (Chang וחב' ב-J Clin Invest משנת 2005, ו-Mackewicz וחב' ב-AIDS משנת 2003), הוא גם מרסן את החדירה של HIV-1 לתאים על ידי עיכוב של איחוי הנגיף בתיווך Env ועל ידי הפחתת הביטוי של CD4 על שטח פני תאי המאחסן כמו את הביטוי של הקו-רצפטור CXCR4 (Demirkhanyan חב' ב-J Biol Chem משנת 2012), שהוא מנגנון שנוי במחלוקת באופן בו HBD2 ו-HBD3 מעכבים הדבקה עם HIV-1 (Sun וחב' ב-J Virol משנת 2005, Lafferty וחב' ב-Blood משנת 2010, ו-Quinones-Mateu ב-AIDS משנת 2003).
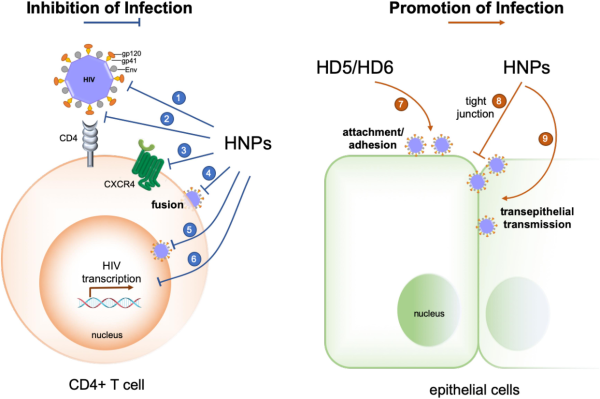
עיכובם של נגיפים לאחר שחדרו לתאי המאחסן על ידי דפנסינים, נצפה במספר משפחות של נגיפים חסרי-מעטפת כגון HPV (Buck וחב' ב-Proc Natl Acad Sci USA משנת 2006). בלי להשפיע על שלבי הקישור לתא והחדירה לתוכו, α-דפנסינים חוסמים באופן יעיל את "ההפשטה" התוך-תאית של HPV ואת הימלטותו של הנגיף מבועיות ציטופלזמטיות על ידי שהם מייצבים את ה-capsid הנגיפי באופן המונע אינטראקציה של חלבוני הנגיף והגנום שלו עם גורמים תאיים החיוניים לתהליך ההדבקה (Tenge וחב' ב-PLoS Pathol משנת 2014, Wiens וחב' ב-J Virol משנת 2015, ו-Gulati וחב' ב-Pathog Immun משנת 2019). מנגנון עיכוב זה אושר גם בנגיפים חסרי-מעטפת אחרים כמו human adenovirus (להלן HAdV) ו-JC polyomavirus, בהם α-דפנסינים מייצבים את חלבוני ה-capsid הנגיפי ועל ידי כך מפחיתים הדבקה תוך-תאית (Smith וחב' ב-PLoS Pathog משנת 2010, Nguyen וחב' ב-J Virol משנת 2010, Gounder וחב' ב-J Biol Chem משנת 2012, ו-Zins וחב' ב-J Virol משנת 2014). עיכוב לאחר חדירת נגיפים חסרי-מעטפת כמו HIV-1 או influenza לתא על ידי HNP1 מתווך על ידי הפרעה למסלולי איתות תוך-תאיים כגון PKC הנדרשים לצורך הרפליקציה של הנגיף (Salvatore וחב' ב-J Infect Dis משנת 2007).
מחקרים עדכניים יותר חושפים את ההשפעות מעודדות ההדבקה של דפנסינים בהקשר ל-HIV-1 ולהדבקות של מספר סרוטיפים של HAdV (Tanabe וחב' ב-J Virol משנת 2004). Chang וחב' דיווחו ש-HD5 ו-HD6 המושרים על ידי הדבקה עם Neisseria gonorrhoeae במערכת תאים הלקוחים מרקמה אגנית-נרתיקית, מגבירים את האינפקטיביות של HIV באופן שאינו תלוי ב-CD4. HD5 ו-HD6 מסייעים להדבקה של HIV על ידי שהם פועלים על ה-virion להגברת הקישור של הנגיף לתאי היעד שלו. דפנסינים אלה פועלים באופן אנטגוניסטי לפעילות האנטי-HIV של פוליאניונים מיקרוביצידים החוסמים חדירה של HIV לתא. HNP1, ה-α-דפנסין הפרוטוטיפי הפועל כנגד HIV, מסוגל גם להרוס את שלמות האפיתל באופן המאפשר לנגיף HIV לחדור דרך המחסום האפיתליאלי הפגוע ובכך לאפשר את ההדבקה וההֲפָצָה של הנגיף. דוגמאות נוספות של ההשפעה המעודדת של דפנסינים של ההדבקה עם נגיפים בעלי מעטפת, פורסמו. לדוגמה, Cryptdin 3 שהוא אחד ממספר דפנסינים בעכבר המבוטאים במעי הדק (Quellette וחב' ב-Cell Mol Life Sci משנת 2011), גם כן מעודד הדבקה עם HIV in vitro על ידי שהוא מעודד חדירת הנגיף לתא. מחקר עדכני מראה ש-equine herpesvirus type 1, עמיד לequine-defendsins 2-3 המעכב חיידקים ונגיפים, ומנצל דפנסינים אלה לחדור למאחסן ולהתרבות (Van Cleemput וחב' ב-J Virol משנת 2020).
דפנסינים בהדבקת חיידקים
דפנסינים יכולים להפחית זיהום חיידקי על ידי נטרול של טוקסינים המופרשים על ידי החיידקים הפתוגניים (Kim וחב' ב-Proc Natl Acad Sci USA משנת 2005, Jin חב' ב-J Immunol משנת 2004, ו-Ehrer וחב' ב-Infect Immun משנת 2009). באופן כללי, אלפא-דפנסינים באדם פחות קטיוניים אך יותר הידרופוביים מאשר בטא-דפנסינים והם שונים מכניסטית באופן בו הם הורגים חיידקים. בעוד ש-HBD1 ו-HBD3 פעילים כנגד חיידקים גראם שליליים, HBD3 שהוא יותר קטיוני, הוא גם בקטריוצידי כנגד חיידקים גראם חיוביים (Harder וחב' ב-J Biol Chem משנת 2001). בגלל האופי המאוד קטיוני של HBD3, האחרון מסוגל להרוג חיידקים באופן נרחב, שאינו תלוי במבנה החיידקים (Wu וחב' ב- Proc Natl Acad Sci USA משנת 2003, ו-Wei וחב' ב-J Biol Chem משנת 2009). תפקיד הגנתי כנגד הדבקה בסלמונלה הודגם על ידי אלפא-דפנסינים בעכברים (Wilson וחב' ב- Science משנת 1999).
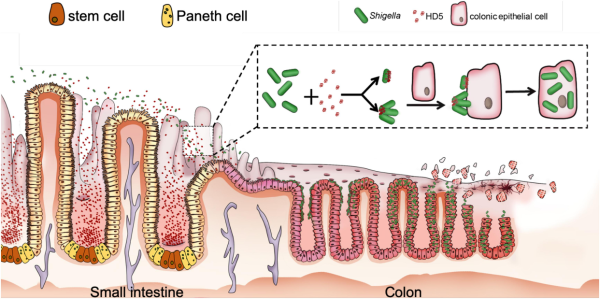
HNP1-3 המופרשים על ידי נויטרופילים במקרי הדבקה עם Staph aureus, משרים שחרור של TNFα ושל אינטרפרון-γ ממקרופאגים, מה שמגביר את הפגוציטוזה של הפתוגן על ידי המקרופאגים (Soehniein וחב' ב-J Clin Invest משנת 2008, ו-Lindbom וחב' ב-Clin Exp Immunol מאותה שנה). HNP1 מעכב גם את ההתחמקות של Listeria monocytogenes ושל Mycobacterium tuberculosis מהפגוציטוזה (Arnett וחב' ב-Cell Microbiol משנת 2011, ו-Tan וחב' ב-J Immunol משנת 2006), מה שמרמז לכך שדפנסין, אף על פי שאינו מבוטא על ידי מקרופאגים, תורם לתפקודם האנטי-בקטריאלי (Brook וחב' ב-Proc Natl Acad Sci USA משנת 2016). מסתבר שאף על פי שתפקידם של דפנסינים בהגנה מפני חיידקים נתמך רבות, נמצא ש-α דפנסינים יכולים לתרום לפתוגניות של חיידקי Shigella (Murphey ו-Maloy ב-Immunity משנת 2018, Liao וחב' ב-Cell Microbiol משנת 2019, ו-Xu וחב' ב-Immunity משנת 2018). שלא בדומה לחיידקים אנטרו-פתוגניים, Shigella חסרה מנגנוני ספיחה כגון שוטונים (Bravo וחב' ב-PLoS One משנת 2015, Schroeder וחב' ב-Clin Microbiol Rev משנת 2008, ו-Donnenberg ב-Nature משנת 2000). כתוצאה מכך חיידקי Shigella נספחים הרבה פחות וחודרניים הרבה פחות in vitro בהשוואה לחיידקים אנטרו-פתוגנים בעלי שוטונים, זאת למרות האינפקטיביות המאוד ניכרת של Shigella באדם. יתרה מכך, אף על פי ש-Shigella אינפקטיבית מאוד באדם, היא מדביקה בקושי בעלי חיים אחרים כולל עכברים בהם רמת ה α-דפנסינים גבוהה (DuPont וחב' ב-J Infect Dis משנת 1989, ו-Schnupf ו-Sansonetti ב--Miicrobiol Spect משנת 2019). תופעה פרדוקסלית זו (Brodcke וחב' ב-Cell Host Microb משנת 2014) בפתוגניות של ,Shigella זוכה להסבר חלקי בכך שחסר שוטונים בחיידק זה מעניק לו שטח פנים ייחודי, המאפשר ל-HD5 ליצור מבנים מולטימריים המאפשרים ל-Shigella להיספח לאפיתל של הפונדקאי ולפלוש לתאים ולרמת אינפקטיביות גבוהה in vivo ו-.ex vivo מחקרים אלה תומכים בהנחה ש-Shigella מנצלת את HD5 לווירולנטיות שלה.
HNP1 גם פעיל בסיוע להדבקת תאי אפיתל עם Shigella, מה שנמצא במתאם עם ממצא קודם שחלבונים גרנולוריים בנויטרופילים אנושיים (המכילים HNPs), מעודדים ספיחה של shigella flexneri in vitro (Eilers וחב' ב-Cell Microbiol משנת 2010). באשר ל α-דפנסינים, ההידרופוביות והקטיוניות הסלקטיבית שלהם, קריטית לפעילות האנטי-מיקרוביאליות שלהם. מספר מחקרים על מוטציות זיהו את המאפיינים התפקודיים של α-דפנסינים המסייעים להדבקות עם פתוגנים נגיפיים וחיידקיים (Klotman וחב' ב-J Immunol משנת 2008, Ding וחב' ב-J Innnate Immun משנת 2011, Rapista וחב' ב-Retrovirology משנת 2011, Valere וחב' ב-Viruses משנת 2017). בקצרה, קשרים דיסולפידיים בדפנסין, נדרשים ביותר לצורך היכולת שלו להגביר את ההדבקה עם HIV-1, וממילא את יכולת הנגיף לפלוש לתאים. שיירים הידרופוביים ב-α-דפנסינים (דהיינו Trp26, ו-Phe28 ו-Leu26 ב-Leu16, Tyr27 ,HPN1 ו-Leu29 ב-HD5 ו-Phe2 ו-Phe29 ב-HD6, משחקים תפקיד מרכזי, כאשר דימריזציה ו/או אוליגומריזציה של α-דפנסינים חיוניים ביותר. קטיוניות סלקטיבית הנתרמת על ידי שייר Arg28 ב-HD5 יכולה להיות קריטית בסיוע בהדבקות של HIV ו-Shigella. אף על פי ש-α-דפנסינים הם בעלי מגוון רחב ברצף של חומצות האמינו, השיירים התפקודיים משומרים, ללא קשר לתפקידיהם הפתוגניים או ההגנתיים.
התפקיד של דפנסינים בממאירות
רוב סוגי הסרטן המתפתחים מתאי אפיתל ומקרצינומות, בהם β-דפנסינים מבוטאים על פני הרירית כהגנה מפני הדבקות מיקרוביאליות (Semple ו-Dorin ב-J Innate Immun משנת 2012, Pazgier וחב' ב- Cell Mol Life Sci משנת 2006, Feng וחב' ב-J Immumol משנת 2006, ו-Diamond וחב' ב- Curr Pharmaceut Design משנת 2009). כיוון ש-β-דפנסינים מבוטאים ברקמות נורמליות ובגידולים סרטניים, תפקידם בהתפתחות הסרטן והתקדמותו גירה התעניינות רבה (Jin ו-Weiberg ב- Semin Cell Dev Biol משנת 2019, Yang וחב' ב-Immunol Rev משנת 2017, Ghosh וחב' ב-Front Oncol משנת 2019, ו-Weinberg וחב' ב- Front Immunol משנת 2012). HBD1 מדוכא ברוב הקרצינומות (Gambichler וחב' ב-BMC Cancer משנת 2006, Sun וחב' ב-Cancer Res משנת 2006, Joly וחב' ב-Oral Microbiol Immunol משנת 2009, Wenghoefer וחב' ב- Int J Oral Maxillof Surgery משנת 2008, Semlali וחב' ב-PLos One משנת 2015, Ling וחב' ב-Sci Rep משנת 2017, ו-Donald וחב' ב- Labor Investigat משנת 2003).
יש ראיות רבות לכך ש-HBD1 מתפקד כמדכא סרטן ברוב הקרצינומות (Bullard וחב' ב-Mol Immunol משנת 2008, ו-Han וחב' ב-PLoS One משנת 2014). לעומת זאת, HBD3 לעיתים קרובות מבוטא ביתר בקרצינומות שונות (Shuyi וחב' ב- Oral Surgery Oral Med Oral Pathol Oral Radiol Endodontol משנת 2011, Kesting וחב' ב- Cancer Investigat משנת 2009, Xu וחב' ב- Oncotarget משנת 2016, ו-Fathy וחב' ב- F1000Res משנת 2012), והשדרוג שלו יוחס לשפעול של EGFR הנתמך על ידי LPS, או על ידי הדבקה בו-זמנית על ידי HPV הגורמת להרס של p53 (DasGupta וחב' ב-Oncotarget משנת 2016). יצוין ש-3HBD מעודד את גידול סרטן ונדידתו (Winter וחב' ב- Cancer Investigat משנת 2011), בכך שהוא מגן על תאי הסרטן מפני אפופטוזיס (Mburu וחב' ב- Carcinogenesis משנת 2011), ומסייע לגייס מקרופאגים הקשורים לגידול המסייעים להתפתחות הגידול הסרטני (Jin וחב' ב- PLoS One משנת 2010). בהתאמה עם תפקיד האונקוגני של HBD3, β-דפנסין 1 בעכבר, שהוא האורתולוג של D3, פועל כגריין כימי (chemoattractant) לסייע לאנגיוגניות ולהתפתחות הגידול (Röhrl וחב' ב-J Immunol משנת 2012).
הרגולציה של HBD2 והשפעתו על טומורוגניות משתנים בין סוגי הסרטן השונים ועלולה להיות בעייתית (Lisovskiy וחב' ב-Exp Oncol משנת 2001, ו-Markeeva וחב' באותו כתב עת משנת 2005). HBD2 עובר שדרוג בסרטני הוושט, העור וריאות (Shi וחב' ב-Oncotarget משנת 2014), אך הוא עובר downregulation בסרטני הפה והמעי הגס (Meyer וחב' ב-Anti Cancer Res משנת 2004). נראה ש-HBD2 משחק תפקיד מרכזי בדיכוי של התפתחות הסרטן והתפשטותו כאשר הוא עובר downregulation (Boughan וחב' ב-J Biol Chem משנת 2006, Kawsar וחב' ב-Peptides משנת 2010, ו-Camino וחב' ב-Oncol Rep משנת 2014), אך יש לו תפקיד בעידוד התהליך הסרטני כאשר הוא משודרג (Baroni וחב' ב-Peptides משנת 2009, Conejo-Garcia וחב' ב-Nat Med משנת 2004, ו-Gao וחב' ב-Int J Clin Exp Pathol משנת 2016), מה שנמצא בהתאמה עם HBD1 ו-HBD3. התכונות המעודדות או המדכאות של דפנסינים בטומורוגניות מסוכמות להלן:
התפקיד של α-דפנסין בטומורוגניות נלמד באופן אינטנסיבי (Hancock וחב' ב-Nat Rev Immunol משנת 2016, ו-Droin וחב' ב-J Proteom משנת 2009). רמות מוגברות של α-דפנסינים מיילואידיים (HNP1-3) מתגלות לעיתים קרובות ברקמות של סוגי סרטן רבים כמו גם בנוזלים ביולוגיים של חולי סרטן (Melle וחב' ב-Gastroenterology משנת 2005, Kemik וחב' ב-Hum Exp Toxicol משנת 2011, Albrethsen וחב' ב-Eur J Cancer משנת 2006, Mothes וחב' ב-Dis Markers משנת 2008, Bateman וחב' ב-Peptides משנת 1992, Muller וחב' ב-Am J Pathol משנת 2002, Lundy וחב' ב-Oral Oncol משנת 2004, Holterman וח' ב-Urol Oncol Sem Orig Invetigat משנת 2006, Gunes וחב' ב-J Cancer Res Clin Oncol משנת 2013, ו-Escher וחב' ב-Eur J Cancer משנת 2006). בה בשעה שתאי חיסון שחודרים לגידולים סרטניים, ובעיקר נויטרופילים, הם תורמים עיקריים לרמות מוגברות של HNP1-3 בגידולים אלה, מספר המחקרים מראים שתאי סרטן עצמם עשויים לייצר HNP1-3 במנגנון לא מוכר. HNP1-3 נמצא מסייע לשגשוג של תאי סרטן (Nishimura וחב' ב-J Dermatol Sci משנת 2004), ותורמים לחודרנות של תאים אלה. בגלל היותם ממיסים ממברנות של חיידקים, רבים מהמחקרים המוקדמים על אלפא-דפנסינים התמקדו ביכולתם לגרום להמסה של תאי סרטן בריכוזים גבוהים (Lichtenstein וחב' ב-Blood משנת 1986). לעומת זאת, מחקרים עדכניים יותר שופכים אור על הסיבוכיות המנגנונית של הפעילות האנטי-סרטנית של HNP1-3 כולל השריית אפופטוזיס (Gaspar וחב' ב-Mol Cell Res משנת 2015, Xu וחב' ב-Mol Cancer Ther משנת 2008, ו-Wang וחב' ב-Clin Cancer Res משנת 2009), עיכוב של אנגיוגניות (Economopoulou וחב' ב-Blood משנת 2005, ו-Chavakis וחב' ב-FASEB J משנת 2004), ובמקרה של גידול מסוגHPV, גיוס של תאים דנדריטיים (Hubert וחב' ב-FASEB J משנת 2007).
התפקיד של α-דפנסין באבחון של זיהום במפרק תותב
ההתנהלות לאבחון זיהום של מפרק בניתוח של חכנסת תותב (להלן PJI) אינה סטנדרטית ברחבי העולם, מה שפוגע בסיכויי האבחון. יותר ניתוחי ארתיופלסטיה של הכנסת תותבים למפרקי הברך או צוואר הירך מתבצעים, ובעקבותיהם מופיעים זיהומים של חיידקים אלימים ועמידים לאנטיביוטיקה מה שגורם לסבל ותחלואה בעיקר במטופלים בגיל המתקדם שהם מטבע הדברים אלה בהם מתבצעות פרוצדורות כירורגיות אלו. האבחון של prosthetic prosthetic joint infection (להלן PJI ) מאתגר, שכן התסמינים הקליניים לא תמיד חד ערכיים והסמנים הסיסטמיים של זיהומים אלה כגון עלייה ברמת CRP או שקיעת דם מוחשת לא תמיד ספציפיים. נעשה שימוש גובר בסמני בנוזל הסינוביאלי כגון ספירה מוגברת של לויקוציטים לאבחון תרחישים של PJI. למרות הסיוע המתקבל ממדידת elastase בלויקוציטים של הסינוביום וכן ממדידת CRP בנוזל זה, הסמן המבטיח ביותר מבחינת הרגישות והספציפיות שלו הוא אלפא-דפנסין. מדידת רמת אלפא-דפנסין בשיטת ELISA מדויקת באבחון של PJI אם כי למדידת lateral flow יש יתרון בשל קבלת תוצאות בזמן קצר ובספציפיות גבוהה. מסתבר ש-PJI מופיע ב-0.7-2.4% מהמנותחים וזיהומים אלה אחראיים ל-15% מהכישלונות של הארתיופלסטיות של צוואר הירך, וב-25% של הכישלונות בהחדרת תותב לברך. כמעט כל מיקרואורגניזם עלול לגרום ל-PJI כגון חיידקים גראם-חיוביים האחראיים בערך לשני שלישים של זיהומי מפרק אלה, וחיידקים גראם-שליליים האחראיים ל-10-15% מהזיהומים. חתכים קפואים אינם מתבצעים באופן שגרתי בבתי חולים, ובעוד שספירת לויקוציטים מנוזל הברך ניתנת בביצוע, לא מתאפשרת תמיד בניתוחים של צוואר הירך. יתרה מכך, metallosis ומחלות זיהומיות כרוניות אחרות מחקות תסמינים של PJI.
האבחון של PJI
בשנת 2011, בניסיון להדריך קלינאים בפרקטיקה היומיומית, החברה לזיהומים שריריים-שלדיים (MSIS) פרסמה גישה אבחונית הכוללת שני קריטריונים ראשיים, או שישה קריטריונים משניים לאבחון PJI, לפיה לפחות קריטריון ראשי אחד או ארבעה קריטריונים משניים מצביעים על PJI. בשנת 2013 קבוצת הקונצנזוס הבינלאומית על Periprothetic Joint Infection שהתכנסה בפילדלפיה, הכניסה מספר שינויים קלים במסמך של MSIS, כגון השמטת הקריטריון המשני של מוגלתיות בנוזל הסינוביאלי, כאשר במקומו הוכנס הקריטריון של אלסטאזה לויקוציטרית כמדד לעלייה בספירת הלויקוציטים בנוזל זה.
סמנים ביולוגיים
Deirmengian וחב' זיהו ולמדו את התכונות האבחוניות של 16 סמנים סינוביאליים מבטיחים לזיהוי PJI. הסמנים שנבחנו היו אלפא-דפנסין, IL-17 ,IL-10 ,IL-8 ,IL-6, IL-1a, IL-1 וכן granulocyte colony-stimulating factor, neutrophil gelatinase associated lipocalin (להלן NGAL), ,lactoferrin, resistin ,thrombospondin ו-bactericidal/permeability-increasing protein (להלן BPI) (על פי Deirmengian וחב' ב-Clin Orthop Relat Dis משנת 2014). הביצועים של סמנים אלה נבחנו על 95 דגימות של נוזל סינוביאלי, והקריטריונים של MSIS שימשו לדירוג של 29 מקרי PJI ו-66 מפרקים אספטיים. תוצאות המחקר הראו שחמישה מתוך 16 הסמנים שנבחנו הראו רגישות וספציפיות של 100% באבחון של PJI : אלפא-דפנסין אנושי 1–3, neutrophil elastase-2, לקטופרין, BPI ו- .NGAL. מבין חמשת הסמנים הללו, נראה שאלפא-דפנסין הוא הסמן הסינוביאלי הטוב ביותר במושגים של רגישות וספציפיות לאבחון PJI.
בדיקה אימונית של אלפא-דפנסין
בדיקת ELISA היא בעלת הדיוק הגבוה ביותר לאבחון PJI, אך היא צריכה להתבצע במעבדה וזמן ביצועה ממושך יותר מזה של מדידת lateral flow המהירה. מחקר של Bingham וחב' שפורסם ב-Clin Orthop Relat Res משנת 2014, השיג 100% רגישות ו-95% ספציפיות בבדיקת alpha defensin-1 ב-57 מטופלים בהשוואה למבחנים קליניים אחרים (ספירת לויקוציטים, מבחן שקיעת דם, ו-CRP) אם כי לא הגיע למובהקות סטטיסטית גבוהה ביחס לדגימות של נבדקים אספטיים. במחקר נוסף של Deirmengian וחב' ב-Clin Orthop Relat Res משנת 2015, הושוו הרגישות והספציפיות של מדידת אלפא-דפנסין לזו של מדידת אלסטאזה בלויקוציטים בנוזל הסינוביום של 23 נבדקים אספטיים עם התרופפות התותב, וב-23 נבדקים עם קריטריונים של MSIS ל-PJI. בעוד שאלפא-דפנסין אבחן נכונה 100% של מקרי PJI, בדיקת אלסטאזה בלויקוציטים זיהתה רק 78% ממקרים אלה. בדיקת אלפא-דפנסין זכתה לאופטימיזציה כאשר ערך ה-cutoff נקבע כ-5.2 מיקרוגרם/מ"ל, כאשר הריכוז הממוצע של מדד זה בסינוביום של נבדקים עם PJI נמצא כ-59.6 מיקרוגרם/מ"ל, ריכוז הגבוה פי-30 ומעלה בהשוואה לריכוז של מדד זה בנבדקים אספטיים, שנקבע כ-1.92 מיקרוגרם/מ"ל. ב-18 מתוך 23 הדגימות של נבדקים אספטיים לא ניתן היה לגלות כלל את אלפא-דפנסין. בסקירה סיסטמטית ומטה-אנליזה של Wyatt וחב' ב-Am J Bone Joint Surg משנת 2016, הודגמה רגישות של 100% וספציפיות של 96% של בדיקת אלפא-דפנסין, שהיו משמעותית גבוהות יותר מאשר אלה שהושגו בבדיקת אלסטאזה בלויקוציטים. Li וחב' בסקירה סיסטמטית נוספת אישרו ממצאים אלה ב-Biomed Res Int משנת 2020. במחקר נוסף, בחנו Bonazinga וחב' ב-Gen Orthop משנת 2019, את האמינות של immunoassay למדידת אלפא-דפנסין, ומצאו רגישות וספציפיות של 97% באבחון של PJI, וכן ערך ניבוי חיובי (PPV) של 88% וערך ניבוי שלילי (NPV) של 99%.
מבחן lateral flow להערכת ריכוז של אלפא-דפנסין
המתקן לקביעת lateral flow מהווה חלופה שימושית לזיהוי אלפא-דפנסין בנוזל סינוביאלי "in situ" אפילו במהלך הניתוח כאשר התוצאה מתקבלת תוך 10 דקות, זמן קצר לאין שיעור מזה הנדרש לביצוע בדיקת ELISA. בניסוי שביצעו Gehrke וחב' ופורסם ב-Journal of Bone and Joint Surgery משנת 2018, הודגמה דרגת דיוק גבוהה בערכת lateral flow (Synovasure AD test) בבדיקה של 195 דגימות נוזל מפרקי לבחון של PJI. התוצאות הראו רגישות של 92.1% וספציפיות של 100%. ערך הניבוי החיובי היה 100%, וערך הניבוי השלילי נקבע כ-95.2%. סך רמת הדיוק של מדידה זו נקבע כ-96.9% (189 מתוך 195 נבדקים). Renz וחב' ב- J Bone Joint Surg משנת 2018, מעריכים שבדיקת lateral flow אינה ראויה לשמש כבדיקת סקר, וחשיבותה כבדיקה מאמתת של PJI. גם Han וחב' ב-J Orthop Surg Res משנת 2019, מדגישים את יעילות בדיקה זו המתבצעת במהלך ניתוח לאשש מקרים של PJI.
הוראות לביצוע הבדיקה
שאיבה של נוזל סינוביאלי ואחסונו בקירור כאשר יציבותו בטמפרטורה זו עד 7 ימים. יש לפסול דגימה מאוד המוליטית. כאשר לא ניתן לזהות אלפא-דפנסין בנוזל סינוביאלי, נראה שאין מדובר ב-PJI. תוצאה שלילית אינה שוללת אפשרות של PJI. הבדיקה יכולה להתבצע בשיטת ELISA או בשיטת lateral flow.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - בדיקות ביוכימיות
- בדיקות מעבדה - מחלות בקטריאליות/ זיהום בקטריאלי-אלח-דם
- בדיקות מעבדה - מחלות נגיפיות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק