אמילין - Amylin
הופניתם מהדף אמילין לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| אמילין | |
|---|---|
| Amylin | |
| שמות אחרים | IAPP או Islet Amyloid Polypeptide |
| מעבדה | אנדוקרינולוגיה בדם |
| תחום | תפקוד בלוטת הלבלב, בהקשר של סוכרת |
| טווח ערכים תקין | 4-8 פיקומול'/ליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
הביוכימיה של amylin
ההורמון הפפטידי amylin, מכיל 37 חומצות אמינו, והוא מופרש ביחד עם אינסולין מתאי β בפנקריאס ביחס של 1 ל-100. ל-amylin יש תפקיד ברגולציה של משק הסוכר בגוף, על ידי כך שהוא מאט את התרוקנות הקיבה, ומעודד תחושת שובע, ועל ידי כך מונע את העליות והירידות החדות (spikes) ברמות גלוקוזה בדם. הצורה הבשלה של amylin מתחילה דרכה מרצף של 89 חומצות אמינו (Sanke וחב' ב-J Biol Chem מ-1988), המכיל רצף של 22 חומצות אמינו הידוע כ-signal peptide, שעובר ביקוע בתאי β לקבלת פפטיד בעל 67 חומצות אמינו הידוע כ-proamylin, העובר שינויים post-tanslational הכוללים פעילות פרוטאוליטית של ביקועים נוספים לקבלת התוצר המוגמר של amylin. הגן ל-proamylin ממוקם על הזרוע הקצרה של כרומוזום 12 באתר 12p12.3-p12.1.
Amylin הוא חבר במשפחת ה-CGRP או calcitonin gene-related peptide, ואמנם על פי Wimalawansa בסקירה משנת 1997 ב-Crit Rev Neurobiol, קיימת הומוליה של 20% ברצף חומצות האמינו בין amylin בין קלציטונין ו-adrenomodullin, ו-44% הומולוגיה עם CGRP.
שינויים אלה כוללים את השלבים הבאים: 11 חומצות אמינו מורחקות מהקצה ה-N טרמינאלי של proamylin, על ידי האנזים proprotein convertase 2, ואילו 16 חומצות אמינו מורחקות מהקצה ה-C טרמינאלי על ידי האנזים proprotein convertase 1/3 (על פי Higham וחב' ב-Eur J Biochem משנת 2000). בקצה ה-C טרמינאלי האנזים carboxypeptidase E מסיר את 2 חומצות האמינו ליזין וארגינין, ואילו הגליצין שהפך לחומצת האמינו ה-C טרמינאלית בעקבות הסרת הדו-פפטיד, עובר אמידציה על ידי האנזים PAM או peptidylglycine alpha amidating monooxygenase להוספת שייר אמיני. בשלב המודיפיציות האחרון, נוצר קשר די-סולפידי בין שיירי ציסטאין בעמדות 2 ו-7, ובכך מתקבלת מולקולת amylin הסופית.
הרצף של amylin פוענח לראשונה על ידי Cooper וחב' ב-1987 והתפרסם ב-Proc Natl Acad Sci, והוא אם כן:
(H-Lys-Cys-Asn-Thr-Ala-Thr-Cys-Ala-Thr-Gln-Arg-Leu-Ala-Asn-Phe-Leu-Val-His-Ser-Ser-Asn-Asn-Phe-Gly-Ala-Ile-Leu-Ser-Ser-Thr-Asn-Val-Gly-Ser-Asn-Thr-Tyr-NH2)
התפקיד של Amylin
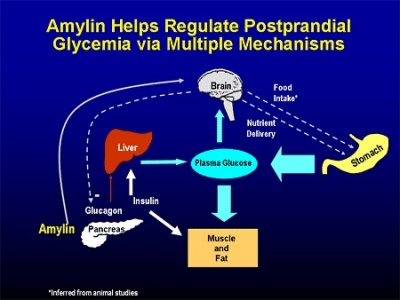
פפטיד זה מהווה חלק מההפרשה האנדוקרינית של הלבלב, ותרומתו לשליטה על המאזן הגליקמי של הגוף. הוא מופרש לדם, אך עובר בכליות ביקוע פרוטאוליטי, באופן שהוא אינו מופרש בשתן. יש דמיון רב בתפקיד של amylin במניעת היפרגליקמיה בדומה לאינסולין (Pittner וחב' משנת 1994 ב-J Cell Biochem). ניתן לקבוע ש-amylin פועל בסינרגיה מלאה עם אינסולין, בהיותם מופרשים הדדית לאחר ארוחה, על מנת להפחית את רמת גלוקוזה בדם, מטרה המושגת בין השאר על ידי עיכוב הפרשת ההורמון גלוקאגון המחיש גלוקונאוגנזה, האטת התרוקנות הקיבה בעידוד עצב הואגוס, עיכוב הפרשת חומצת הקיבה אנזימי הלבלב ופליטת חומצות המרה, על מנת להפחית את קצב צריכת המזון.
אכן, Gedulin וחב' הדגימו בחולדות ש-amylin מגביר סינתזת גלוקאגון (Metabolism, 1997), ו-Guidobono פרסם בשנת 1998 ב-Gen Pharm, נתונים על השפעת amylin להאטת קצב התרוקנות הקיבה ממזון. חלק מהמטרות הללו מושגות על ידי הפעלת האזור הרגיש לגלוקוזה בגזע המוח, הידוע כ-area posterma. נמצא שלא רק הפרשת אינסולין ו-amylin נעשים בעת ובעונה אחת, אלא גם הפסקת הפרשתם נעשית באופן סינכרוני (Buse וחב' ב-Clinical Diabetes משנת 2002). בין הפפטידים המופרשים כתוצאה מצריכת פחמימות, רק amylin ו-glucagon-like-peptide-1, ידועים ככאלה המעכבים התרוקנות הקיבה בריכוזים הקרובים לפיזיולוגיים, ויכולים אם כן לסייע למשוב השלילי המפקח על שחרור פחמימות מהקיבה. ניסויים במכרסמים מדגימים ש-amylin מגביל את יצר האכילה של יצורים אלה, וכנראה שבדומה ל-CCK יש ל-amylin תכונה של גורם המגביר את תחושת השובע, כפי שהציעו Young ו-Denato ב-Nutrition משנת 1998.
נראה ש-amylin עושה מודולציה של הרגישות לאינסולין של תאי שריר שלד, ויש לו אף השפעה בוויסות לחץ-דם על ידי פעולה וזו-דילטורית דרך השפעתו על קולטני CGRP כפי שהודגם בכליות של חולדות (Wookey וחב' ב-Hypertension משנת 1997, ו-Chin וחב' ב-J Pharmacol Exp Ther משנת 1994.
אינסולין ו-amylin נמצאים תחת רגולציה של גורמים דומים שכן הם בעלי promoter motif רגולטורי משותף (Höppener וחב' ב-N Eng J Med משנת 2000), אם כי הפרומוטר של amylin משופעל גם על ידי גירויים שאינם משפיעים על אינסולין, כגון TNF-α (על פי Cai וחב' משנת 2011 ב-Diabetologia), וכן גם חומצות שומן (Qi וחב' ב-Am J Physiol Endocrinol Metabol משנת 2010). גם מצבים של תנגודת לאינסולין שמביאה ליצירה מוגברת של האחרון, משפיעה באופן דומה להגברת ההפרשה של amylin, ובאופן כללי ניתן לקבוע שרמת גלוקוזה בדם משחקת תפקיד חשוב בוויסות הסינתזה של amylin. בבני-אדם בגיל מתקדם יש ירידה בהפרשת amylin מתאי β בפנקריאס (Dechenes וחב' משנת 1998 ב-Am J Physiol Endocrinol Metab).
המשמעות הקלינית של amylin
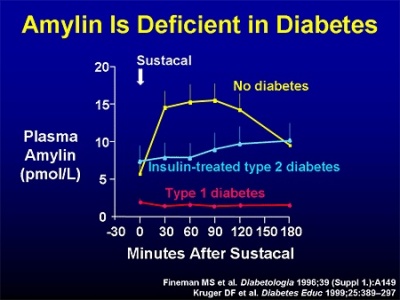
חסר ב-amylin אופייני לסוכרת type 1, ולשלבים מאוחרים של סוכרת type 2 (על פי Asmar וחב' משנת 2010 ב-J Clin Endocrinol Metab).
תנגודת לאינסולין בסוכרת type 2 מכתיבה דרישה מוגברת ליצירת אינסולין הגורמת להפרשה של proinsulin (על פי Marzban וחב' ב-Diabetes משנת 2006). proamylin מופרש בעת ובעונה אחת, אלא שהאנזימים המסבים 2 קודמנים אלה לאינסולין ול-amylin, אינם מסוגלים לעמוד בקצב הדרישה המוגברת לפעולתם, מה שמביא להצטברות של proamylin. בעיקר מתרחש שיבוש בביקוע הפפטיד בקצה ה-N טרמינאלי של proamylin במסגרת המודיפיקציות ה-post translational האמורות לייצר את מולקולת ה-amylin הבשלה. שיבוש זה יכול להתרחש בעיתוי של דרישה מוגברת לאינסולין ול-amylin בסוכרת type 2, כאשר רמות גלוקוזה גבוהות. אותו proamylin שאינו עובר באופן מושלם את שלבי הביקוע האנזימטיים, עלול לשמש כגרגיר (granule) סביבו מצטברות עוד מולקולות amylin ליצירת חלבון עמילואיד בתאי β, ולגרום לתהליך אפופטוטי ולמות תאים אלה (Paulsson וחב' ב-Diabetologia משנת 2006). כאשר הבועיות (vesicles) בתאי β תופחות ומשתחררות מתאים אלה, הן קולטות עוד amylin מחוץ לתאים.
הפרופיל היומי של רמות amylin בפלזמה תואם את זה של אינסולין. הרמות הנורמאליות של amylin המופיעות בספרות הרפואית, מראות שינויים משמעותיים בשל השיטות השונות למדידתו, אך הן נעות בין 4 פיקומול' לליטר בצום, עד 25 פיקומול' לליטר לאחר ארוחה (על פי Young ב-Curr Opin Endocrinol Diab משנת 1997, ו-Percy וחב' ב-Clin Chem משנת 1996).
מחקר של Roth וחב' משנת 2008 ב-Proc Natl Acad Sci, דיווח על השפעה סינרגיסטית של לפטין ו-Amylin בהפחתת משקל, כאשר הם ניתנו סימולטאנית לחולדות שהולעטו בדיאטה משמינה, וההשפעה של הפחתת משקל יוחסה לשחזור הרגישות של ההיפותלמוס ללפטין. אלא שניסויים קליניים דומים באנשים שמנים, הופסקו בשנת 2011 ב-phase II, כאשר ב-2 ממשתתפי הניסוי הופיעו נוגדנים שנטרלו את ההשפעה מפחיתת המשקל של metreleptin, והתברר ששני מטופלים אלה טופלו ב-metreleptin בניסוי קודם בו הם השתתפו. metreleptin (גרסא אנושית של לפטין), ניתן באותו ניסוי קודם ביחד עם Symlin, אנאלוג של amylin.
ההיבט ה"עמילואידי" של amylin
מעבר לפעילותו ה"חיובית" של amylin "כהורמון עזר" של אינסולין במניעת סוכרת, יש ל-amylin מספר היבטים של פעילות העלולה לגרום נזק. Westermark וחב' כרכו את amylin לאפשרות של תרומה לסוכרת type 2 בהיותו תורם להרס של תאי β יוצרי אינסולין (Proc Natl Acad Sci, 1987). יצירת חלבון עמילואיד באיי לנגרהנס, המושרית על ידי צימות (אגרגציה) של proamylin, עלולה לתרום לאובדן הולך וגדל של תאי β. בשנת 2005 דיווח Paulsson ב-Diabetes, שהצורה המקדימה של proamylin יוצרת כנראה את הגרנולות הראשוניות שמאפשרות ל-amylin לעבור צימות וליצור את חלבון העמילואיד שעלול לגרום לתהליך אפופטוזיס בתאי β.
amylin מסוגל ליצור סיבים (fibrils) של עמילואיד in vitro, ובשלב יצירת סיבים אלה, מבנים קדם-סיביים הם בעלי רעלנות רבה לתאי β ולתאים סרטניים (insulinoma) מייצרי אינסולין בתרבית תאים. Amylin הוא מרכיב עיקרי וייחודי של amyloid של תאי β בלבלב. אכן ב-90% מאלה עם סוכרת type 2 מתאפיינים בנוכחות משקעי עמילואיד באיי בלבלב שפוגעים בתפקוד תאים אלה.
משקעי עמילואיד שמקורם ב-amylin מתאי לנגרהנס, מוצאים באופן בולט באיי הלבלב של אלה הסובלים מסוכרת type 2, או אלה עם גידול כמו אינסולינומה. למרות שהקשר בין amylin לסוג זה של סוכרת ידוע זה מכבר, קשה יותר להצביע על הקשר המנגנוני. Lorenzo הציע במאמר ב-Nature מ-1994, ש-amylin בדומה ל-β amyloid הרלווונטי למחלת אלצהיימר, יכול להשרות מות תאי β במנגנון אפופטוזיס, מה שיכול לגרום להתפתחות סוכרת type 2.
לעומת זאת, הטוקסיות של סיבי עמילואיד בשלים לתאים שהוזכרו מופחתת. Brender וחב' פרסמו בשנת 2009 ב-Biochemistry, שפפטיד שאינו יוצר פיברילות, שהוא הקטע של חומצות אמינו 1-19 ב-amylin ממקור אדם, טוקסי באותה מידה כמו הפפטיד השלם, ו-Brender וחב' הראו גם ב-2007 ב-Biochem Biophys Acta שמקטע של חומצות אמינו 20-29 של amylin ממקור אדם גורם לפרגמנטציה של ממברנות תאי β, כנראה בשל אפקט העמילואיד, אם כי מקטעי amylin ממקור עכבר וחולדה, משוללים תכונות טוקסיות אלה בתאי β.
משקעי amylin במוח עלולים לכרוך סוכרת עם שיטיון מסוג אלצהיימר
Despa וחב' ב-U. Cal ב-Davis, פרסמו ב-Ann Neurol באוקטובר 2013 מאמר היפותטי, המציע שמשקעי amylin במוח, יכולים להוות סיכון להתפתחות שיטיון בחולי סוכרת type 2. בניתוחים שלאחר המוות בחולי אלצהיימר מעל גיל 70 שנה שהיו גם סוכרתיים. קבוצת חוקרים זו גילתה לראשונה משקעי amylin ברקמות מוח מחולים אלה, והציעה שמשקעי amylin יכולים להתגבב וליצור פלאקים בדומה לאלה הנוצרים על ידי סבכי עמילואיד בחולי אלצהיימר. נבחנו מוחות משלוש קבוצות נבדקים לאחר מותם: אלה עם סוכרת ושיטיון וסקולארי או אלצהיימר, אלה עם אלצהיימר ללא סוכרת, ואלה ללא סוכרת או שיטיון. נמצאו כמויות נכבדות של משקעי amylin באלה עם שיטיון וסוכרת, אך באופן מפתיע נמצאו משקעי amylin מועטים יותר גם באלה עם מחלת אלצהיימר ללא סוכרת, בעוד שבקבוצת הביקורת נמצאו מעט מאוןד משקעי amylin. מחקר זה עשוי להסביר מדוע סוכרת מהווה גורם סיכון לשיטיון.
קולטנים ל-amylin
יש לפחות 3 קומפלקסים של קולטנים אליהם נקשר amylin בזיקה גבוהה, וכל השלושה מכילים בגרעין שלהם את הקולטן ל-calcitonin, וכן אחד משלושת החלבונים הידועים כ-receptor activity modifying proteins, או RAMP2 ,RAMP1 ו-RAMP3. על פי Hay וחב' בסקירתם משנת 2004 ב-Biochem Soc Trans, חלבוני RAMP הם חלבונים טרנס-ממברנליים עם קצה N-טרמינאלי חוץ-תאי, שתפקידם הוא לעשות טרנספורט של calcitonin-receptor-like receptor לממברנת התא. חלבוני RAMP יכולים לעבור אינטראקציה עם הקולטן לקלציטונין, ועל ידי הטרומריזציה של RAMP1 לדוגמה עם קלציטונין ניתן לגרום להורמון זה להיקשר לקולטן של amylin הידוע כ-AMY1. קולטנים אלה מכילים 7 מקטעים (domains) טרנס-ממברנליים הקשורים לחלבוני G ופועלים דרך cAMP (על פי Juaneda וחב' משנת 2000 ב-Trends Pharmacol Sci).
השפעת amylin על רקמת העצם
יש השערה ש-8 חומצות האמינו בקצה ה-N טרמינאלי של amylin, כולל הטבעת הדי-סולפידית בין שיירי ציסטאין בעמדות 2 ו-7, הן בעלות תפקיד בגירוי השגשוג של תאים בוני עצם, אוסטיאובלסטים, זאת בשיתוף פעולה עם קלציטונין. באוסטיאובלסטים של עוברי חולדות מולקולת amylin שלימה, או המקטע בן 8 חומצות האמינו בקצה ה-N טרמינאלי מעודדים שגשוג תאים אלה. לעומת זאת, המקטע בן 29 חומצות אמינו (8-37) בקצה הקרבוקסילי שעבר אמידציה, וכן גם amylin שעבר תהליך חיזור המבקע את הקשר הדיסופידי בין שיירי ציסטאין 2 ו-7, פועלים באופן אנטגוניסטי שאינו מאפשר שגשוג אוסטיאובלסטים. כצפוי המולקולה השלימה של amylin מעכבת את תהליך ספיגת העצם על ידי תאים אוסטיאוקלסטים (על פי Cornish וחב' ב-Am J Physiol Endocrinol Metabol משנת 1998).
הפרדה זו בין פעילויות Amylin ומקטעיו על תאים מרכזיים במטבוליזם של עצם, מרמזת לכך שפפטיד זה פועל דרך 2 קולטנים נפרדים, אחד מהם על אוסטיאוקלסטים (ייתכן שמדובר בקולטן לקלציטונין), ואילו הקולטן השני על פני אוסטיאובלסטים. מתן יומי של מקטע 1-8 של amylin לעכברים בוגרים למשך 4 שבועות הגדיל משמעותית את עובי הקורטקס של העצם, את אורך עצמות השוֹקָה (tibia), ואת נפח העצם הטרבקולארית (Cornish וחב' ב-Am J Physiol Endocrinol Metabol משנת 2000). כל הנתונים הללו מצביעים על כל שהקשר הדיסולפידי Cys2-Cys7 חיוני להשפעת amylin על רקמת העצם.
מחקר מעניין הכורך פעילות מפחתת של amylin עם תהליך אוסטיאופורוזיס בבני-אדם, התפרסם על ידי Bronsky ו-Prusa בשנת 2003 ב-Osteoporos Int. כיוון ש-amylin ומקטעיו מעודדים שגשוש של אוסטיאובלסטים, מעכבים ספיגת עצם ומגבירים את צפיפותה ואת המסה שלה, החליטו חוקרים אלה למדוד בצום רמות amylin ב-25 נשים ו-3 גברים בגיל ממוצע של 64 שנים הלוקים באוסטיאפורוזיס, וכן בקבוצת ביקורת של 24 אנשים בריאים (11 גברים ו-13 נשים בגיל ממוצע של 53 שנה). נמצא שסך רמת amylin הממוצעת בחולים עם אוסטיאופורוזיס הייתה 3.33±0.46 פיקומול' לליטר, בעוד שבחולי סוכרת type 2 היא הייתה בממוצע 6.29±1.47 פיקומול' לליטר, שעה שבאנשים בריאים נמדדה רמה ממוצעת של ±3.12 8.48 פיקומול' לליטר. מחקר זה מרמז לאפשרות של מעורבות חסר ב-amylin לתהליך של אוסטיאופורוזיס.
כאשר יצרו עכברים knockout טרנסגניים עם אי-יצירת amylin, התברר שהם נכשלים להגיע לשלב הנורמאלי האנורקטי מייד לאחר ארוחות. את ההשפעה האנורקטית של amylin לאחר ארוחות מייחסים לעובדה שפפטיד זה עבר אמידציה, בדומה לנוירופפטידים רבים.
התכשיר Pramlintide
למרות היתרונות הצפויים לכאורה של טיפול ב-amylin כתוסף-עזר טיפולי לאינסולין, היישום של טיפול זה התעכב והוגבל בגלל מסיסותו הנמוכה של amylin, בגלל נטייתו לעבור צימות עצמי ולהיספח למשטחים ולממברנות. כיוון ש-amylin טבעי הוא בעל תכונות עמילואידוגניות ופוטנציאל של טוקסיות, האיסטרטגיה של חברת Amylin pharmaceuticals, הייתה לבטל את התכונה העמילואידוגנית על ידי שחלוף של חומצות האמינו אלנין בעמדה 25 וסרין בעמדות 28 ו-29 של הפפטיד המקורי, בחומצת האמינו פרולין, הידועה כחומצת אמינו "שוברת מבנים פפטידיים", וכך נוצר התכשיר pramlintide (שם מותג Symlin) שהוא פפטיד בעל מטען חשמלי חיובי, המאושר מאז שנת 2005 על ידי ה-FDA לטיפול במבוגרים עם סוכרת type 1 או type 2 הצורכים אינסולין לפני הארוחה. התכשיר pramlintide משווק כמלח אצטט של הפפטיד. למרות ש-FDA אישר שימוש ב-pramlintide למבוגרים בלבד, מספר מחקרים הראו שתכשיר זה בטיחותי ויעיל בנערים ונערות, בסביבה תומכת ומפקחת.
בין יתרונותיו של pramlintide הפחתה ברמת המוגלובין A1C והפחתת משקל בחולי סוכרת type 2 המטופלים עם אינסולין (Hollander וחב' ב-Obesityמשנת 2004). על ידי הגברת ההשפעה של amylin אנדוגני, pramlintide מסייעת בקליטת גלוקוזה על ידי התאים ולוויסות של רמת הסוכר בדם על ידי האטת התרוקנות הקיבה, הגברת תחושת השובע על פעולה על קולטנים בהיפותלמוס (השונים מהקולטנים של GLP-1), ועיכוב הפרשת גלוקאגון, שפעולתו מנוגדת לזו של אינסולין ו-amylin. כיוון שהשפעת pramlintide היא למשך 2-3 שעות, הדבר מפחית את הנטייה לצריכת חטיפים בין ארוחות, מה שיכול להסביר את האיבוד של 2.5 ק"ג במשקל בקרב צורכי תכשיר זה במהלך 6 החודשים הראשונים לצריכתו.
השימוש ב-pramlintide מאפשר הפחתת מינון אינסולין, ופרט לאנאלוגים של אינסולין, pramlintide הוא התכשיר היחיד שאושר על ידי ה-FDA לשימוש להפחתת רמת גלוקוזה בחולי סוכרת type 1, מאז האישור שניתן לאינסולין עצמו בשנות ה-20 של המאה שעברה.
יתרונותיו של pramlintide בהיותו פפטיד יציב, מסיס, שאינו עובר צימות (self-aggregation), המוזרק תת-עורית לפני הארוחה. התכונות הפרמאקוקינטיות, פרמאקודינמיות ותכונותיו הביולוגיות, הן ברות השוואה לאלו של amylin אנדוגני (Rink וחב' ב-Trends Pharmacl Sci מ-1993). כמו כן pramlintide אינו גורם להיפו-גליקמיה אף במינונים היפר-פיזיולוגיים באנשים בריאים (Amiel וחב' ב-Diabetes Obes Metab מ-2005). בנוסף, pramlintide אינו מפריע בתהליך ההתאוששות מהיפו-גליקמיה הנגרמת על ידי אינסולין ( Whitehouse וחב' ב-Diabetes Care מ-2002, ו-Ratner וחב' ב-Diabet Med משנת 2004).
היעילות של pramlintide
תכשיר זה נבחן בניסויים קליניים אקראיים בחולי סוכרת על 2 סוגיה. בסוכרת type 1, הזרקה תת-עורית של pramlintide במינונים של 30-60 מיקרוגרם לפני הארוחה, הביאה לירידה מתונה של פחות מ-1% ברמת המוגלובין A1C בניסוי שנמשך 52 שבועות (Ratner וחב' משנת 2002 ב-Diabetes Technol Ther). בניסוי זה יותר מטופלים השיגו יעד Hb A1C של פחות מ-7% בין מטופליpramlintide (כ-25% מהמטופלים) בהשוואה לפלצבו (11.3% מהמטופלים), ללא צורך בהגברת מינון אינסולין וללא התרחשות מקרים של היפוגליקמיה חמורה. ירידות מתונות במשקל (0.5 ק"ג בממוצע) נרשמו בקבוצת pramlintide, בהשוואה לעליות משקל במטופלים עם אינסולין בלבד.
תוצאות דומות נמצאו בניסוי אקראי גדול נוסף עליו דיווחו Riddle וחב' ב-Diabetes care ב-2007, בו המינון היה 60 מיקרוגרם pramlintide ב-3-4 טיפולים ביום, בהם איבוד המשקל אף היה יותר שכיח בקרב מטופלים שמנים, מאשר בקרב אלה עם משקל גוף נורמאלי, ואף לא נרשמו בו תופעות של בחילה.
ניסויים מבוקרים כנגד פלצבו באלה עם סוכרת type 2 נתנו תוצאות דומות: כאשר הוסיפו טיפול ב-pramlintide לטיפול באינסולין (עם או ללא סולפוניל-אוריאה או metformin), הירידות בהמוגלובין -A1C (בממוצע 0.62%), או במשקל הגוף (בממוצע 1.4 ק"ג), התקבלו במינון pramlitide של 120 מיקרוגרם, אך לא בטיפול של 90 מיקרוגרם הניתנים פעמיים ביום (Riddle וחב' ב-Diabetes Care משנת 2009). סיכום של תוצאות ממספר ניסויים הראה שירידה בדרישה לאינסולין כמו גם הירידה במשקל הגוף היו גדולות יותר בטיפול ב-pramlintide במטופלים השמנים יותר (Wysham וחב' ב-Curr Med Res Opin משנת 2008).
בניסוי של 24 שבועות בקרב מטופלים עם סוכרת 1 type בלתי מאוזנים, התוספת לפני ארוחות של pralintide לטיפול בסיסי באינסולין, אם או בלי תוספת של תכשירים פומיים מקובלים, נמצאה בעלת יעילות גליקמית דומה לזו של אנלוגים פומיים של אינסולים מהירי-תגובה, בהפחתת A1C בערך ב-1%(על פי Cariello וחב' ב-Diabetes Metab Res Rec מ-2008. מטופלים שנבחרו אקראית לקבל pramlintide, שמרו על משקלם וזאת לעומת אלה שטופלו בנגזרי אינסולין מהירי-תגובה בהם נרשמה עליה ממוצעת של 4.7 ק"ג במשקל. טיפול סינרגי ב-pramlintide היה כרוך בפחות אירועים של היפוגליקמיה מאשר טיפול באינסולין בשעת הארוחה (Hollander וחב' ב-Obes Res מ-2004 ו-Kovatchev וחב' ב-Diabetes Technol Ther משנת 2008).
מתן pramlintide לפני הארוחה מאפשר להפחית את מינון אינסולין ב-17% בממוצע כדי לקבל השפעה מיטבית על רמת גלוקוזה שלאחר הארוחה (Schmitz ב-iabetes משנת 2004). גם King בסקירתו משנת 2009 ב-Endocr Pract הגיע למסקנה דומה. Maggs וחב' הדגימו ב-Diabetes Metab Res Rev משנת 2004, שריבוי המקרים של התרחשות היפוגליקמית הנצפית בולי סוכרת type 1, קשורה לאי-ההתאמה בזמן של נטילת אינסולין בעת הארוחה לבין מועד השיא ברמות גלוקוזה בעקבות הארוחה (post-prandial). כיוון ש-pramlintide מעכב את התרוקנות הקיבה, הוא משהה את שיא רמות הגלקוזה, כך שאנלוגים מהירי-פעולה של אינסולין הנלקחים לפני הארוחה, יכולים למנוע באופן יעיל יותר את רמות השיא של גלוקוזה בעקבות הארוחה, אך יש בכך סיכון מוגבר להגיע למצבי היפוגליקמיה מוקדמת.
אי לכך יש לנקוט זהירות יתרה ועל בסיס אינדיבידואלי בקביעת נקודת הזמן המדויקת בה מזריקים pramlintide ואת המינון המדויק, כאשר משתמשים בתכשיר זה בחולי סוכרת על סוגיה המשתמשים באינסולין לפני הארוחה. כיוון ש-pramlintide שוקע ב-pH5.5, והוא צריך להיות מוזרק בהפרש זמן מאינסולין ובנקודת הזרקה שונה (Weyer וחב' ב-Diabetes Care משנת 2003), הזמן האופטימאלי להזרקתו הוא מייד לפני הארוחה (Riddle ו-Druckerב-Diabetes Care משנת 2006 ו-King ב-Diabetes Technol Ther משנת 2010).
על פי האישור של ה-FDA, כאשר הושג יעד הטיפול ב-pramlintide מבחינת המינון האופטימאלי של תכשיר זה, יש במקרים אחדים צורך בהפחתת מינון האינסולין הניתן לפני הארוחה עד כדי 50%, ויש צורך לטטר מינון זה כלפי מעלה כדי להשיג מצב של euglycemia. אך רוב המטופלים יזדקקו להפחתה מתונה יותר במינון האינסולין שלפני הארוחה, כאשר אלה עם משאבות אינסולין הנמצאים תחת בקרה כמעט אופטימאלית של רמת הגלוקוזה, נזקקים להתאמות מינימאליות של פחות מ-10% ברמת האינסולין הפרנדיאלי לאחר הזרקה מקדימה של pramlintide (על פי Creutzfeldt ב-Regul pept משנת 2005).
היבטים של השפעת pramlimtide על קצב התרוקנות הקיבה
ההשפעה של pramlintide על קצב התרוקנות הקיבה תואר הן בזן BB של חולדות סוכרתיות (Young וחב' משנת 1995 ב-Diabetologia) וכן בחולים עם סוכרת type 1 בהם נמצא שהזרקה בודדת של התכשיר במינון של 30, 60 או 90 מיקרוגרם עיכבה התרוקנות הקיבה (על פי Kong וחב' ב-1998 באותו כתב עת). מחקרם של Gedulin וחב' משנת 1997 ב-Metabolism, מרמז לכך שבחולדות השפעת pramlintide גם על עיכוב התרוקנות הקיבה בחולדות מתווכת על ידי עיכוב התפקוד של העצב הוואגאלי.
מנגנון זה באדם היה פחות ברור, ומחקר של Vella וחב' ב-Neurogstroenterol Mot משנת 2002, לקח על עצמו בירור לברר את הדינמיקה של עיכוב התרוקנות הקיבה בחולים עם סוכרת משני הסוגים בהשפעת pramlintide. מחקר זה הראה תגובה דומה בעיכוב התרוקנות הקיבה על ידי pramlintide בשני סוגי הסוכרת: הזרקה תת-עורית של 30 מיקרוגרם פעמיים ביום של התכשיר גרמה להתרוקנות של 50% מתכולת הקיבה תוך 268±37 דקות בממוצע, ואילו מינון של 60 מיקרוגרם של התכשיר במתכונת דומה, הביא להתרוקנות 50% מתכולת הקיבה תוך 329±49 דקות. בהזרקות של פלצבו באותה מתכונת, התרוקנות 50% מתכולת הקיבה התרחשה בממוצע לאחר 91±6 דקות.
הנחיות של ה-FDA כהתניות לאישור השימוש ב-pramlintide
- אין להזריק תכשיר זה למטופלים הידועים ככאלה שאין להם כל תודעה בכל הקשור למשמעות תרחישי היפוגליקמיה חמורים.
- מתן pramlintide מותר רק לפני ארוחות המכילות לפחות 250 קלוריות או 30 גרם של פחמימות.
- המינון ההתחלתי המומלץ של pramlintide במקרים של סוכרת type 1 הוא 15 מיקרוגרם לפני כל ארוחה, עם עלייה במינון של 15 מיקרוגרם כל 3 עד 7 ימים, במידת הסבילות, ליעד של 60 מיקרוגרם לפני כל ארוחה. במקרים של בחילות עיקשות כתופעת לוואי של התכשיר, יש לרדת במינון עד שהבחילות חולפות ולטטר בזהירות בכיוון של עלייה בריכוזי התכשיר.
- המינון ההתחלתי במקרים של סוכרת type 2 הוא 60 מיקרוגרם, כאשר עולים בהדרגה במינון עד ליעד של 120 מיקרוגרם בכל ארוחה.
- כיוון ש-pramlintide מעכב את התרוקנות הקיבה ואף יכול לעכב את קצב הספיגה של תרופות הנלקחות באופן פומי, למטופלים הסובלים מגסטרופרזיס מומלץ לא להשתמש בתכשיר זה. תרופות פומיות המשיגות את יעילותן על ידי ספיגה מהירה, אמורים ליטול תרופות אלה שעה אחת לפני או שעה אחת אחרי הזרקת pramlintide.
- בסוכרת type 1 יש להזריק pramlimtide עם כל ארוחה, אך בסוכרת type 2 יש להזריק תכשיר זה לפחות פעמיים ביום.
- אין לערבב pramlitide ואינסולין באותו מזרק, ולתיתו בהזרקה סימולטנית.
- ניתן לשקול שימוש ב-pramlintide בחולי סוכרת על 2 סוגיה, בעלי מוטיבציה גבוהה אך למרות זאת אינם מאוזנים, בייחוד באלה עם סוכרת type 1 המטופלים באינסולין מספר פעמים ביום, או כאלה המחוברים למשאבת אינסולין העולים במשקלם למרות שינויים באורח חייהם, וכן במטופלי סוכרת type 2 העולים במשקלם למרות התאמות באורח חייהם.
- אין נתונים ראויים כדי לתמוך בשימוש ב-pramlintide במקרים הבאים: במטופלים שאינם צורכים אינסולין; במטופלים עם היסטוריה של תרחישים היפו-גליקמיה חמורה חוזרים, או באלה עם חוסר מודעות למשמעות תרחישים אלה; באלה המטופלים ב-exenatide או בתכשירים אחרים המבוססים על GLP-1.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק