הנחיות תזונתיות לטיפול בשחמת הכבד - נייר עמדה
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
|
| |
|---|---|
| הנחיות תזונתיות לטיפול בשחמת הכבד | |
| האיגוד המפרסם | פורום גסטרו, עמותת עתיד – עמותת הדיאטנים והתזונאים בישראל |
| תאריך פרסום | פברואר 2022 |
| יוצר הערך | מחברות המסמך |
| ניירות עמדה מתפרסמים ככלי עזר לרופא/ה ואינם באים במקום שיקול דעתו/ה בכל מצב נתון. כל הכתוב בלשון זכר מתייחס לשני המגדרים. | |
תקציר
מטרת הטיפול התזונתי בשחמת היא לספק תמיכה תזונתית למניעה וטיפול בתת תזונה, תוך התחשבות במצבים נלווים כמו זיהומים, מיימת ואנצפלופתיה. חשוב לאתר כל מטופל עם שחמת לסיכון לתת תזונה ולהתאים לו תכנית טיפולית אישית.
ההערכה והטיפול התזונתי מחייבים התייחסות לנושאים הבאים: הערכה פיזיקלית של המטופל (משקל יבש, דלדול שרירים, כוח שריר, מאגרי שומן, מיימת, בצקת), שינוי משקל והיסטורית משקל, בדיקות מעבדה, תסמינים קליניים (עייפות, חולשה, חוסר תיאבון, שינויים בטעם, תחושת מלאות), בעיות גסטרו-אינטסטינליות (בחילה, הקאות, שלשולים, עצירות, דליות ושט/קיבה ודמם GI) ונוכחות סיבוכים או מחלות נוספות.
התזונה המומלצת במצב של שחמת, לרבות שחמת עם אנצפלופתיה היא עשירה באנרגיה ובחלבון כתלות בסטטוס תזונתי ו- BMI. ישנה חשיבות רבה לחלוקה לארוחות כל 3-6 שעות, עם דגש על ארוחת בוקר וארוחת לילה מאוחרת. שימוש במזון ייעודי יכול לשמש כתחליף לארוחה או כארוחת ביניים. הגבלת נתרן תעשה במקרים של צבירת נוזלים, אך לא על חשבון ירידה בכמות האכילה.
פעילות גופנית מתונה, מותאמת אישית, לפחות 4 פעמים בשבוע, מומלצת לשיפור מסת שריר, איכות חיים, חולשה וירידה בלחץ דם פורטלי.
מחברות המסמך
(לפי סדר א'-ב')
- פרופ' זלבר-שגיא שירה - דיאטנית ואפידמיולוגית, PhD, RD, בית הספר לבריאות הציבור, אוניברסיטת חיפה, המכון למחלות דרכי העיכול והכבד, המרכז הרפואי תל אביב ע"ש סוראסקי
- לוסטיגמן חגית - דיאטנית RD, היחידה לתזונה קלינית, מרכז רפואי רבין השרון
- נתנאל כרמית - דיאטנית MHA, RD, המחלקה לתזונה, המרכז למחלות כבד, המרכז הרפואי שיבא תל-השומר
- ד"ר ענבר רונית - דיאטנית PhD, RD, המחלקה לתזונה ודיאטה, המרכז הרפואי תל אביב ע"ש סוראסקי
- פולאן דוראל - דיאטנית RD, המחלקה לתזונה ודיאטה, המרכז הרפואי תל אביב ע"ש סוראסקי, מכבי שירותי בריאות מחוז השרון
- ששון-אברהם אודליה - דיאטנית RD, המחלקה לתזונה ודיאטה, המרכז הרפואי הדסה עין כרם
הקדמה
שחמת הכבד הוא מצב בו רוב רקמת הכבד הבריאה מוחלפת ברקמה צלקתית (פיברוזיס) וככל שדרגת הצלקות גדלה, פוחתת יכולת התפקוד של הכבד על מגוון פעולותיו עד כשל בתפקודו. במהלך הטבעי של התפתחות המחלה, שחמת הכבד יכולה להתבטא באופן מפוצה (compensated cirrhosis), ללא תסמינים קליניים. בהמשך חלה עלייה ביתר לחץ דם פורטלי ומתפתחת שחמת בלתי מפוצה (Decompensated cirrhosis), המאופיינת בהופעת סימפטומים משמעותיים כמו: מיימת, אנמיה, אנצפלופתיה, פריטוניטיס (SBP- spontaneous bacterial peritonitis) ודמם מדליות בוושט או ממערכת העיכול. מצב זה יכול להחמיר עם התפתחות סיבוכים נוספים כמו: דימומים חוזרים, נזק כלייתי ( - AKI Acute kidney injury) עם או בלי אפיונים של תסמונת הפטו-רנלית (HRS - Hepatorenal syndrome), קרדיומיופתיה שחמתית, סינדרום הפטו-פולמונרי ויתר לחץ דם פורט-פולמונרי.
מחלת הכבד השומני היא הסיבה המובילה לשחמת הכבד. אטיולוגיות נפוצות נוספות לשחמת כוללות: מחלות וירליות (HBV, HCV, HDV), מחלות אוטואימוניות (הפטיטיס אוטואימונית, כולנגיטיס מרתית ראשונית – Primary biliary cholangitis PBC, דלקת צלקתית ראשונית של דרכי המרה - Primary sclerosing cholangitis PSC), הרעלה (אלכוהול, ארסן), מחלות מטאבוליות (כבד שומני, חסר באלפא 1 אנטיטריפסין, גלקטוזמיה, מחלת אגירת גליקוגן, המוכרומטוזיס, מחלת וילסון), מחלות דרכי מרה (אטרזיה, אבנים, גידול), מחלות וסקולריות (BUDD-CHIARY syndrome, פיברוזיס לבבי), מחלות גנטיות (ציסטיק פיברוזיס, חסר ליפאז ליזוזומלי), פגיעה ביליארית, או תרופות[1][2].
הערכת חומרת המחלה בשחמת
ישנם שני כלי סיקור מקובלים להערכת חומרת מחלת הכבד: Child Pugh score וציון ה- Model for End Stage Liver Disease (MELD).
Child Pugh score - משמש להערכת הפרוגנוזה של מחלת הכבד הכרונית ולהערכת הטיפול והצורך בהשתלה. המדד מדורג כ- A, B, או C, כאשר C היא דרגת החומרה הגבוהה ביותר ומעידה על שחמת כבד בלתי מפוצה. הפרמטרים הנלקחים לחישוב הם: סך בילירובין, אלבומין בסרום, זמן פרותרומבין (PTT) ונוכחות מיימת ואנצפלופטיה כבדית. מטופלים המדורגים כ- Child Pugh C הם בסיכון לתת תזונה[3].
ניקוד MELD - מיועד להערכת חומרת מחלת הכבד הכרונית לשם תיעדוף ברשימת מועמדים להשתלה. הנוסחה לוקחת בחשבון מדדים של סך בילירובין, INR וקריאטנין בסרום. ניקוד MELD נעשה על ידי המרכזים הרפואיים ומועבר למרכז הלאומי להשתלות שבמשרד הבריאות והוא הגוף האחראי להקצאת איברים להשתלה[4].
שכיחות וגורמים לתת תזונה במטופלים עם שחמת
תת תזונה הוא מצב שכיח במטופלים עם שחמת, עד כדי 72% מהמטופלים. שכיחות תת-תזונה גבוהה יותר בדרגות חמורות יותר של המחלה (45%, 73% ו-95% בדרגות CHILD Pugh A, B ו-C, בהתאמה) וקשורה לאחוזי הישרדות נמוכים יותר לאחר מעקב של שנה (59% שרידות במטופלים עם תת-תזונה לעומת 81% במטופלים עם סטטוס תזונתי תקין)[3].
הסיבות לתת תזונה כוללות:
- מצב היפרמטאבולי – בחולי שחמת נפגעת יצירת גליקוגן ואחסונו בכבד. כתוצאה מכך, כבר במצב של צום של כמה שעות (לרבות במהלך הלילה) מתרחשת עלייה מוקדמת בליפוליזה ובגלוקונאוגנזה, המובילה לעלייה בהוצאה האנרגטית במנוחה. העלייה הממושכת בדרישה האנרגטית מובילה לפירוק חלבון ממאגרי השריר לצורך הפקת אנרגיה מחומצות אמינו ובכך עולה הדרישה לחלבון וכן מוגברת יצירת אמוניה מתוצרי פירוק החלבון
- צריכה ירודה של מזון - עקב תיאבון ירוד, או תחושת מלאות מוקדמת בנוכחות מיימת. בנוסף, תזונה מוגבלת בנתרן עלולה לגרום לירידה נוספת בצריכה, בשל פגיעה בטעם, או פחד לאכול מזונות מחשש שמכילים נתרן. גם השפעה של תרופות משלשלות (כמו Lactulose וdyufalak) הניתנות למניעה של אנצלופתיה, מובילות לירידה בצריכת המזון בשל תופעות הלוואי שהן גורמות במערכת העיכול
- פגיעה באיכות הספיגה – עקב ירידה בייצור והפרשת המרה ובצקת בדופן המעי הנובעת מרמה נמוכה של האלבומין בסרום[5][6][7][8].
שכיחות תת-תזונה מושפעת מחומרת המחלה ושונה בין שיטות סיקור שונות. הערכתו התזונתית של חולה הכבד מורכבת משני שלבים: הערכת סיכון מהירה לתת תזונה ובשלב הבא, הערכה תזונתית מלאה.
הערכת הסיכון לתת תזונה
כלי סיקור להערכת הסיכון לתת תזונה כוללים את מדד מסת הגוף (BMI) וה– Royal Free Hospital Nutritional Prioritizing Tool (RFH-NPT).
BMI (=משקל/גובה2) מתחת ל-18 ק"ג/מ2, מהווה גורם סיכון מוגבר לתת תזונה בחולי שחמת, הקשורה לאיבוד שריר. לשם קביעת משקל יבש מוערך יש לקחת בחשבון נוכחות בצקות בגפיים ונוכחות מיימת. הערכת המשקל היבש תעשה לפי המשקל לאחר ביצוע ניקור נוזלים, או אם ידוע, לפי המשקל לפני שהחלה צבירת הנוזלים. לחלופין, ניתן להפחית אחוז משקל גוף לפי חומרת המיימת (מיימת קלה 5%, בינונית 10%, חמורה 15%) ולהפחית 5% נוספים אם קיימת בצקת דו צדדית ברגליים[9].
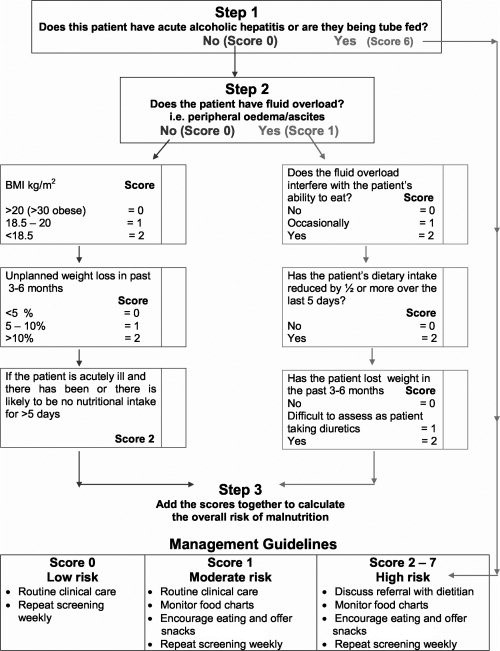
RFH-NPT – כלי סיקור לקביעת מידת הסיכון התזונתי בחולי שחמת הכבד (תרשים מצורף בנספח 1) הכולל התייחסות למדדים הבאים: הזנה דרך צינורית, קיום מחלת כבד אלכוהולית חריפה, צבירת נוזלים - בצקות/מיימת ומידת הפרעתה באכילה, או BMI נמוך, צריכה תזונתית מופחתת ב-5 ימים אחרונים, איבוד משקל ב־3-6 חודשים אחרונים, שילוב של מחלה אקוטית יחד עם צריכה תזונתית מופחתת במשך לפחות 5 ימים. הסיכון לתת תזונה נקבע לפי סכימת הנקודות בכל מדד ולפיו נקבעת מידת ההתערבות התזונתית[10]. כלי זה נמצא קשור לסיבוכים כמו מיימת, אנצפאלופתיה ותסמונת הפטו-רנאלית והוא מנבא עצמאי להתקדמות מחלת הכבד ולשרידות[11]. כלי זה הוא פשוט מאוד לשימוש ואינו דורש זמן או מיומנות גבוהה של הבודק.
הערכה תזונתית של מטופלים עם שחמת
הערכה תזונתית מפורטת למטופלים עם שחמת שנמצאו בסיכון לתת תזונה כוללת את המרכיבים הבאים: הערכה כללית, הערכת דלדול מסת שריר, הערכת שבריריות, הערכת צריכה תזונתית והתייחסות למטופלים עם עודף משקל. הערכה זו יכולה להתבצע במסגרת מרפאה או במהלך אשפוז[9].
כלים להערכה תזונתית
כלים להערכה כללית כוללים את שאלוני ה- Subjective Global Assessment (SGA) וה- Royal Free Hospital Gobal Assessment Scheme (RFH-GA Scheme).
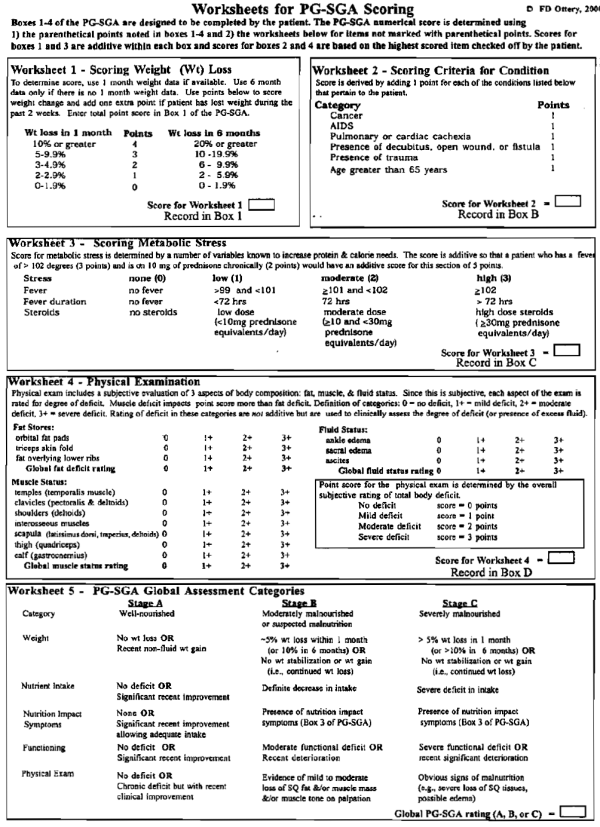
שאלון ה – SGA - כולל הערכה סובייקטיבית של המדדים הבאים: אובדן משקל, צריכה תזונתית, תסמונות של מערכת העיכול (כמו שלשול, הקאות ואנורקסיה), רמת תפקוד גופני, תחלואה ובדיקה גופנית להערכת איבוד מסת שומן, דלדול מסת שריר ובצקות[12] (תרשים מצורף בנספח 1). SGA נמצא קשור למדדים קליניים של חומרת המחלה כולל דרגת מיימת ודירוג Child Pugh וכן למשתנים פרוגנוסטיים אחרי השתלת כבד (איבוד דם ושימוש במוצרי דם) ולתמותה[13][14][15]. עם זאת, כלי זה דורש זמן ומיומנות קלינית רבה של הבודק.
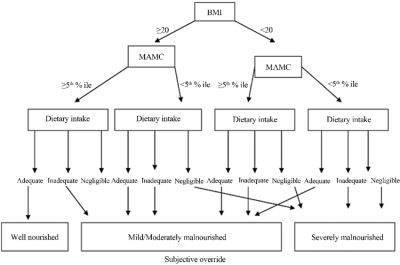
RFH-GA Scheme - כלי זה מתוקף לחולי שחמת הכבד. הכלי כולל שאלון מפורט על מדדים אובייקטיביים וסובייקטיביים (תרשים מצורף בנספח 3): BMI, היקף זרוע, צריכה תזונתית, פעילות גופנית והערכה קלינית לגבי תפקוד כלייתי, כבדי ותסמונות של מערכת העיכול (כמו שלשול, הקאות ואנורקסיה). לכל פרמטר ישנו דירוג הנסכם לקביעת קטגוריות לסטטוס תזונתי: תקין, בינוני או ירוד. בנוסף, בדירוג הכללי ישנה התייחסות סובייקטיבית של הבודק[16]. RFH-GA נמצא כמנבא תמותה בחולי שחמת וסיבוכים לאחר השתלה[9]. כלי זה פשוט ולא יקר, אך דורש זמן ומיומנות של הבודק.
הערכת דלדול מסת שריר (סרקופניה)
סרקופניה (sarcopenia) המוגדרת כדלדול מסת שריר השלד, היא ביטוי לתת תזונה ונפוצה בחולי שחמת הכבד, עם שיעור של 30-70%[17].
סרקופניה מהווה גורם סיכון לאיכות חיים ירודה וסיבוכי תחלואה ותמותה לפני ולאחר השתלת כבד[9][18][19][20]. כלים להערכת סרקופניה כוללים: טומוגרפיה ממוחשבת (CT), שאלון ה- SARC-F, היקף אמצע זרוע ומדידת קפלי עור, הערכת כוח האחיזה ביד (Hand Grip), DEXA ו-BIA.
הדמיית CT להערכת סרקופניה - נחשבת לשיטה המדויקת ביותר לאבחנה של סרקופניה. המדידה נעשית על ידי חישוב חתך השטח של שרירי השלד המותניים בגובה חוליה L3 ונרמול לפי הגובה. בניסוי רב מרכזי גדול, נקבע מדד סף לסרקופניה המהווה גורם סיכון לתמותה מוגברת בחולי שחמת הממתינים להשתלה (50 ס"מ/מ2 עבור גברים ו- 39 ס"מ/מ2 עבור נשים)[21]. חסרונות בדיקת ה-CT כוללים עלות גבוהה וחשיפה לקרינה. עם זאת, רוב חולי השחמת המועמדים להשתלת כבד מבצעים הדמיית CT כחלק מההערכה לפני השתלה, על כן ניתן להטמיע את חישוב מדד הסרקופניה כחלק משגרת הבדיקה.
שאלון ה-SARC-F - כלי פשוט להערכת סרקופניה, שעבר תיקוף למחלות כבד[22]. כלי זה כולל 5 שאלות על היכולות התפקודיות הבאות: הרמה ונשיאה, הליכה, קימה מישיבה, טיפוס מדרגות ונפילות. עבור כל מרכיב ניתן ציון מתוך טווח של 0 עד 2 נקודות, כאשר ציון 4 ומעלה הוא מנבא לסרקופניה[23]. שכיחות ציון גבוה ב-SARC-F עולה במטופלים עם מחלת כבד מתקדמת[24]. לשאלון רגישות נמוכה (14%-45%), אך סגוליות גבוהה (90%–95%)[22][25], על כן הוא יכול לסייע לאתר מטופלים שצריכים הערכה נוספת לצורך אבחון סרקופניה.
מדידת היקף אמצע זרוע (Mid-Arm Muscle Circumference MAMC) – מחושבת באופן הבא:
MAMC = MAC – (3.14 x TSF thickness), כאשר MAC = Mid-Arm Circumference, TSF = Triceps skinfold. MAMC מהווה מדד פרוגנוסטי לתמותה בקרב מטופלים עם שחמת לפני ואחרי השתלת כבד. בנוסף, מדידת ה-MAMC נמצאה בקורלציה חיובית מובהקת למדידת סרקופניה על ידי CT, בקרב גברים. מדידה זו פשוטה לביצוע, מהירה, זולה ואינה מושפעת מצבירת נוזלים. עם זאת, עליה להתבצע על ידי בודק מיומן[9].
כוח אחיזת יד (Hand grip - HG) - כלי פשוט, זמין ויעיל כמדד לסרקופניה. מהווה גורם מנבא לסיבוכים ותמותה במטופלים עם שחמת והוא כלי מדידה ליעילות ההתערבות התזונתית[3][26][27]. הבדיקה מתבצעת על ידי לחיצה עם היד הדומיננטית על מכשיר דינמומטר, 3 פעמים. המדידה הגבוהה ביותר משמשת לחישוב, כאשר תוצאה הנמוכה מ-26 ק"ג לגברים ו-16 ק"ג לנשים, מעידה על סרקופניה.
DEXA (Dual Energy X-ray Absorptiometry) – בדיקת סריקה המשתמשת בקרני רנטגן ברמה נמוכה ומיועדת לבדיקת צפיפות עצם או לבדיקת הרכב הגוף (Total Body Composition). בדיקת הרכב הגוף נותנת מידע לגבי מסת שומן ומסת שריר (FM, LBM) לפי איברי הגוף (ידיים, רגליים, בטן, אגן). יתרונה בדיוק גבוה ובאורך בדיקה קצר של כ־10 דקות, מאידך, עלותה גבוהה והיא כרוכה בחשיפה לקרינה[9].
BIA (Bioelectrical Impedance Analysis) - בדיקה לא חודרנית להרכב הגוף המשתמשת במוליכות חשמלית, על ידי אלקטרודות בידיים ובכפות הרגלים בזמן עמידה. באמצעות מידת המוליכות בכל רקמה לפי כמות המים שבה יחושבו מסת הגוף ללא שומן (FFM) וסך המים בגוף (TBW). הבדיקה תספק מידע על כמות הנוזלים בגוף, מהתייבשות עד צבירת נוזלים ומסת שריר של גוף אתלטי, רזה, כחוש ושמן. בשחמת הכבד פאזת זווית נמוכה (כיחידת מדידה) קשורה בעליה בתמותה[28]. יתרונות בדיקת ה-BIA הן העלות הזולה, הניידות וקלות השימוש, עם זאת, היא תלויה בכמות הנוזלים בגוף ולכן מהימנותה נפגעת בחולי שחמת עם מיימת[9].
הערכת שבריריות
Fried frailty phenotype – כלי הכולל 5 קריטריונים להערכה על פי דיווח עצמי של המטופל: ירידה בלתי מכוונת במשקל, חולשת שרירים (נמדדת על ידי HG), הליכה איטית, סיבולת נמוכה/תשישות ורמת פעילות גופנית ממוצעת נמוכה{[29]. שבריריות מאובחנת על ידי נוכחות של שלושה קריטריונים או יותר. כלי זה הוא מנבא לתמותה בקרב מועמדים להשתלת כבד{[30] {[31], עם זאת, לא בקרב מטופלים עם אנצפלופתיה כבדית{[31] .
Short Physical Performance Battery - SPPB – כלי זה בודק ומדרג את היכולות הפיזיות הבאות: יציבה, מהירות הליכה וקימה מכיסא (ללא היעזרות בידיים). הבדיקה נערכת מספר דקות בלבד ובסופה מקבל הנבדק ציון מספרי מסכם. ציון מקסימלי הוא 12, כאשר ציון מתחת ל-10 מעיד על שבריריות. SPPB נמצא קשור לתמותה במטופלים עם שחמת{[30]{[32]{[33].
הערכת צריכה תזונתית
אנמנזה תזונתית חשובה להערכת צריכה קלורית ומסוגלות של המטופל לאכול, כמו כן, להערכת חוסרים תזונתיים. האנמנזה תכלול את הערכת הצריכה של המרכיבים הבאים: קלוריות, חלבון, נוזלים, תוספי תזונה ומספר וזמני הארוחות לאורך היום. בנוסף, יש לברר קיומם של מצבים המקשים על האכילה כגון: בחילות, הקאות, דחיה ממזונות, שינויים בטעם, שובע מוקדם, הגבלה בצריכת נתרן, כאבי בטן, שלשול, או עצירות. הדרך המהימנה ביותר להערכת הצריכה התזונתית היא באמצעות יומן אכילה ל-3 ימים, עם זאת היא דורשת היענות גבוהה העלולה להיות קשה להשגה במטופלים עם מחלה מתקדמת. שיטה יעילה ופשוטה יותר היא שאלון שחזור מזון של 24 שעות. במקרה של קושי באנמנזה, יש לפחות לברר האם היה שינוי יחסי בצריכה התזונתית ולמשך כמה זמן[9].
מדד אלבומין בסרום
רמת אלבומין בסרום היא מדד לתפקוד סינתטי של הכבד ואינה מהווה מדד תזונתי בפני עצמו. יתרה מכך, רמת האלבומין בסרום עולה בחולי שחמת עם מיימת המקבלים עירוי אלבומין לאחר ניקור מיימת ואינה משקפת את המצב התזונתי הירוד בחולים אלו.
הערכת מטופלים עם שחמת והשמנה
עם העלייה בשכיחות ההשמנה ושחמת על רקע NASH, נדרשת התייחסות למטופל השחמתי הסובל גם מהשמנת יתר. ההערכה היא ש-20-35% מחולי השחמת סובלים מהשמנה, גם בחישוב משקל יבש (ללא עודף נוזלים). השמנה אינה שוללת המצאות תת-תזונה וסרקופניה. ממצאים מראים ששכיחות NAFLD יכולה להיות מושפעת מסרקופניה, כאשר השמנה סרקופנית היא גורם סיכון ל-NAFLD וסמן להחמרה ולהתקדמות הכבד השומני לקראת שחמת[34]. השמנה ותסמונת מטאבולית נמצאו כגורם סיכון עצמאי להופעת סיבוכים[35][36], כמו כן, סוכרת נמצאה קשורה לסיבוכים ואף להישרדות נמוכה יותר בחולי שחמת[37][38]. השמנת יתר חולנית עם BMI מעל 40, מקושרת להגברת הסיכון לתחלואה ותמותה, לסרטן הכבד וכמו כן לסיבוכים לאחר השתלת כבד[9]. שילוב של סרקופניה והשמנה (sarcopenic obesity) נמצא בשיעורים משמעותיים בקרב מטופלים שחמתיים (כ-20%) וקשור לעלייה בתמותה[39]. להשמנה סרקופנית קשר הדוק יותר עם עמידות לאינסולין, לעומת השמנה או סרקופניה לבדן[40]. בקרב מטופלים שהוערכו לקראת השתלת כבד נמצא כי הסובלים מסרקופניה הראו שרידות נמוכה יותר, כשמתוכם, הקבוצה עם השמנת יתר סרקופנית הייתה עם הפרוגנוזה הגרועה ביותר[34].
מטופלים עם שחמת באשפוז
אשפוז מעלה סיכון להחמרה בתת-תזונה, בקרב חולי שחמת, עקב ריבוי ימי צום (לקראת בדיקות ופעולות), אכילה מופחתת של מזון בית החולים ואיחור במתן תוספות תזונתיות. ישנה חשיבות רבה לבצע סיקור, הערכה והתערבות תזונתית בשלב מוקדם של האשפוז בייחוד במועמדים להשתלה. העלאת מודעות בקרב צוות רפואי והתערבות מוקדמת של דיאטנית יכולה להביא לקיצור משך האשפוז ולהורדת שעורי חזרה לאשפוז[41][42].
יעדים תזונתיים בטיפול בשחמת
לחולי שחמת צרכים אנרגטיים וחלבוניים מוגברים על רקע הפרעות מטבוליות הכוללות היפר-קטבוליזם ועלייה בפירוק חלבון. תת-תזונה של חלבון ואנרגיה מקושרת לעלייה בפירוק החלבון וסרקופניה ויש לטפל בה כבר בשלבי המחלה המוקדמים.
התזונה המומלצת במצב של שחמת בלתי מפוצה, לרבות שחמת עם אנצפלופתיה, היא עשירה באנרגיה ובחלבון. רמות צריכת חלבון ואנרגיה של 1.2-1.3 ג'/ק"ג/יום ו-30–35 קק"ל/ק"ג/יום, בהתאמה, נמצאו כמורידות שיעורי תמותה ומפחיתות סיבוכים, הכוללים: אנצפאלופתיה, דימומים ממערכת העיכול וניקורי מיימת בנפחים גדולים[7]. במחקר רטרוספקטיבי שבדק רשומות מזון של 630 מטופלים עם שחמת, נמצא כי רק 24% עמדו ביעד תזונתי של 1.2 ג' חלבון/ק"ג/יום, כאשר ממוצע צריכת חלבון יומית היה 1±0.36 ג'/ק"ג. צריכה של חלבון פחותה מ־0.8 ג'/ק"ג/יום נמצאה קשורה לחומרת השחמת והייתה גורם עצמאי לניבוי תמותה[43].
בהנחיות של ה-EASL[9] ישנה המלצה ליעד קלורי, למטופלים ללא השמנה, של כ־35 קק"ל/ק"ג משקל גוף יבש, ויעד חלבון אופטימלי בין 1.2-1.5 גרם/ק"ג משקל גוף יבש. יתרה מכך, מחקרים מראים שחולי שחמת יכולים לנצל עד 1.8 גרם חלבון/ק"ג ליום. בעבר נטו להגביל צריכת חלבון בחולים עם אנצפלופתיה במטרה למנוע הצטברות אמוניה. מחקרים מראים כי הגבלת חלבון מהמזון אינה מפחיתה אנצפלופתיה, ומתן חלבון לפי היעד אף נמצא משפר מצב מנטלי. חולים קריטיים עם שחמת המאושפזים ביח' לטיפול נמרץ, צריכים לקבל בין 35–40 קק"ל/ק"ג, או כ־130% מערך ה- REE (Resting energy expenditure) שנמדד באמצעות קלורימטריה עקיפה, וכ־1.2-1.3 גרם חלבון לק"ג/ליום.
יעדים תזונתיים בטיפול בשחמת עם השמנה (BMI > 30)
במצב של שחמת מפוצה, הטיפול התזונתי מתבסס על אותם עקרונות טיפול במחלת הכבד השומני (NAFLD) וכולל ירידה מתונה במשקל ופעילות גופנית. ירידה במשקל, של כ-5-10% ממשקל הגוף, נמצאה כמפחיתה את סיבוכי המחלה ולכן מומלצת בקב' חולים זו[9][44][45].
מטופלים עם שחמת בלתי מפוצה ועודף משקל מהווים אתגר מבחינת ההמלצות לתמיכה תזונתית ונדרשים למעקב תזונתי צמוד. הגישה המקובלת בחולים אלו היא לשאוף לכיסוי חלבוני מקסימלי, עם כיסוי קלורי מופחת של 15–20 קק"ל/ק"ג ביום. גישה נוספת מציעה להפחית כ-500–800 קק"ל יומיות בחולי שחמת עם השמנה ומתן של לפחות 1.5 גרם חלבון/ ק"ג משקל גוף אידיאלי ליום. למטופלים עם BMI בין 30 ל־40 ק"ג/מ2, מומלצת הנחיה לצריכה אנרגטית של 25–35 קק"ל/ק"ג משקל אידיאלי ליום, ולמטופלים עם BMI גדול מ-40 ק"ג/מ2, 20-25קק"ל/ ק"ג משקל אידיאלי ליום[9]. כמו כן, מומלץ להנחות לאכול ארוחות קטנות לעיתים תכופות, עם הקפדה על ארוחת לילה (late evening snack)[34].
בחולי שחמת עם השמנה, לאחר ניתוח, הצריכה היומית המומלצת היא 25 קק"ל/ק"ג וכ־2 גרם חלבון/ק"ג לפי משקל גוף אידיאלי[46].
סיכום היעדים התזונתיים לטיפול בשחמת בלתי מפוצה מופיעים בטבלה 1.
טבלה 1: יעדים תזונתיים בטיפול בשחמת בלתי מפוצה
| BMI מחושב על פי משקל מצוי יבש (ק"ג/מ2) | יעד קלורי | יעד חלבון |
|---|---|---|
| מתחת ל-30 | לפחות 35 קק"ל/ק"ג משקל גוף יבש | 1.2-1.5 גרם/ק"ג משקל גוף יבש |
| שחמת במצבי חולי קריטיים ללא השמנה | 35-40 קק"ל/ק"ג משקל גוף יבש או 130% REE | 1.2-1.3 גרם/ק"ג משקל גוף יבש |
| מעל ל-30 ומתחת ל-40 | 25-35 קק"ל/ק"ג משקל גוף אידיאלי | לפחות 1.5 גרם/ק"ג משקל גוף אידיאלי |
| גדול מ-40 | 20-25 קק"ל/ק"ג משקל גוף אידיאלי | לפחות 1.5 גרם/ק"ג משקל גוף אידיאלי |
| מעל ל-30 לאחר ניתוח | 25 קק"ל/ק"ג משקל גוף אידיאלי | 2 גרם/ק"ג משקל גוף אידיאלי |
אנצפלופתיה כבדית
Hepatic Encephalopathy (HE) מוגדרת כסינדרום נוירופסיכיאטרי בנוכחות מחלה כבדית או/ו מעקף דם פורטוסיסטמי ושאינה מוסברת על ידי בעיה נוירולוגית אחרת. HE שכיחה יותר בחולי שחמת עם תת-תזונה. הסיכון ל-HE עולה לאחר ביצוע מעקף כלי דם מסוג TIPS (Transjugular intrahepatic portosystemic shunts) המיועד לטיפול במיימת קשה וביתר לחץ דם פורטלי מסכן חיים. הביטוי ל-HE הוא ב-4 רמות: מצב הכרה, תפקוד קוגניטיבי, שינוי באישיות וגירוי נוירומוסקולטרי (West-Haven Criteria). דירוג HE הוא על פי החומרה מ - 0 עד 4, כאשר 0 משקף מצב בו אין סימפטומים כלל, 1 -ירידה בערנות והתמצאות, 2 - איטיות וכבדות, 3 - ישנוניות עד ערפול חושים, ו-4 – תרדמת[2].
סדר ארוחות והימנעות מצום
ארוחת לילה עשויה להיות קשורה לשרידות טובה יותר, שיפור באיכות החיים ובסטטוס תזונתי וכן שיפור בחומרה ובתכיפות של אירועי אנצפאלופתיה[47][48]. עבודות הראו שמתן ארוחת לילה (Late-evening snack) למטופלים עם שחמת הכבד עשוי להקטין קטבוליזם חלבון, ולשפר סרקופניה. החברה האירופאית לתזונה קלינית ומטבוליזם המליצו על הימנעות מצום ממושך של מעל 12 שעות, לרבות צום לילה במטופלים אלה. ניסוי יחיד, מבוקר ורנדומלי עם כפל סמיות, השווה בין שתי קבוצות של חולי שחמת, למשך שנה. האחת (n=51), קיבלה העשרה תזונתית של 2 פחיות אנשור במהלך הלילה והשנייה (n=52), קיבלה את אותה העשרה בשעות היום. בקבוצה שקיבלה העשרה לילית נמצאה עלייה משמעותית ברמת החלבון בגוף (כפי שנמדדה על ידי neutron activation וכן עליה במסת השומן, ביחס לרמה ההתחלתית. עלייה זו לא נמצאה בקבוצת ההעשרה היומית. לא נצפה הבדל בצריכת חלבון ואנרגיה בין שתי הקבוצות (נבדק בשלושת החודשים הראשונים). 69% מהמשתתפים סיימו את המחקר[8].
במטא- אנליזה שנעשתה על ידי Chen ועמיתיו וכללה 8 עבודות בניסיון להעריך את היתרונות של ארוחת הלילה נמצא שיפור ברמות אלבומין, ירידה באנזימי הכבד (AST,ALT), אמוניה ותפקודי קרישה. בנוסף, ירידה בהיארעות אנצפלופתיה ומיימת, ללא עלייה ברמות גלוקוז בעקבות ארוחה זו. במחקרים שנכללו מרבית ארוחות הלילה נצרכו בין 21:00-22:00, לאורך תקופה של שבועיים (מחקר אחד) עד לשנה (4 מחקרים), והכילו כ-200 קק"ל ו - 13.5 גרם חלבון (למעט מחקר אחד בו ארוחת הלילה הכילה 320 קק"ל ו - 8 גרם חלבון), כאשר מקור החלבון היה BCAA[49].
בניסוי קליני רנדומלי ומבוקר, נבדקה השפעת ארוחת בוקר על התפקוד הקוגניטיבי של 21 חולי שחמת עם אנצפאלופתיה קלה, לעומת קבוצת בריאים. שעתיים לאחר אכילת ארוחת בוקר נמצאה עלייה במדדי ערנות וביצוע משימות, בקרב חולי השחמת שאכלו, לעומת חולי השחמת שהמשיכו את הצום מהלילה (אם כי בקבוצת הבריאים, רמת מדדים אלו הייתה גבוהה יותר בקרב אלו שהמשיכו לצום)[50].
חלבון ממקור צמחי וסיבים למטופלים עם אנצפאלופתיה
סבילות לחלבון משתנה ממטופל אחד לאחר ותלויה במקור החלבון. לחלבון ממקור צמחי עשויים להיות מספר יתרונות:
- הסיבים התזונתיים מפחיתים ספיגת אמוניה במעי
- חלבון צמחי דל בחומצות האמינו מתיונין וציסטאין, שהן פרה-קורסרים לתרכובות הקשורות למנגנון יצירת HE
- חלבון צמחי עשיר בחומצות האמינו אורניטין וארגינין המעורבות בתהליך סילוק האמוניה במעגל האוריאה.
כמו כן, לסיבים עשויה להיות השפעה מטיבה על המצב הנוירו-פסיכיאטרי של חולים עם שחמת, אך המידע על כך ממחקרים קליניים עדיין מאוד מוגבל. בנוסף, נדרשים מחקרים לבדיקת השפעתה של צריכת סיבים על המיקרוביום בחולי שחמת[5][6].
אף על פי שעדיין אין ביסוס של יתרונות אלו בניסויים קליניים מבוקרים, ההמלצה המקובלת במצבי שחמת עם אנצפאלופתיה היא תזונה עשירה בחלבון ממקור צמחי וחלבי, תוך התחשבות בהעדפה וסבילות אישית לחלבון (30–40 ג' חלבון צמחי ליום הוא יעד בר השגה). סיבים בתזונה מומלצים כחלק מתפריט עשיר בחלבון מן הצומח, כאשר יש להתחשב במצבי שלשול בחולים הנוטלים לקטולוז[5].
אנצפלופתיה שכיחה יותר בקרב חולי שחמת הסובלים מתת תזונה. נמצא קשר הפוך בין רמות אמוניה בדם למסת השריר. על כן, אין להגביל חלבון באנצפלופתיה, אלא במצב של אנצפלופתיה חמורה ודימום גסטרואינטסטינלי, וגם אז, לזמן קצר. יש להימנע מצום ממושך, ומומלצת ארוחת בוקר וארוחת לילה כמפורט בסעיף לעיל[9].
פרוביוטיקה ופרה-ביוטיקה למטופלים עם אנצפאלופתיה
לקטולוז (אבילק) המוגדר כפרה-ביוטיקה, הוא טיפול מוכח באנצפאלופתיה כבדית[51]. לקטולוז הוא דו-סוכר סינתטי, אשר גורם לשלשול אוסמוטי, כמו כן, מפחית ספיגת אמוניה במעי (מפורק על ידי חיידקי המעי ליצירת סביבה חומצית בלומן, ההופכת אמוניה לאמוניום שספיגתו פחותה).
לפרוביוטיקה עשוי להיות תפקיד בטיפול באנצפאלופתיה, בכך שהיא משנה את אוכלוסיית המיקרוביוטיקה ומורידה את יצור וספיגת האמוניה במעי. ניסויים רבים הראו השפעה מטיבה של פרוביוטיקה, על מניעה וטיפול באנצפאלופתיה, אך ישנה שונות רבה בין הניסויים, בהגדרת התוצאים, בהרכב הדיאטה ובסוג ומינון הטיפול הפרוביוטי וברובם משך הטיפול קצר והמדגם קטן[51][52][53][54]. נכון למועד כתיבת נייר זה, עדיין לא ניתן להמליץ על פרוביוטיקה כטיפול באנצפלופתיה כבדית.
BCAA (חומצות אמינו מסועפות שרשרת)
ממחקרים מסתמן כי ל-BCAA (ואלין, לאוצין ואיזוליאוצין) יתרונות רבים ואף תפקיד פרמקולוגי במחלות כבד: השפעה על סינתזת אלבומין, הפחתת תנגודת לאינסולין, שיפור הפרוגנוזה ואיכות החיים וכן יתרון בטיפול באנצפאלופתיה. יתרונות אלו משוייכים בעיקר ללאוצין המעודדת יצירת חלבון בשריר והפרשת אינסולין וכן משפעלת סינתזה של HGF (Hepatocyte Growth Factor) שמעודד את התחדשות רקמת הכבד[5][55][56][57][58].
רמתן בסרום של BCAA, נמצאה נמוכה בחולי שחמת וקשורה להתקדמות מחלת הכבד. צריכת BCAA בתזונה או כתוסף עשויה לעלות צריכת חלבון ולשפר את מאזן החנקן ובכך לסייע במניעת תת-תזונה. מוצרי חלב וחלבון ממקור צמחי, עשירים יותר ב- BCAA מאשר חלבון ממקור בשרי ולכן מומלץ לעודד צריכתם. כמו כן, ניתן לשקול צריכת תוסף המכיל BCAA עבור חולי שחמת בלתי מפוצה עם סרקופניה, שאינם מגיעים לצריכת חלבון מספקת[9][57][58].
לפי מטה-אנליזה שבוצעה ב-2015, אשר סקרה 16 מחקרים קליניים רנדומליים, בהם בחנו מתן BCAA תוך ורידי או פומי בהשוואה לקבוצות ביקורת שקיבלו טיפול סטנדרטי באנצפלופתיה, נמצאה השפעה מטיבה של מתן תוסף BCAA פומי על אנצפלופתיה, אך ללא השפעה על מצב תזונתי, איכות חיים, או תמותה[56].
מיימת Ascites
מיימת היא מצב בו ישנה צבירת נוזל בחלל הפריטוניאום. נוזל זה מכיל חלבונים. חולי שחמת עם מיימת הם בסיכון גבוה יותר לסיבוכים של המחלה כולל פריטוניטיס (עקב SBP – Spontaneous Bacterial Peritonitis - זיהום בקטריאלי של נוזל המיימת), היפונתרמיה, או כשל כלייתי (HRS – Hepatic-Renal Syndrome). נוכחות מיימת רפרקטורית (הדורשת ניקורים תכופים), מגבירה את הסיכון לתת תזונה ומחמירה את הפרוגנוזה. מבחינה תזונתית, נוכחות מיימת גורמת לחוסר תיאבון ושובע מהיר בשל לחץ פיזי על הקיבה ומערכת העיכול[2].
מיימת ונתרן
מיימת היא מצב קטבולי ביותר, בו ישנה ירידה במאזן חלבון: ייצור מופחת וכן איבוד חלבון מזרם הדם. בנוסף ישנה ירידה בצריכת חלבון עקב שובע מוקדם וחוסר תיאבון. ניקורים חוזרים מחמירים את מאזן החלבון ומאידך, החזר אלבומין אינו משפיע על המצב הקטבולי, אלא רק שומר על לחץ הדם. יתר לחץ דם פורטאלי, לעומת לחץ נמוך יותר בכליות, יגרום לאגירת נתרן ולכן, לבריחת נוזל מזרם הדם לתוך הרקמות, לחלל הבטן, או לחלל בית החזה. כתוצאה מכך, רמות הנתרן תשארנה תקינות או אף נמוכות, כתוצאה מ"דילול"[59].
למרות ההמלצה הגורפת על מגבלה בנתרן, עדיין יש שאלה בנוגע לתועלת שבה, בעיקר בשל הירידה בצריכת המזון שבחלקה קשורה במגבלה זו. 5-10% מהמטופלים סובלים ממיימת רפרקטורית - מיימת שיש קושי בניקורה, וגם כאשר מנוקרת, מהר מאוד מתחדשת. מיימת זו לרוב אינה מגיבה למגבלה בנתרן, יש אף עבודות המצביעות על יתרון בהגברת צריכת הנתרן[60].
ניסוי רנדומלי ומבוקר, במטופלים עם מיימת, שהשווה בין דיאטה מוגבלת בנתרן לפחות מ-2000 מ"ג/יום (n=101), לעומת דיאטה לא מוגבלת בנתרן (2000–2600 מ"ג/יום) (n=97), ל-10 ימים, מצא כי הרמה הממוצעת של נתרן בסרום ירדה באופן משמעותי בקבוצה שהוגבלה בנתרן, מ-134.05±4.20 ל-128.74±2.28 ונצפתה ירידה בתפקוד הכלייתי, לעומת הקבוצה שלא הוגבלה בנתרן. צריכת הקלוריות הממוצעת 30 ימים לאחר הטיפול, נמצאה גדולה יותר באופן מובהק בקבוצת המשתתפים שלא הוגבלה בנתרן. יתרה מכך, שיעורי העלמות המיימת היו גבוהים משמעותית בקבוצה זו (45.36% לעומת 15.84% בקבוצה שהוגבלה בנתרן, p<0.001)[61].
בנוסף, הגבלת צריכת נתרן ל-2000 מ"ג ליום או פחות (ללא התערבות תזונתית נוספת) הייתה גורם עצמאי לניבוי תמותה בקרב חולי שחמת עם מיימת עקשנית (RR 3.91 (1.45–6.58) p<0.001)[7].
לפי ההנחיות העדכניות של החברה האירופאית לחקר הכבד (EASL), לטיפול במיימת יש להגביל צריכת נתרן ל–1840 - 2760 מ"ג ליום[1]. הטיפול במיימת אינו משפיע על שרידות, אך בעל משמעות לאיכות חיי המטופל. מומלץ להתאים את המגבלה בנתרן באופן אישי לכל מטופל לפי מצבו תזונתי, כמות הצריכה בפועל של נתרן ומצב צבירת הנוזלים. יש לעקוב אחר היענות, ולוודא שאין ירידה בצריכה אנרגטית וחלבונית[9].
דליות בוושט
דימום מדליות בוושט מלווה בשיעורי תחלואה ותמותה ניכרים. כשליש מחולי השחמת הכבד ידממו מדליות במהלך מחלתם וכ-40% ימותו במהלך הדימום הראשון. רוב החולים הנותרים בחיים מדממים שוב בתוך פחות משנה. דליות יכולות להופיע לכל אורך מערכת העיכול, אך כמעט תמיד הדימום נובע מהדליות בוושט התחתון. דימום מדליות בוושט מופיע כאשר הלחץ בוורידים הפורטלים עולה במידה ניכרת. ישנן 3 גישות טיפול במצב זה: תרופתית, להפחתת הלחץ בוורידים הפורטלים; אנדוסקופית לקשירה של הדליות; וכירורגית, לתיקון דלף מדליות[62].
הגישה התזונתית במצב של דליות בוושט היא להתאים את מרקם המזון להפחתת סיכון לדימום. מומלץ להעדיף צריכה של מרקמי מזון רכים ונוזליים ולעודד לעיסה טובה של המזון. במצבים של אשפוז על רקע דימום מדליות בוושט, מומלץ להשהות הזנה אנטרלית ל-48–72 שעות לאחר הדימום האקוטי, מאחר שהזנה אנטרלית מגבירה את זרימת הדם לטחול ועלולה להעלות את לחץ הדם הפורטלי ולהגביר את הסיכון לדימום חוזר מהדליות[9]. דליות בוושט שאינן מדממות, לא מהוות קונטרה אינדיקציה להזנה אנטרלית בזונדה. שימוש ב-PEG לעומת זאת הביא לעלייה בסיבוכים, בעיקר דימומים ולכן אינו מומלץ בחולי שחמת[63].
ויטמינים מינרלים
למטופלים עם שחמת שכיחות גבוהה לחסרים של מיקרונוטריאנטים הנובעת מצריכת מזון ירודה ופגיעה באיכות הספיגה. הגישה היא לרוב שמרנית ותיסוף יינתן במינונים נמוכים יחסית, כפי שמפורט להלן, בהתבסס על המלצות ה-EASL[9].
ויטמינים מסיסי שומן:
ספיגה של ויטמינים אלה מושפעת מריכוזם של מלחי המרה בחלל הלומן במעי ולכן נפגעת במחלת כבד כולסטטית. מחסור בוויטמינים אלה נפוץ בחולי כבד. במחקר רטרוספקטיבי נמצא כי מרבית המטופלים המועמדים להשתלת כבד מגיעים עם מחסור בוויטמין A ו-D.
וויטמין A – מחסור בוויטמין A יכול לפגוע בבריאות העור ולעודד עיוורון לילה. יש צורך לנטר את רמות הוויטמין ולתסף רק במקרים של מחסור. בשל חלון תרפויטי קצר, יש לבצע תיסוף זהיר של כ-10,000 עד 20,000 יחב"ל, עם ניטור של הרמות בדם כל 8 עד 12 שבועות.
וויטמין E – מתן ויטמין E, במינון של 800 IU, הביא לשיפור היסטולוגי בקרב מטופלים עם NASH ללא שחמת, שאינם סוכרתיים, בניסוי מבוקר שארך שנתיים (42% לעומת 19%). אין מידע לגבי הצורך והבטיחות של מתן תוסף ויטמין E בחולי שחמת.
ויטמין K - מאריך את פעולתו של הפרוטרומבין ומחסור בו יכול להגביר את הסיכון לדימומים. כמו כן, לוויטמין K תפקיד חשוב בשמירה על בריאות העצם וידוע כי מחלת עצם מטאבולית שכיחה בחולי שחמת. מחסור בוויטמין נפוץ בעיקר בקרב מטופלים עם צהבת או עם מחלה כולסטטית. תיסוף ניתן לרוב IV.
וויטמין D – מחסור בוויטמין D נפוץ באוכלוסייה הכללית, ונפוץ אף יותר בקרב מטופלי שחמת ומגיע לשיעור של כ-64 עד 92%. רמותיו הנמוכות בסרום מושפעות מהמחסור התזונתי, אך יש לקחת בחשבון כי הבדיקה מסתמכת על ריכוז Plasma binding proteins ולכן רמות נמוכות של אלבומין וגלובולין, הנפוצות אף הן בחולים אלה, עשויות לשקף מחסור גדול מהקיים. נמצא כי מחסור חמור בוויטמין D במחלת כבד אלכוהולית נמצא קשור בעלייה בפגיעה הכבדית ועלייה בתמותה, ואף הוצע כפרמטר לניבוי דרגת החומרה של מחלת הכבד. מחסור בוויטמין D עשוי אף לפגוע בתגובה לטיפול בתרופות מבוססות אינטפרונים הניתנות לטיפול בהפטיטיס C. בשל התפקיד האימוני שלו, ויטמין D מסייע במניעה של SBP. מחסור בוויטמין מעודד אוסטאופניה ואוסטאופורוזיס. מחסור בוויטמין D מוגדר < 20 ננוגרם/מ"ל. מומלץ לתסף עד להשגת יעד של מעל 30 ננוגרם/מ"ל.
ויטמינים מקבוצת B - מחסור בקבוצת ויטמינים אלה, ובעיקר בתיאמין (B1), קיים אך פחות שכיח. מחסור עשוי להביא לסיבוכים רבים מאנצפלופתיה ע"ש WERNICKE'S ועד לאנמיה ונוירופתיה. מחסורים ב-B12, B6 ופולת יכולים להתפתח במהירות לאור פגיעה ביכולת של הכבד לאגור אותם בתוכו. מאחר שיש קושי להעריך את סטטוס הוויטמינים ומשום שתוסף מולטי ויטמין הוא זול ובטוח, ייתכן שיש מקום להמליץ על תוסף זה במחלת כבד בלתי מפוצה לתקופת זמן מסוימת בה התזונה של המטופל אינה מלאה.
אבץ - מחסור באבץ נפוץ במטופלים עם מחלת כבד כרונית ונמצא קשור בעמידות לאינסולין, סטאטוזיס, הצטברות ברזל ואנצלופתיה כבדית. יש לבדוק את רמות האבץ בסרום ולתסף במקרים של רמות נמוכות[64].
סלניום - מחסור במינרל סלניום נפוץ בעיקר בשחמת מתקדמת, ויש לשקול לתסף ברמות נמוכות. אין מספיק עדויות התומכות בהנחיה גורפת לתיסוף.
הימנעות מהגבלות מזון מיותרות
למטופלים עם שחמת אתגרים תזונתיים רבים. בנוסף לכך, לחולי שחמת צרכים תזונתיים משתנים עם התקדמות המחלה על סיבוכיה, שמעלים צורך במעקב תזונתי סדיר והתאמת ההנחיות למצב החולה בכל שלב. הדרכה תזונתית הכוללת הנחיות שבחלקן סותרות עלולה להתרחש עקב ריבוי תחלואות רקע, כמו סוכרת, מחלות כליה ו-IBD. מצב זה עשוי להוות אתגר נוסף ואף להגביר את הסיכון התזונתי. יש להימנע מהגבלות מיותרות העלולות לפגוע בצריכה התזונתית ולהחמיר מצבים של תת-תזונה. דיאטות דלות מאוד בקלוריות אינן מומלצות למטופלים שחמתיים עם השמנה, כמו כן, דיאטות הכוללות שעות מרובות של צום עלולות לדלדל מאגרי שריר, לפגוע במאזן הסוכר ולהחמיר סרקופניה. יש להימנע מהגבלה של חלבון העלולה לפגוע בסטטוס התזונתי גם במצבים של אנצפאלופתיה ותסמונת הפטו-רנאלית[9]. יש לשוחח עם המטופלים על דיסאינפורמציה רבה שקיימת ברשת, הסכנות הטמונות בה והחשיבות של קבלת ייעוץ מדיאטנית קלינית מוסמכת בלבד, רצוי עם התמחות / ניסיון בתחום של מחלות כבד.
סיכום הטיפול התזונתי בשחמת
התזונה היא מרכיב חיוני בטיפול בחולה שחמת. חשוב לאתר כל מטופל עם שחמת לסיכון לתת תזונה ולהתאים תוכנית טיפולית אישית. מטרת הטיפול התזונתי בשחמת היא לספק תמיכה תזונתית, למניעה וטיפול בתת-תזונה תוך התחשבות במצבים הנלווים של השחמת כמו זיהומים, מיימת ואנצפלופתיה. מטרה נוספת היא שיפור באיכות החיים ומניעת החמרת הסימפטומים השליליים.
ההערכה והטיפול התזונתי מחייבים התייחסות לנושאים הבאים: הערכה פיזיקלית של המטופל (משקל יבש, דלדול שרירים, כוח שריר, מאגרי שומן, מיימת, בצקת), שינוי משקל והיסטורית משקל, בדיקות מעבדה רלוונטיות, תסמינים קליניים (עייפות, חולשה, חוסר תיאבון, שינויים בטעם, תחושת מלאות), בעיות גסטרו-אינטסטינליות (בחילה, הקאות, שלשולים, עצירות, דליות ושט/קיבה ודמם GI), נוכחות סיבוכים (אנצפלופתיה, מיימת, בצקות או דימום במערכת העיכול) ונוכחות מחלות אחרות כמו סוכרת.
לקיחת אנמנזה תזונתית מפורטת חשובה ביותר להערכת צריכת קלוריות, חלבון ונתרן, להבנת דפוס האכילה היומי, להבנת מגבלות אכילה אם קיימות וכן להערכת מצבו התפקודי ואיכות חיי המטופל. בנוסף, חשוב לוודא אם למטופל יש פעולת מעיים יומית (עצירות היא גורם סיכון לאנצפלופתיה) ושנוטל לקטולוז/אבילק אם נרשם לו על ידי הרופא.
התזונה המומלצת במצב של שחמת, לרבות שחמת עם אנצפלופתיה היא עשירה באנרגיה ובחלבון כתלות בסטטוס תזונתי ו-BMI. לעיתים תידרש התייחסות לסוג החלבון עם העדפת חלבון צמחי וחלבי על פני חלבון בשרי וזאת בהתאמה אישית בהתחשב בנוכחות או העדר אנצפלופתיה וסבילות אישית לחלבון. ישנה חשיבות רבה לחלוקת ארוחות נכונה עם אכילה תכופה, כל 3–6 שעות, במהלך היום, עם דגש על ארוחת בוקר וארוחת לילה מאוחרת. שימוש במזון ייעודי יכול לשמש כתחליף לארוחה או כארוחת ביניים. הגבלת נתרן תעשה במקרים של צבירת נוזלים, אך לא על חשבון ירידה בכמות האכילה. עיקרי ההמלצות התזונתיות למטופל מופיעות בנספח 4.
פעילות גופנית
רמת הפעילות הגופנית בקרב חולי שחמת היא נמוכה מאוד ובקרב מאושפזים היא זניחה. הגורמים המשפיעים על היכולת לבצע פעילות גופנית כוללים: מצבי מיימת חמורה, בצקות ברגליים ואנצפלופתיה, כמו גם, היענות וסיבולת נמוכות. ישנה חשיבות רבה להתאמה אישית של עצימות הפעילות וצורך באישור רפואי בנוכחות מחלות קרדיווסקולריות, סוכרת ומחלות כליה. באופן עקרוני, יש להימנע מפעילות עם סיכון מוגבר לפציעה או נפילה, בייחוד במצבים בהן רמת הטסיות מתחת ל-20,000[65].
מחקרי התערבות מבוקרים ואקראיים מהשנים האחרונות, שכללו כל אחד כ־10-20 חולי שחמת בכל זרוע התערבות (פעילות גופנית מודרכת מול טיפול שגרתי) ונמשכו 8–12 שבועות, הראו כי פעילות גופנית מתונה משפרת מסת שריר, איכות חיים, חולשה וירידה בלחץ דם פורטלי[65][66].
מחקר אקראי עדכני, שכלל 18 מטופלים עם שחמת, הראה כי פעילות גופנית מותאמת אישית (על ידי פיזיותרפיסט) המשלבת אימוני אירובי והתנגדות, למשך 12 שבועות, שפרה מדדים של יכולת גופנית בכל סוגי הפעילות ושיפור איכות חיים. ייחוד המחקר היה בכך שנערך במסגרת ביתית[67].
המלצות לתוכנית פעילות גופנית לחולי שחמת מופיעות בטבלה 2 להלן. התדירות המומלצת לביצוע פעילות היא לפחות 4 פעמים בשבוע. העצימות המומלצת היא מתונה, אם עדיין מאפשרת לדבר במהלך הפעילות[65].
טבלה 2: המלצות תוכנית פעילות גופנית לחולי שחמת לפי מודל FITT (Frequency, Intensity, Type, Time)[65]
| מאפיין | פעילות אירובית | פעילות התנגדות | גמישות ואיזון |
|---|---|---|---|
| תדירות | לפחות 4 ימים בשבוע | יומיים ומעלה | יומיים ומעלה |
| עצימות | 5-6 מתוך 10 בסולם Borg, כלומר, עצימה אם עדיין מאפשרת לדבר במהלך הפעילות | עבודה עם רצועה, או משקולות על קבוצות שרירים שונות. כאשר הפעילות הופכת קלה, להעלות את המשקל או את התנגדות הרצועה. | מתיחה עד לתחושה קלה של אי נוחות |
| משך | להתחיל לסירוגין דקה הליכה, דקה מנוחה, לעלות בהדרגה את זמן הפעילות ולהוריד את זמן המנוחה. המטרה להגיע ל-40 דק' פעילות רצופה, לפחות 150 דק בשבוע. | לעלות בהדרגה ל-7 תרגילים ביום על קבוצות שריר שונות, בכל תרגיל 3 חזרות של 10–15, עם הפסקה ביניהן. | 3 חזרות, כל אחת למשך 30–60 שניות |
| סוג | הליכה, רכיבה וכו'. | אימוני משקולות, אימונים פונקציונליים, כמו טיפוס מדרגות | תרגילי מתיחות ושיווי משקל |
הנחיות תזונתיות למטופלים לאחר השתלת כבד
תת תזונה נפוצה בקרב חולים הסובלים מכשל כבדי ומתוארת בקרב כ-50-90% מחולי שחמת הכבד. חומרת תת-התזונה נמצאת בקורלציה ישירה עם חומרת הכשל הכבדי, סיבוכים הקשורים במחלה הכבדית, שיעורי השרידות ותוצאות הטיפול לאחר השתלה[68][64][69]. תת-משקל ועודף משקל מקושרים עם עליה בשיעורי התחלואה והתמותה אחרי ההשתלה[9][70], ישנן עדויות לכך שגם סרקופניה ושבריריות מגדילות את הסיכון לתחלואה ותמותה בתקופת ההמתנה להשתלה ולאחריה[71].
הערכה תזונתית היא שלב חיוני בטיפול התזונתי בחולי הכבד ובהכנה לקראת השתלה. המטרות העיקריות של ההכנה התזונתית להשתלה הן למנוע המשך הידרדרות תזונתית, דלדול מסת שריר ולתקן חסרים של מיקרונוטראנטים[72]. התערבות תזונתית מוקדמת מומלצת מספר חודשים לפני ההשתלה על מנת לשפר עד כמה שניתן את מסת השריר ו- BCM (Body Cell Mass). כיוון שמועד השתלה מתורם נפטר אינו ידוע, טיפול תזונתי אינטנסיבי יותר ולעיתים הזנה אנטראלית נדרשים למטופלים בעלי MELD גבוה הסובלים מתת תזונה[73][74].
ישנן עבודות אשר הדגימו את השפעתה של תוספת פרוביוטיקה או סינביוטיקה לקראת ההשתלה על הפחתת שיעור הסיבוכים הזיהומיים. טיפול זה עדיין שנוי במחלוקת בהיעדר מספיק מידע אודות משך הטיפול, אופן מתן ושונות בהרכבי התכשירים[75][76]. במצבים של השתלה מן חי נדרשת התערבות תזונתית מותאמת אשר לרוב תחל מספר חודשים לפני מועד ההשתלה המתוכנן[72].
תמיכה תזונתית אחרי השתלת כבד
השתלת כבד כרוכה באיבוד משמעותי של מסת שריר והתפתחות סרקופניה אשר מתווסף לדלדול מסת השריר שמאפיין את המועמדים להשתלת כבד[77][78]. תהליך שיקום מסת השריר לאחר ההשתלה הוא מורכב ויכול להמשך שנתיים ויותר[78]. לאחר ההשתלה ישנם גורמים רבים המובילים לצבירה משמעותית של עודף משקל והשמנה, בהם: שיפור התיאבון, הרגשה כללית טובה יותר, הסרת מגבלות תזונתיות ונרמול הסטטוס המטבולי. מטופלים אשר סבלו מעודף משקל או השמנה לפני ההשתלה לרוב יסבלו מכך גם בהמשך. בנוסף, כשליש מהמטופלים שהיו במשקל תקין לפני ההשתלה יסבלו מהשמנה אחריה[79]. עודף משקל והשמנה אחרי ההשתלה גורמים להתפתחות תסמיני הסינדרום המטבולי אשר מאפייניו הקליניים תורמים להתפתחות תחלואה נלווית הכוללת מחלות לב וכלי דם, מחלות כליה ועוד[80][81]. התרופות נוגדות הדחיה והסטרואידים תורמים גם הם להתפתחות או החמרת סוכרת, יתר לחץ דם, דיסליפדמיות ועוד.
אחרי ההשתלה יש חשיבות לטיפול תזונתי ממושך, מטרות הטיפול משתנות בין התקופה ההיפרמטבולית קצרת הטווח שאחרי ההשתלה וההמשך.
בתקופה ההיפרמטבולית אשר מוערכת בכ-4–6 שבועות, מטרת הטיפול התזונתי היא אספקה נאותה של אנרגיה וחלבון ומניעת פירוק של חלבון עד כמה שניתן, הצרכים האנרגטיים מוגברים ומוערכים בכ-30–35 קק"ל/ק"ג וכ-1.2-1.5 גרם חלבון/ק"ג. למטופלים הסובלים מהשמנה הצרכים האנרגטיים מוערכים בכ-25 קק"ל/ק"ג ו-2-2.5 גר׳/ק"ג של חלבון[82]. תחילת הזנה אנטראלית מוקדמת מומלצת כ-12 שעות אחרי הניתוח, נזוגסטרית או נזוג׳אוג׳ונלית, מקושרת עם שיעור נמוך יותר של זיהומים ויראליים ומאזני חנקן בהשוואה למטופלים אשר לא הוזנו בשלב זה[71][83]. תחילת ההזנה מומלצת באופן הדרגתי תוך הערכת הסיכון לרפידינג סנדרום[7]. רצוי לשקול תוספת של סוגים ספציפיים של פרוביוטיקה (עשירה ב- Lactobacillus ו- Bifidobacterium) להזנה האנטראלית בשל הפוטנציאל להפחתת שיעור הזיהומים[82][84]. אחרי ההשתלה, במהלך האשפוז ביחידה לטיפול נמרץ, במצבים בהם לא ניתן להזין אנטראלית ו/או פומית יש לשקול תחילת הזנה פרנטראלית[71]. בהמשך, תחילת הזנה פומית בהתאם ליכולתו של המטופל תוך ניתור רמות גלוקוז ואלקטרוליטים, דגש מיוחד להיפומגנזמיה משנית לטיפול בציקלוספורין או Tacrolimus ולהיפרקלמיה אשר מקושרת גם היא עם הטיפול ב Tacrolimus.
עם תום השלב ההיפרמטובלי הטיפול התזונתי ימוקד בשיקום תזונתי ובהמשך שמירה על מצב תזונתי תקין תוך כדי הכוונה לאורח חיים בריא הכולל פעילות גופנית והתמודדות עם תופעות הלוואי של התרופות, עליית משקל היא אחד מהתסמינים הנפוצים ביותר. דגש מיוחד יינתן למניעת איבוד מסת עצם אשר מתרחשת בעיקר 3–6 חודשים אחרי השתלה ומקושרת עם הטיפול הסטרואידי, תת-תזונה, דלדול מסת שריר, ירידה בתנועתיות ואוסטאופניה/אוסטאופורזיס טרום השתלה[72][85].
הטיפול התרופתי השגרתי לאחר ההשתלה מורכב לרוב מתרופות למניעת דחיית השתל וכן מתרופות למניעת זיהומים. לקיחת התרופות היא על בסיס קבוע במינונים משתנים (לרוב פוחתים).
טבלה 3: השלכות תזונתיות של הטיפול התרופתי למניעת דחיית שתל במושתלי כבד
| פעילות | שם התרופה | תופעות לוואי בעלות השלכות תזונתיות |
|---|---|---|
| קורטיקו-סטרואידים | פרדניזון | Mucositis, שינויי טעם, תיאבון מוגבר והשמנה, במינונים גבוהים protein wasting, היפרגליקמיה, היפרליפידמיה, פנקריאטיטיס, בצקות, כיבים, אוסטיאופורוזיס, יתר לחץ דם, אצירת נתרן, ירידה בספיגת סידן וזרחן |
| מעכבי קלצינורין | Cyclosporine | היפרליפידמיה, סוכרת, עודף משקל, בחילות, הקאות, הפרעות אלקטרוליטריות (בעיקר היפומגנזמיה, היפרקלמיה), יתר לחץ דם, אצירת נתרן, פנקראטיטיס |
| Tacrolimus (פרוגראף, FK506, Tacrocell) | היפרקלמיה, סוכרת, בחילות, הקאות, אנורקסיה, היפרכולסטרולמיה, יתר לחץ דם | |
| מעכבי mTOR | Sirolimus (רפמיון) Everolimus(סרטיקן) | הפרעות בשומני הדם, היפרגליקמיה, גסטרואינטסטינליות (עצירויות, שלשולים, כאבי בטן, בחילות, הקאות), כאבים כלליים, אקנה |
| עיכוב ייצור לימפוציטים מסוג T ו-B | סלספט (Mycophenolate) | כאבי בטן ושלשולים, בחילות, הקאות |
| עיכוב פורינים | אימוראן (Azathioprine) – ניתנת עם פרוגרף, פרדניזון או ציקלוספורין | בחילות והקאות, פריחה |
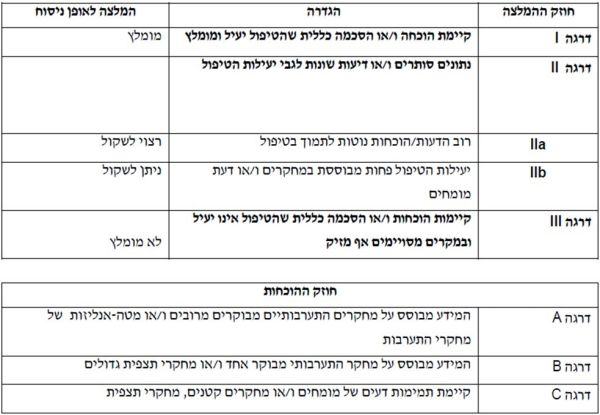
המלצות הוועדה לטיפול תזונתי בשחמת הכבד
| המלצות הוועדה | חוזק ההמלצה | רמת ההוכחה |
|---|---|---|
| למטופלים עם שחמת, לרבות שחמת עם אנצפאלופתיה, מומלצת תזונה עשירה באנרגיה ובחלבון (25–40 קק"ל ו- 1.2-1.5 ג' חלבון לק"ג, לפי משקל גוף יבש, או אידיאלי עבור מטופלים עם השמנה), כתלות בסטטוס תזונתי | I | A |
| מומלץ להגביל צריכת נתרן ל־2000 - 2500 מ"ג ליום בשחמת עם מיימת | I | B |
| מומלץ לאכול ארוחות תכופות ולהקפיד על ארוחת בוקר וארוחת לילה | I | A |
| ניתן לשקול ירידה מתונה במשקל בשחמת עם השמנה, אך יש להקפיד על צריכת חלבון נאותה ושמירת סטטוס תזונתי תקין | IIb | B |
| במצבי אנצפאלופתיה חוזרים רצוי לשקול צריכת חלבון ממקור צמחי, מוצרי חלב ודגים, תוך התחשבות בהעדפה וסבילות אישית | IIa | C |
| ניתן לשקול צריכת תוסף המכיל BCAA עבור חולי שחמת בלתי מפוצה עם סרקופניה, שאינם מגיעים לצריכת חלבון מספקת | IIb | A |
| מומלץ לנטר ולתקן חוסרים בוויטמינים ומינרלים | I | B |
| רצוי לשקול מתן תוסף מולטיויטמין בשחמת בלתי מפוצה | IIa | B |
| מומלץ לשלב תוכנית פעילות גופנית בהתאמה אישית | I | A |
נספח 1 - The Royal Free Hospital Nutritional Prioritizing Tool (RFH-NPT)
נספח 2 - שאלון ה- Subjective Global Assessment (SGA)
נספח 3 - Royal free hospital gobal assessment scheme (RFH-GA Scheme)
נספח 4 - עיקרי ההמלצות התזונתיות למטופל
- לרוב, לכל המטופלים מומלצת תזונה בריאה הכוללת מגוון מזונות
- אכילה מספקת של קלוריות וחלבון חשובה בהרבה יותר מאשר הימנעות מסוגים מסוימים של מזונות
- פריט המזון היחיד שיש להימנע ממנו באופן מובהק הוא אלכוהול
- כדאי לחלק את התזונה היומית ל-3 ארוחות עיקריות ו-3 ארוחות ביניים. ארוחת לילה מאוחרת המכילה פחמימה וחלבון היא חשובה ביותר כדי למנוע נזקים של צום הלילה
- ישנה חשיבות להכללת חלבון בכל ארוחה עיקרית לפחות 3 פעמים ביום. דוגמאות למקורות חלבון: ביצים, מוצרי חלב, קטניות, בשרים (עוף, הודו, דג, בקר במתינות)
- בכל מקרה של קושי עם צריכת חלבון ממקור של בשר, עוף ודג, מומלץ להעדיף חלבון ממקור של קטניות, מוצרי חלב וביצים
- אכילת פירות וירקות מומלצת בהתאמה אישית
- בנוכחות מיימת, מומלץ להפחית בצריכת המלח. עם סבילות והתמדה ניתן להתרגל לתזונה דלה במלח. ניתן להשתמש בעשבי תיבול ובתיבולים טבעיים, כמו שום ומיץ לימון ומאידך, לצמצם שימוש במלח, אבקות מרק, מזון מעובד ומזונות עתירי נתרן
- בנוכחות דליות בוושט, כדאי להעדיף צריכה של מרקמי מזון רכים ונוזליים, ולעודד לעיסה טובה של המזון. בסמיכות לפעולה של קשירת דליות, מומלץ להימנע מצריכת מזונות חמים או קרים מידי
ביבליוגרפיה
- ↑ 1.0 1.1 European Association for the Study of the Liver. EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis. J Hepatol. 2018; 69(2):406-460.
- ↑ 2.0 2.1 2.2 Sleisenger and Fordtran's GASTROINTESTINAL and LIVER DISEASE 10th edition.
- ↑ 3.0 3.1 3.2 Maharshi S, Sharma BC, Srivastava S. Malnutrition in cirrhosis increases morbidity and mortality. J Gastroenterol Hepatol. 2015; 30(10):1507-13.
- ↑ Bernardi M, Gitto S, Biselli M. The MELD score in patients awaiting liver transplant: strengths and weaknesses. J Hepatol. 2011 Jun;54(6):1297-306.
- ↑ 5.0 5.1 5.2 5.3 Amodio P1, Bemeur C, Butterworth R, et-al. The nutritional management of hepatic encephalopathy in patients with cirrhosis: International Society for Hepatic Encephalopathy and Nitrogen Metabolism Consensus. Hepatology 2013; 58(1):325-36.
- ↑ 6.0 6.1 Merli M, Iebba V, Giusto M. What is new about diet in hepatic encephalopathy. Metab Brain Dis. 2015.
- ↑ 7.0 7.1 7.2 7.3 Sorrentino P, Castaldo G, Tarantino L,et-al. Preservation of nutritional-status in patients with refractory ascites due to hepatic cirrhosis who are undergoing repeated paracentesis. J Gastroenterol Hepatol 2012; 27:813–22.
- ↑ 8.0 8.1 Plank LD1, Gane EJ, Peng S, et-al. Nocturnal nutritional supplementation improves total body protein status of patients with liver cirrhosis: a randomized 12-month trial. Hepatology 2008; 48(2):557-66.
- ↑ 9.00 9.01 9.02 9.03 9.04 9.05 9.06 9.07 9.08 9.09 9.10 9.11 9.12 9.13 9.14 9.15 9.16 9.17 9.18 EASL Clinical Practice Guidelines on nutrition in chronic liver disease. J Hepatol (2018), https://doi.org/10.1016/j.jhep.2018.06.024.
- ↑ The development and validation of a nutritional prioritising tool for use in patients with chronic liver disease J Hepatol 2012; 56(Suppl 2): S241.
- ↑ Borhofen, S.M., Gerner, C., Lehmann, J. et al. The Royal Free Hospital-Nutritional Prioritizing Tool Is an Independent Predictor of Deterioration of Liver Function and Survival in Cirrhosis. Dig Dis Sci.2016; 61, 1735–1743.
- ↑ Detsky AS, McLaughlin JR, Baker JP, Johnston N, Whittaker S, Mendelson RA, Jeejeebhoy KN. What is subjective global assessment of nutritional status? 1987. Classical article. Nutr Hosp. 2008; 23(4):400-7.
- ↑ Bakshi N, Singh K. Nutrition assessment and its effect on various clinical variables among patients undergoing liver transplant. Hepatobiliary Surg Nutr 2016;5:358–371.
- ↑ Ciocîrlan M, Cazan AR, Barbu M, Mănuc M, Diculescu M, Ciocîrlan M. Subjective Global Assessment and Handgrip Strength as Predictive Factors in Patients with Liver Cirrhosis. Gastroenterol Res Pract. 2017;2017:8348390.
- ↑ Ferreira LG, Anastacio LR, Lima AS, Correia MI. Assessment of nutritional status of patients waiting for liver transplantation. Clin Transplant 2011; 25:248–254.
- ↑ Morgan MY, Madden AM, Soulsby CT, Morris RW. Derivation and validation of a new global method for assessing nutritional status in patients with cirrhosis. Hepatology 2006; 44:823–835.
- ↑ Dasarathy S, Merli M. Sarcopenia from mechanism to diagnosis and treatment in liver disease. J. Hepatology 2016; 65:1232-1244.
- ↑ Tsien C, Garber A, Narayanan A, et-al. Post-liver transplantation sarcopenia in cirrhosis: a prospective evaluation. J Gastroenterol Hepatol. 2014; 29(6):1250-7.
- ↑ Nardelli S, Lattanzi B, Torrisi S, et-al. Sarcopenia is risk factor for development of hepatic encephalopathy after transjugular intrahepatic portosystemic shunt placement. Clin Gastroenterol Hepatol. 2016; S1542-3565(16)30999-5.
- ↑ Koo BK, Kim D, Joo SK, et-al. Sarcopenia is an independent risk factor for non-alcoholic steatohepatitis and significant fibrosis. J Hepatol 2017; 66(1):123-131.
- ↑ Carey EJ, Lai JC, Wang CW, et al. A multi-center study to define sarcopenia in patients with end-stage liver disease:From the Fitness, Life Enhancement and exersice in Liver Transplantation (FLEXIT) consortium. Hepatology 2016; 64(1) (Suppl).
- ↑ 22.0 22.1 Ida S, Kojima Y, Hamaoka S, et al. Validity of Japanese version of SARC-F questionnaire in patients with chronic liver disease. J Gastroenterol Hepatol. 2019;34(5):947-953.
- ↑ Malmstrom TK, Morley JE. SARC-F: a simple questionnaire to rapidly diagnose sarcopenia. J Am Med Dir Assoc. 2013;14(8):531-532.
- ↑ Hiraoka A, Nagamatsu K, Izumoto H, et al. SARC-F combined with a simple tool for assessment of muscle abnormalities in outpatients with chronic liver disease. Hepatol Res. 2020;50(4):502-511.
- ↑ Ida S, Kaneko R, Murata K. SARC-F for Screening of Sarcopenia Among Older Adults: A Meta-analysis of Screening Test Accuracy. J Am Med Dir Assoc. 2018;19(8):685-689.
- ↑ Alvares-da-Silva MR, Reverbel da Silviera T. Comparison between handgrip strength, subjective global assessment and prognostic nutritional index in assessing malnutrition and predicting clinical outcome in cirrhotic outpatients. Nutrition 2005; 21(2):113-7.
- ↑ Tapper EB, Derstine B, Baki J, Su GL. Bedside Measures of Frailty and Cognitive Function Correlate with Sarcopenia in Patients with Cirrhosis. Dig Dis Sci. 2019; 64(12):3652-3659.
- ↑ Belarmino G, Gonzalez MC, Torrinhas RS, Sala P, Andraus W, D'Albuquerque LA, Pereira RM, Caparbo VF, Ravacci GR, Damiani L, Heymsfield SB, Waitzberg DL. Phase angle obtained by bioelectrical impedance analysis independently predicts mortality in patients with cirrhosis. World J Hepatol. 2017 8;9(7):401-408.
- ↑ Fried LP, Tangen CM, Walston J, Newman AB, Hirsch C, Gottdiener J, et al. Frailty in older adults: evidence for a phenotype. J Gerontol A Biol Sci Med Sci 2001; 56:M146–M156.
- ↑ 30.0 30.1 Lai JC, Feng S, Terrault NA, Lizaola B, Hayssen H, Covinsky K. Frailty predicts waitlist mortality in liver transplant candidates. Am J Transplant. 2014;14(8):1870-9.
- ↑ 31.0 31.1 Tapper EB, Konerman M, Murphy S, Sonnenday CJ. Hepatic encephalopathy impacts the predictive value of the Fried Frailty Index. Am J Transplant. 2018; 18(10):2566-2570.
- ↑ Essam Behiry M, Mogawer S, Yamany A, Rakha M, Awad R, Emad N, Abdelfatah Y. Ability of the Short Physical Performance Battery Frailty Index to Predict Mortality and Hospital Readmission in Patients with Liver Cirrhosis. Int J Hepatol. 2019; 2019:8092865.
- ↑ Wang CW, Feng S, Covinsky KE, Hayssen H, Zhou LQ, Yeh BM, Lai JC. A Comparison of Muscle Function, Mass, and Quality in Liver Transplant Candidates: Results From the Functional Assessment in Liver Transplantation Study. Transplantation. 2016; 100(8):1692-8.
- ↑ 34.0 34.1 34.2 Schiavo L et al. Nutritional issues in patients with obesity and cirrhosis. World J Hepatol. 2018; 24(30):3330-46.
- ↑ Berzigotti A, Garcia-Tsao G, Bosch J, et al. Obesity is an independent risk factor for clinical decompensation in patients with cirrhosis. Hepatology 2011; 54(2):555-61.
- ↑ Kumar N et al. Treating morbid obesity in cirrhosis: a quest of holy grail. World J Hepatol.2015; 7(28):2819-28.
- ↑ Hazlehurst JM, Woods C, Marjot T, et-al. Non-alcoholic fatty liver disease and diabetes. Metabolism. 2016 ;65(8):1096-108.
- ↑ Streba LA, Vere CC, Rogoveanu I, et-al. Nonalcoholic fatty liver disease, metabolic risk factors, and hepatocellular carcinoma: an open question. World J Gastroenterol. 2015; 21(14):4103-10.
- ↑ Montano-Loza AJ, Angulo P, Meza-Junco J, et-al. Sarcopenic obesity and myosteatosis are associated with higher mortality in patients with cirrhosis. J Cachexia Sarcopenia Muscle. 2016; 7(2):126-35.
- ↑ Hara N et al. Sarcopenia and sarcopenic obesity are prognostic factors for overall survival in patients with cirrhosis. Inter Med.2016; 55: 863-70.
- ↑ Reuter B, Shaw J, Hanson J, Tate V, Acharya C, Bajaj JS. Nutritional assessment in inpatients with cirrhosis can be improved after training and is associated with lower readmissions. Liver Transpl 2019; 25:1790-1799.
- ↑ Kuftinec G, Ram Bhamidimarri K, Pearlman M. Malnutrition in Cirrhosis: Frequent but Overlooked. Liver Transpl. 2019; 25(12):1743-1744.
- ↑ Ney M, Abraldes JG, Ma M, et-al. Insufficient protein intake is associated with increased mortality in 630 Patients with cirrhosis awaiting liver transplantation. Nutr Clin Pract 2015; 30(4):530–6.
- ↑ Chalasani N, Younossi Z, Lavine JE, et al. The diagnosis and management of non-alcoholic fatty liver disease: practice Guideline by the American Association for the Study of Liver Diseases, American College of Gastroenterology, and the American Gastroenterological Association. Hepatology 2012; 55(6):2005-23.
- ↑ Vilar-Gomez E, Martinez-Perez Y, Calzadilla-Bertot L, et al. Weight Loss Through Lifestyle Modification Significantly Reduces Features of Nonalcoholic Steatohepatitis. Gastroenterology 2015; 149:367–378
- ↑ McClave SA, Kushner R, Van Way CW 3rd, Cave M, DeLegge M, Dibaise J, Dickerson R, Drover J, Frazier TH, Fujioka K, Gallagher D, Hurt RT, Kaplan L, Kiraly L, Martindale R, McClain C, Ochoa J. Nutrition therapy of the severely obese, critically ill patient: summation of conclusions and recommendations. JPEN J Parenter Enteral Nutr. 2011;35(5 Suppl):88S-96S.
- ↑ Tsien CD1, McCullough AJ, Dasarathy S. Late evening snack: exploiting a period of anabolic opportunity in cirrhosis. J Gastroenterol Hepatol 2012; 27(3):430-41.
- ↑ Koreeda C1, Seki T, Okazaki K, et-al. Effects of late evening snack including branched-chain amino acid on the function of hepatic parenchymal cells in patients with liver cirrhosis. Hepatol Res. 2011; 41(5):417-22.
- ↑ Chen CJ, Wang LC, Kuo HT, Fang YC, Lee HF. Significant effects of late evening snack on liver functions in patients with liver cirrhosis: A meta-analysis of randomized controlled trials. J Gastroenterol Hepatol. 2019; 34(7):1143-1152.
- ↑ Vaisman N, Katzman H, Carmiel-Haggai M, et-al. Breakfast improves cognitive function in cirrhotic patients with cognitive impairment. Am J Clin Nutr. 2010; 92(1):137-40.
- ↑ 51.0 51.1 Sharma BC, Singh J. Probiotics in management of hepatic encephalopathy. Metab Brain Dis. 2016; 1(6):1295-1301.
- ↑ McGee RG1, Bakens A, Wiley K, et-al. Probiotics for patients with hepatic encephalopathy. Cochrane Database Syst Rev 2011;
- ↑ Holte K1, Krag A, Gluud LL. Systematic review and meta-analysis of randomized trials on probiotics for hepatic encephalopathy. Hepatol Res 2012; 42(10):1008-15.
- ↑ Shukla S, Shukla A, Mehboob S, et-al. Meta-analysis: the effects of gut flora modulation using prebiotics, probiotics and synbiotics on minimal hepatic encephalopathy. Aliment Pharmacol Ther 2011; 33:662-71.
- ↑ Kawaguchi T, Izumi N, Charlton MR, et-al. Branched-chain amino acids as pharmacological nutrients in chronic liver disease. Hepatology 2011; 54(3):1063-70.
- ↑ 56.0 56.1 Gluud LL, Dam G, Les I, Córdoba J, et-al. Branched-chain amino acids for people with hepatic encephalopathy. Cochrane Database Syst Rev 2015.
- ↑ 57.0 57.1 Marchesini G1, Marzocchi R, Noia M, et-al. Branched-chain amino acid supplementation in patients with liver diseases. J Nutr 2005; 135(6 Suppl):1596S-601S.
- ↑ 58.0 58.1 Three targets of branched-chain amino acid supplementation in the treatment of liver disease. Nutrition 2010; 26:482-90.
- ↑ ד"ר מיכל כרמיאל-חגי. אוכל, שתייה... כבד, נקודות עניין לגבי תזונה לפני ואחרי השתלת כבד. בטאון העמותה למושתלי כבד בישראל 2010, גליון 13.
- ↑ Haberl J et al. To salt or not to salt- that is the question in cirrhosis. Liver Int. 2018; 38:1148-59.
- ↑ Gu XB, Yang XJ, Zhu HY, et-al. Effect of a diet with unrestricted sodium on ascites in patients with hepatic cirrhosis. Gut Liver 2012; 6:355-61.
- ↑ ד"ר צבי קויפמן, כירורגיה של הכבד
- ↑ Stirnimann J, Stirnimann G. Nutritional Challenges in Patients with Advanced Liver Cirrhosis. J Clin Med. 2019 Nov 9;8(11):1926.
- ↑ 64.0 64.1 Mouzaky M, Ng V, Kamath BN et al. Enteral energy and macronutrients in end stage liver disease. JPEN 2014;38: 673-81.
- ↑ 65.0 65.1 65.2 65.3 Tandon P, Ismond KP, Riess K, Duarte-Rojo A, Al-Judaibi B, Dunn MA, Holman J, Howes N, Haykowsky MJF, Josbeno DA, McNeely M. Exercise in cirrhosis: Translating evidence and experience to practice. J Hepatol. 2018; 69(5):1164-1177.
- ↑ Williams FR, Berzigotti A, Lord JM, Lai JC, Armstrong MJ. Review article: impact of exercise on physical frailty in patients with chronic liver disease. Aliment Pharmacol Ther. 2019; 50(9):988-1000.
- ↑ Williams FR, Vallance A, Faulkner T, Towey J, Durman S, Kyte D, Elsharkawy AM, Perera T, Holt A, Ferguson J, Lord JM, Armstrong MJ. Home-Based Exercise in Patients Awaiting Liver Transplantation: A Feasibility Study. Liver Transpl. 2019; 25(7):995-1006.
- ↑ Johnson T M, Overbard E B, Cohen AE et al Nutrition assessment in advanced liver disease. Nutrition in Clinical Practice 2012 ; 28(1):15-29.
- ↑ Alberino F, Gatta A, Amodio P et al. Nutrition and survival in patients with liver cirrhosis. Nutrition 2001;17: 445-50.
- ↑ Dick AA, Spitzer AL, Seifert CF. Liver transplantation at the extreme of the body mass index.Liver Transplantation 2009;15:968-77.
- ↑ 71.0 71.1 71.2 Bischoff SC, Bernal W,Dasarathy S. ESPEN practical guideline clinical nutrition in liver disease. Clin Nutr 2020;39:3533-62.
- ↑ 72.0 72.1 72.2 Hammad A, Kaido T,Aliyev Vet al. Nutritional therapy in liver transplantation. Nutrients 2017; 9:1116.
- ↑ Aqel, B.A.; Scolapio, J.S.; Dickson, R.C.; Bruton, D.D.; Bouras, E.P. Contribution of ascites to impaired gastric function and nutritional intake in patients with cirrhosis and ascites. Clin. Gastroenterol. Hepatol. 2005; 3:1095–1100.
- ↑ Kaido, T, Mori, A, Ogura, Y, Ogawa K, Hata K, Yoshizawa A, Yagi S, Uemoto S. Pre and perioperative factors affecting infection after living donor liver transplantation. Nutrition 2012; 28: 1104–110.
- ↑ Kahn J, Pregartner G,Schemmer P. Effects of both Pro- and Synbiotics in Liver Surgery and Transplantation with Special Focus on the Gut–Liver Axis—A Systematic Review and Meta-Analysis. Nutrients 2000; 12:2461.
- ↑ Jorgenson MR, Descourouez JL, Siodlak M et al. Efficacy and safety of probiotics and synbiotics in liver transplantation. Pharmacotherapy 2018; 38:758-68.
- ↑ Plank LD, Mathur S, Gane EJ, et al. Perioperative immunonutrition in patients undergoing liver transplantation: a randomized double-blind trial. Hepatology 2015; 61:639–647.
- ↑ 78.0 78.1 Plank LD, Ruselle K. Nutrition in liver tranasplantation: to little or too much. Curr Opin Clin nutr Metab Care 2015; 18:501-7.
- ↑ Dasarathy S. Posttransplant sarcopenia: an underrecognized early consequence of liver transplantation. Dig Dis Sci 2013; 58:3103–3111.
- ↑ De Luca L, Westbrook R, Tsochatzis EA. Metabolic and cardiovascular complications in the liver transplant recipient. Ann Gastroenterol 2015; 28:182–192.
- ↑ DiCecco SR, Francisco-Ziller N. Obesity and organ transplantation: successes, failures, and opportunities. Nutr Clin Prac 2014; 29:171–191.
- ↑ 82.0 82.1 Plauth M, Bernal W,Dasarathy S. ESPEN guidelines on clinical nutrition in liver disease. Clin Nutr 2019; 38:485-521.
- ↑ Hasse JM, Blue LS, Liepa GUet al. Early enteral nutrition support in patients undergoing liver transplantation. J Parenter Enteral Nutr 1995; 19: 437-43.
- ↑ Rayes N, Seehofer D, Theruvath T. Supply of pre- and probiotics reduces bacterial infection rates after liver transplantation–a randomized, double-blind trial. Am J Transplant 2005; 5:125-30.
- ↑ Giannini S, Nobile M, Ciuffreda M, et al. Long-term persistence of low bone density in orthotopic liver transplantation. Osteoporosis 2000; 11:417–424.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק