נוהל מוצרים הומאופתיים - חוזר משרד הבריאות
|
| ||
|---|---|---|
| נוהל מוצרים הומאופתיים | ||

| ||
| תחום | תרופות, פרמקולוגיה קלינית , רפואה משלימה | |
| מספר החוזר | 10, עדכון מס' 8 | |
| קישור | באתר משרד הבריאות | |
| תאריך פרסום | עודכן ב-10 בדצמבר 2019 | |
כללי
גישת משרד הבריאות לשימוש בתכשירים הומאופתיים מושתתת על העיקרון שהטיפול בתכשירים הומאופתיים אינו מהווה תחליף לטיפול הרפואי המקובל, וזאת בהתבסס על הקביעה כי יעילותם של התכשירים ההומאופתיים לא הוכחה בשיטות המקובלות ברפואה ולכן לא ניתן לרשמם כתכשיר רפואי על כל המשתמע מכך. ככל שתכשירים הומאופתיים נצרכים על ידי מטופלים ישנה חשיבות לעקוב אחר בעיות אפשריות שעלולות להיגרם מנטילתם בשל תקלות איכות ובטיחות וכחלק מניהול סיכונים הנגזר משימוש בהם.
בספטמבר 1996 נכנס לתוקף הנוהל לפיו הותרו לשווק תכשירים הומאופתיים מוגמרים בטיפות או גלובולים לשימוש פומי במיהולים המדוללים מעבר ל-D6. תכשירים אלה משווקים אך ורק בבתי מרקחת ללא חובת מרשם רופא. בנוסף מותר להכין הכנות הומאופתיות בבתי-המרקחת על-פי מרשמי רופאים, ועל-כן הותר הייבוא של חומרי גלם הומאופתיים / תרכיזים הומאופתיים.
במסגרת עדכון מספר 1 מספטמבר 1998 - הותרו לשווק בארץ גם תכשירים הומאופתיים מוגמרים בצורות מתן נוספות: אבקות ללקיחה דרך הפה, טיפות עיניים, טיפות אוזניים, טיפות אף, פתילות רקטליות, משחות ונוזלים לשימוש על פני העור. נקבע שהתכשירים ההומאופתיים המוגמרים יהיו במיהולים המדוללים מעבר ל-D4 (כולל) ויאושרו על-סמך הרשימות המופיעות בפרמקופיאות ההומאופתיות ובלבד שאינם טעונים מרשם רופא לפיהן. כמו כן יילקחו בחשבון שיקולי בטיחות המבוססים על מידע ממקורות מהימנים אחרים.
עדכון מספר 2 - בא להרחיב את תחום התכשירים ההומאופתיים לשימוש חיצוני לתכשירים בריכוזים גבוהים יותר, ולהוסיף כללים לביצוע הכנות הומאופתיות והעברתן מבית-מרקחת אחד לאחר וכן לאפשר ייבוא חריג בכמות קטנה במקרים מיוחדים.
עדכון מספר 3 - בא לאפשר אישורם של תכשירים הומאופתיים לשימוש בבעלי חיים וניפוקם בבתי מרקחת או במקומות מורשים לניפוק תכשירים וטרינריים כמוגדר בתקנות הרוקחים (ניפוקם של תכשירים וטרינריים, התשמ"ט 1988) בהתאם לסוג בעל החיים לו התכשיר מיועד.
עדכון מספר 4 - בא להוסיף סימון אחיד לאריזות מוצרים הומאופתיים מוגמרים ולפרסומים למוצרים הומאופתיים, להבהיר כללי חישוב של ריכוזים סופיים של מרכיבים הומאופתיים וכללי תיעוד של ניפוק הכנות הומאופתיות.
עדכון מספר 5 - בא להבהיר מיהו מבקש אישור השיווק למוצר הומאופתי, להוסיף נתונים לצורך אישור של מוצרים הומאופתיים מוגמרים, להגביל את הריכוז של תכשיר הומאופתי מוגמר המיועד לשימוש חיצוני, לשנות תנאי השיווק של הכנות הומאופתיות בבית מרקחת ותנאי ייבוא חריג של מוצר הומאופתי על ידי בית מרקחת.
עדכון מספר 6 - בא לאפשר לבעל אישור מוצר הומאופתי לייבא ולשווק מוצרים הומאופתיים עבורם קיבל אישור, באמצעות בית מסחר לתרופות שלא בבעלותו וכן להוסיף הוראה לצרכן להיוועץ ברופא או ברוקח אם סימני המחלה נמשכים או מוחמרים.
עדכון מספר 7 - בא להסדיר את נושא המעקב אחר תופעות לוואי בתכשירים הומאופתיים, פרסום וייעוד תכשירים הומאופתיים לתינוקות, מניעת פרסום סגולות ריפוי, החזרת מוצר הומאופתי מהשוק, ייבוא חריג של מוצר הומאופתי, דרישות איכות לגבי מוצרים הומאופתיים וכן תוקנו הדרישות עבור טיפות עיניים הומאופתיות.
עדכון מספר 8 – הוסף שחרור אצווה על ידי רוקח אחראי, בדומה לנוהלי שחרור תכשיר, הבהרות מספר מושגים והרחבה של טווח חומרי הגלם ההומאופתיים בהתאם למקובל במדינות מוכרות.
הגדרות
- בית מרקחת - כהגדרתו בפקודת הרוקחים (נוסח חדש), התשמ"א - 1981
- בעל אישור - תושב ישראל או תאגיד רשום בישראל שקיבל אישור שיווק מוצר הומאופתי לפי נוהל זה
- חומר גלם הומאופתי - חומר המופיע בפרמקופיאה הומאופתית רשמית עדכנית של אחת המדינות הבאות (להלן: פרמקופאיה מוכרת): ארצות הברית, אנגליה, גרמניה, צרפת (להלן: חומר גלם).
חומר גלם הומאופתי יכול להיות חומר גלם ראשוני או תרכיז הומאופתי (תמיסת אם) - מדיגה מוכרת - מדינות החברות באיחוד האירופאי, שווייץ, נורווגיה, איסלנד, ארצות הברית, קנדה, אוסטרליה,
יפן וישראל ובלבד שהמדינה מקיימת הסדר רגולטורי המקנה אישור לכל מוצר הומאופתי, כנדרש לפי נוהל זה
- מעקב יזום - מעקב פרואקטיבי של בעל אישור תוך יצירת קשר עם הרופא או בית המרקחת וכן קיום קו מידע למטופל באמצעותו ניתן לדווח על תופעת לוואי או חשד לתופעת לוואי
- מרשם רופא - בהתאם לתקנות הרופאים (מתן מרשם) התשמ"א - 1981
- פנקס הכנות הומאופתיות - ספר או מחברת או אוגדן או תוכנת מחשב שניתן לשנות רק כאשר כל שינוי בה יהיה ניכר
- רוקח אחראי למוצר הומאופתי - בעל רישיון ישראלי לעסוק ברוקחות שמונה על ידי מבקש אישור שיווק למוצר הומאופתי או חומר גלם הומאופתי על מנת לייצג אותו בכל האמור בנוהל זה או חלקים ממנו
- ריכוזים הומאופתיים - בספרות ההומאופתית מסומנים ריכוזים באופן הבא: ריכוז הומאופתי D4 מקביל למיהול של 1:10,000 (0.01%); ריכוז הומאופתי D6 מקביל למיהול של 1:1,000,000 ; ריכוז הומאופתי D8 מקביל ל - 1:108 וכן הלאה
- מוצר הומאופתי - מוצר הומאופתי מוגמר מוכן לשימוש באדם או בבעלי חיים, המכיל דילול של חומר גלם אחד או מספר חומרי גלם כפי שמופיע באחת הפרמקופיאות בסעיף 2.3
תוכן הנוהל
אישור שיווק
- מוצר הומאופתי יאושר לשיווק לאחר שהוכחה בטיחותו. במקרים מסוימים יידרש מגיש הבקשה לצרף נתונים טוקסיקולוגיים לגבי המוצר ההומאופתי בריכוז המוצע
- מוצר הומאופתי המיועד לשימוש מתחת לגיל שש לא יאושר אלא על בסיס נתונים קליניים ובטיחותיים המתייחסים לילדים. מוצרים שלא יעמדו בדרישות אלו, ייפסק שיווקם תוך שנה מתאריך פרסום נוהל זה
- נתוני בטיחות ונתונים קליניים בילדים מתחת לגיל 6 יש לשלוח לאגף הרוקחות למנהל המחלקה לייבוא, והם ידונו בוועדה שתתכנס אד הוק וחבריה יהיו: יו"ר - מנהל המחלקה לייבוא, מנהלת המחלקה לניהול סיכונים, נציג מחלקת רישום, נציג מחלקת ניסויים קליניים, ורופא ילדים שהוא פרמקולוג קליני
- לא יאושרו לשיווק מוצרים הומאופתיים לתינוקות המכילים אלכוהול
- מרכיבים הומאופתיים חייבים להימצא במוצר המוגמר בריכוז מרבי של 1:10,000 או 0.01% (מקביל לריכוז הומאופתי D4)
- מוצר המכיל שילוב של מרכיב הומאופתי עם מרכיב רפואי או חומר אחר לא יחשב כמוצר הומאופתי לפי נוהל זה
- חומר גלם הומאופתי יאושר על-פי הכללתו במקור מאושר כמוגדר בסעיף 2.3
- האישור לשיווק יינתן לכל חומר גלם או מוצר מוגמר באופן פרטני לתקופה של עד 5 שנים
- מוצר הומאופתי ייובא וישווק על ידי בעל אישור השיווק ובאמצעות בית מסחר לתרופות, למעט מוצר הומאופתי ביבוא חריג כאמור להלן בסעיף 3.16
- בקשה לחידוש אישור יש להגיש שלושה חודשים לפני מועד פקיעת תוקף האישור
- מוצר הומאופתי לשימוש בבעלי חיים יאושר לאחר שתתקבל חוות דעת כתובה מהממונה על התרופות בשירותים הוטרינריים במשרד החקלאות
צורות מינון
תכשיר הומאופתי מוגמר ניתן לשווק באחת מצורות המינון הבאות בלבד:
- מתן דרך הפה: טיפות, כדוריות (גלובולים) שהוספגו בנוזל, טבליות למציצה או אבקה לנטילה פומית
- משחות ונוזלים לשימוש על פני העור
- פתילות רקטליות
- טיפות אף
- טיפות אוזניים
- טיפות עיניים
ייבוא
- ניתן לייבא מוצרים הומאופתיים שקיבלו אישור כאמור, המיוצרים במפעלים אשר עומדים בתנאי ייצור נאותים על-פי אישור מהרשויות המוסמכות בארץ בה התכשיר מיוצר ובלבד שיהיו מהמדינות החברות באיחוד האירופאי, שווייץ, נורווגיה, איסלנד, ארצות הברית, קנדה, אוסטרליה, יפן וישראל
- הייבוא יותר רק למפעלים פרמצבטיים מאושרים ולבתי מסחר לתרופות
- לרשויות המכס יינתן אישור מיוחד לייבוא על ידי המחלקה ליבוא ופרמצבטיקה
האישור ליבוא יינתן על-פי צו יבוא חופשי לשנתיים או עד תום תוקף אישור השיווק (המוקדם שבניהם).
ייצור בארץ
ניתן לייצר חומרי גלם הומאופתיים ומוצרים הומאופתיים במפעלים המקיימים תנאי ייצור נאותים, שקיבלו אישור על-כך מהמכון לביקורת ולתקנים של חומרי רפואה - משרד הבריאות, ירושלים.
שיווק לבתי מרקחת
חומרי גלם הומאופתיים / תכשירים הומאופתיים ישווקו לבתי-המרקחת על ידי בתי-מסחר לתרופות בלבד. חומרי גלם / תכשירים הומאופתיים יאוחסנו ויובלו ע"פ הנחיות היצרן.
אחסון וניפוק בבית המרקחת
מוצר הומאופתי מוגמר יאוחסן מאחורי דלפק הרוקח בנפרד מהתרופות וינופק לצרכן על ידי רוקח בבית-מרקחת בלבד, וזאת ללא חובת מרשם רופא.
- הכנה הומאופתית תנופק בבית-מרקחת על-פי מרשם רופא בלבד במקרים הבאים
- הכנה הומאופתית ה מכילה מרכיב הומאופתי בריכוז גבוה מ -D8 (1:108), או מלחי שוסלר בריכוז גבוה מ -D6 (1:106)
- הכנה הומאופתית המכילה מספר מרכיבים הומאופתיים שסה"כ הריכוז שלהם עולה על D6
- רשאי אגף הרוקחות מטעמים שינמק לחייב סוגים נוספים של הכנות הומאופתיות במרשם רופא
- תכשירים הומאופתיים המיועדים לחיות מחמד ינופקו בבית מרקחת בלבד
- תכשירים הומאופתיים המיועדים לחיות משק ינופקו גם במקומות ניפוק מורשים כמוגדר בתקנות הרוקחים (ניפוקם של תכשירים וטרינריים, התשמ"ט 1988) ע"פ מרשם רופא וטרינר
מעקב אחר תופעות לוואי
- בעל אישור לשיווק ידווח למחלקה לניהול סיכונים באגף הרוקחות על כל תלונה או חשד לתופעת לוואי בתכשיר הומאופתי
- בעל האישור לשיווק יבצע מעקב תופעות לוואי מתמיד ויגיש סיכום הממצאים מדי שנה לאגף הרוקחות
- בעל האישור לשיווק יעמיד לרשות המטופלים את פרטיו לצורך דיווח על תופעות לוואי
החזרה מהשוק
- אין לשווק מוצרים שהוחזרו מהשוק במדינה מוכרת שבה היו משווקים
- בעל אישור או בית מרקחת מייבא יודיע למשרד הבריאות על כל בעיה שהתגלתה במוצר בחו"ל
- בית מסחר לתרופות או בית מרקחת המייבא מוצר הומאופתי לפי סעיף 3.16 להלן, יבצע החזרה מהשוק בכל עת שיידרש, על-פי נוהל 3
הכנות הומאופתיות
- הכנות הומאופתיות תבוצענה בפיקוחו של רוקח מורשה ובאחריותו להיבט האיכות והבטיחות
- חומרי הגלם בהם ייעשה שימוש הם חומרי גלם המאושרים על ידי משרד הבריאות
- יציבות תמיסות אם תיקבע על ידי היצרן ע"פ בדיקות יציבות לפי הנחיות EMA או שיטה ולידית אחרת
- הארכת תאריכי תוקף של תמיסות/טריטורציות ביניים מדוללות תיקבע ע"פ בדיקות היציבות של המונוגרף הרלוונטי בפרמקופאיה או בהיעדרה, מונוגרף IN-HOUSE ובלבד שיסופק תימוכין לולידיות של הבדיקה
- יש לקבוע תאריכי תפוגה עבור הכנות הומאופתיות מוגמרות ולהצדיקם על בסיס נתונים מקצועיים ספרותיים ו/או על בסיס נתוני יציבות תוך התחשבות בתנאי האחסון הצפויים ובכל מקרה תאריכי תוקף של הכנות מוגמרות יהיו עד חצי שנה מתאריך ההכנה או בהתאם לבדיקות יציבות כאמור.
- תיעוד: הכנה הומאופתית תתועד בבית-המרקחת המכין בפנקס ההכנות ההומאופתיות כמפורט להלן:
- מספר סידורי של ההכנה
- תאריך ההכנה ותוקף ההכנה
- שם המטופל
- שם הרופא רושם מרשם או שם מזמין ההכנה
- הרכב ההכנה (כולל דילולים הומאופתיים)
- מאפייני הרכיבים - מספר אצווה ותאריך תפוגה
- חומרי עזר בתכשיר
- שם הרוקח האחראי על ההכנה וחתימתו
- סימון: הכנה הומאופתית תסומן על-גבי האריזה בבית המרקחת המכין כדלקמן:
- שם וכתובת בית המרקחת המכין
- תאריך ההכנה
- המספר הסידורי של ההכנה
- שם המטופל
- שם רושם המרשם או שם המזמין
- הוראות שימוש ואחסון (יכולות להופיע גם בעלון מצורף)
- ניפוק, הובלה ומסירה של הכנה הומאופתית שהוכנה בבית מרקחת אחר:
ניפוק, הובלה ומסירה של הכנה הומאופתית שהוכנה בבית מרקחת אחר תתבצע בהתאם לסעיפים 3.6, 3.7 בנוהל 128 של אגף הרוקחות כאשר בית המרקחת המבצע את ההכנה הוא בית המרקחת המנפק.
חובת מרשם רופא תחול על ההכנות ההומאופתיות החייבות מרשם על-פי נוהל זה. הסבר כאמור בסעיף 3.10.4 יינתן על ידי בית המרקחת המוסר או יינתן בכתב בצמוד לתכשיר ההומאופתי - שמירת מסמכים להכנה הומאופתית:
בית המרקחת מוסר ההזמנה ובית המרקחת המכין ישמרו את מרשם הרופא עבור הכנה הדורשת מרשם רופא (או העתקו), ההזמנה ותעודת המשלוח לתקופה של שנה. ספר המרשמים או רשימת ההכנות במחשב ישמרו לתקופה של 7 שנים - אחריות על ההכנה וניפוקה:
האחריות על הכנה הומאופתית חלה על הרוקח בבית המרקחת המכין לרבות התיעוד, אופן המשלוח והסימון כאמור. האחריות לניפוק הכנה הומאופתית חלה על הרוקח המנפק אותה
פרסום ואיסור ייחוס סגולות ריפוי
- אין לייחס התוויה רפואית או סגולת ריפוי, מניעה או אבחון של מחלות לחומר גלם ו/או תכשיר הומאופתי מוגמר על-גבי אריזת המוצר ועל גבי כל חומר פרסומי לציבור בכל מדיה שהיא
- בעל אישור לשיווק מצור הומאופתי המעוניין לפרסם/ לציין על גבי אריזת מוצר הומאופתי כי: הוא נטול תופעות לוואי/ אינו פוגע בערנות / בטוח לשימוש ארוך טווח / בטוח / בטוח בנשים בהיריון או נשים מניקות או כל הצהרה אחרת הנוגעות לבטיחות מוצר הומאופתי, עליו להציג נתונים קליניים לשיווק מוצר הומאופתי התומכים בכך ולקבל על כך אישור מוקדם בכתב
- בעל אישור יוודא כי כל פרסום תכשיר הומאופתי לקהל הרחב לא יטעה את הציבור ולא ייחס לו סגולות ריפוי, מניעה או איבחון מחלות וכן יוסיף בכל פרסום את הכיתוב הבא באופן מודגש וברור בגודל שלא יופחת משני שלישים משם התכשיר:
"תכשיר הומאופתי ללא התוויה רפואית מאושרת"
אם הפרסומת היא למספר מוצרים יופיע הכיתוב בסמוך לכל מוצר המוצג בפרסומת - רוקח המנפק מוצר הומאופתי יסביר למטופל כי הטיפול ההומאופתי אינו מחליף טיפול תרופתי מאחר שהמוצר ההומאופתי לא הוכיח יעילות רפואית. כמו כן יוודא כי המטופל אינו מפסיק את הטיפול תרופתי ככל שניתן לו. כמו כן ידגיש הרוקח בפני המטופל כי המוצר מכיל לקטוז, אלכוהול או חומר עזר אחר בהתאם לעניין
סימון
- סימון חומר גלם הומאופתי:
על גבי האריזה הפנימית והחיצונית יצויין:- חומר גלם הומאופתי
- שם החומר באותיות לטיניות
- כמות באריזה
- מספר אצווה ותאריך תפוגה
- שם היצרן, היבואן בעל האישור והמפיץ וכתובותיהם
- הוראות לאחסון חומר הגלם
- מוצר הומאופתי:
על גבי האריזה הפנימית והחיצונית יצוינו הפרטים הבאים:- מספר האישור של התכשיר
- הכיתוב:
"מוצר הומאופתי ללא התוויה רפואית מאושרת",
"יש להיוועץ ברופא או ברוקח טרם השימוש במוצר ואם סימני המחלה אינם עוברים או מוחמרים".
הכתובית תודפס באופן מודגש וברור באותיות שגודלן לא יפחת משני שלישים (2/3) גודל אותיות שם המוצר ההומאופתי - שם המוצר באותיות לטיניות, הזהה לשם המופיע בפרמקופיאה ההומאופתית. הרלוונטית ודרגת המיהול (לפי השיטה ההומאופתית)
- פירוט חומרי העזר במוצר ההומאופתי
- שם היצרן, היבואן, בעל האישור והמפיץ וכתובותיהם (בעברית)
- כמות באריזה
- מספר אצווה ותאריך תפוגה
- הוראות מיוחדות לגבי שימוש במוצר (בעברית)
- הוראות לאחסון (בעברית)
- שמות המרכיבים ההומאופתיים באותיות לטיניות הזהים לשמות המופיעים בפרמקופיאה ההומאופתית הרלוונטית ודרגת המיהול (לפי השיטה ההומאופתית)
- במוצר שמכיל שילוב מרכיבים הומאופתיים, אין מניעה בהוספת שם נוסף (להלן: שם מסחרי) ובתנאי שלא תהיה משום רמיזה להתוויה רפואית.
השם המסחרי של המוצר יופיע באותיות לטיניות ובעברית - על-גבי האריזה הפנימית והחיצונית של מוצר הומאופתי לשימוש בבעלי חיים תופיע הכתובית הבאה באותיות שגודלן כמפורט בסעיף 3.11.2 (ב):"לשימוש בבעלי חיים בלבד"
- סימון מוצר הומאופתי בבית מסחר לתרופות:
באחריותו של הרוקח הממונה לוודא התאמת אריזת מוצר הומאופתי לאישור השיווק שניתן למוצר. בית מסחר לתרופות רשאי לבצע התאמת אריזה למוצר הומאופתי או חומר גלם הומאופתי בהתאם לנוהל פנימי, באישור הרוקח המחוזי
הוראות להגשת הבקשה לאישור שיווק / חידוש אישור שיווק חומר גלם הומאופתי / מוצר הומאופתי
- בקשות לאישור שיווק מוצר הומאופתי, חידושו או שינוי בו (להלן בקשות) יגיש רוקח ממונה למוצר הומאופתי לאגף הרוקחות, משרד הבריאות, ירושלים
- בקשה אחת יכולה לכלול מספר מוצרים המכילים את אותם חומרי גלם במיהולים שונים ובצורות מינון שונות
- כל החומר יוגש בשפה עברית ו/או אנגלית. מסמכים רשמיים יוגשו בשפה המקורית בצירוף תרגום לעברית או אנגלית המאושר על ידי נוטריון
פרטי הבקשה לאישור חומר גלם / תכשיר הומאופתי
- טופס בקשה לאישור שיווק חומר גלם /מוצר הומאופתי (נספח 1)
- קבלה מקורית על תשלום האגרה הנהוגה על ידי משרד הבריאות בעת ההגשה עבור כל בקשה אשר תשולם לזכות אגף הרוקחות, חשבון מספר 0-03807-9, בבנק הדואר
- אישור עדכני מרשות מוסמכת בארץ הייצור על קיום תנאי ייצור נאותים במפעל
- צילום מונוגרף ממקור מאושר, הרלוונטי לכל חומר גלם / מוצר הומאופתי
- ספציפיקציות ותעודת אנליזה של מוצרים מוגמרים מטעם היצרן
- תמיסות אם יישאו הצהרה מטעם היצרן בעל האישור, כי האצווה יוצרה בהתאם למונוגרף במקור מוכר והם הותרו לשיווק במדינה מוכרת
- סקיצה של האריזה המוצעת ונוסח מדויק של התווית על האריזה כפי שמבוקשת לשיווק בישראל (לפי סעיף 3.11)
- תעודת מכירה חופשית עדכנית (מהשנה האחרונה) מהרשויות המוסמכות בארץ הייצור, או בארץ בה משווק מוצר הומאופתי מוגמר אשר תכלול את שם המוצר, שם היצרן, כתובת אתר הייצור, הצהרה לגבי שיווק המוצר כמוצר הומאופתי וללא מרשם רופא
- דוגמה של האריזה המקורית בלועזית (פנימית וחיצונית) של המוצר כפי שהוא משווק בארץ הייצור או במדינה שממנה התקבלה תעודת המכירה שצוינה בסעיף הקודם (דוגמת התכשיר)
שחרור אצווה של מוצר הומאופתי לשיווק
רוקח אחראי, ישחרר אצוות מוצר ההומאופתי לשימוש הציבור בהתאם לנספח 3 לנוהל זה.
שמידת מסמכים למוצר הומאופתי ושינויים במוצר הומאופתי
על מקבל האישור לשיווק מוצר הומאופתי לשמור אצלו את תיק המוצר ובתוכו כל המסמכים הרלוונטיים הנדרשים לפי נוהל זה.
כל שינוי שיעשה במפרט המוצר ההומאופתי ידווח לאגף הרוקחות לא יאוחר מ־30 ימים מיום ביצועו.
כל שינוי באריזת המוצר ההומאופתי מחייב אישור מוקדם של אגף הרוקחות.
ייבוא חריג של מוצר הומאופתי
הוראות אלה לא יחולו על מוצר הומאופתי למתן פומי או חיצוני, שיובא באריזתו המקורית על ידי בית- המרקחת בכמות קטנה באישור הרוקח המחוזי, ללקוחות של אותו בית מרקחת בלבד.
- הרוקח המחוזי יאשר הנ"ל בהתקיים תנאים אלה
- המוצר ינופק אך ורק למי שבידו מרשם רופא
- כמות הצריכה לא תעלה על 6 חודשים
- תוקף חיי המדף של המוצר לא יפוג תוך 6 חודשים לפחות מתאריך הנפקתו לצרכן
- חומר גלם הומאופתי או מוצר הומיאופתי מוגמר שישמש אך ורק כחומר גלם לא ישווק לצרכן ויסומן על ידי תווית "חומר גלם לא למכירה"
- המוצר המיובא מיועד לטיפול בלקוח בית המרקחת המבקש בלבד
- הרוקח מתחייב ליידע את המטופל כי המוצר ההומאופתי לא עבר את הליך האישור על-פי נוהל מוצרים הומאופתיים בישראל ולצרף מידע והוראות שימוש בעברית בהתאם למידע המופיע על תווית המוצר בחו"ל ועלון המידע המצורפים אליו
- אישור הייבוא החריג של מוצר הומאופתי יינתן על ידי המחלקה ליבוא ופרמצבטיקה באגף הרוקחות, לאחר שמולאו התנאים ונחתם נספח מס' 2 של הנוהל.
פיקוח
דיווח תופעות לוואי על ידי בעל האישור לשיווק וכן פרסום למוצר הומאופתי ייבדקו על ידי ביקורות של הרוקחות המחוזית וכן על ידי אגף הרוקחות.
אחריות לביצוע
אגף הרוקחות - משרד הבריאות.
המכון לביקורת ולתקנים של חומרי רפואה - משרד הבריאות.
רוקחים מחוזיים: ירושלים, תל אביב, חיפה, מרכז, צפון, דרום.
השירותים הווטרינריים.
תחולה
תחולתו של עדכון זה 30 ימים מיום פרסומו למעט שינויי סימון - "מוצר הומאופתי", אשר יחולו כעבור שנה מפרסום עדכון זה לנוהל.
נספחים
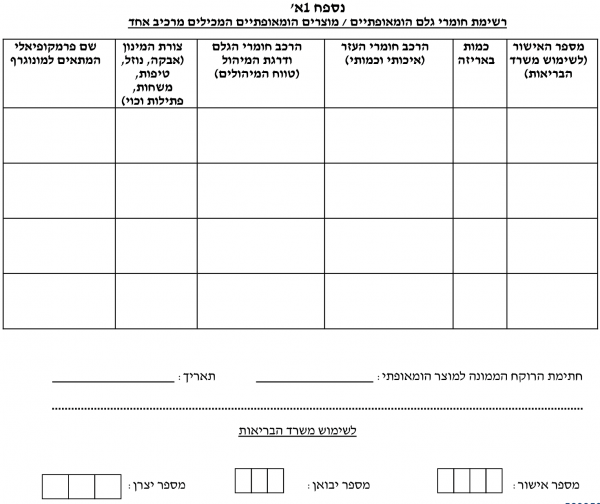
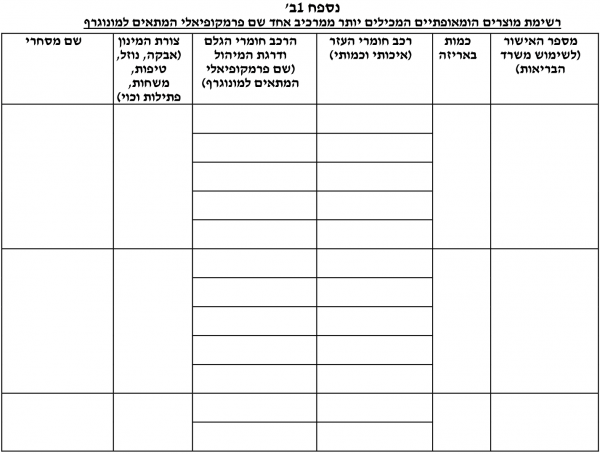
טופס בקשה לאישור שיווק חומר גלם / מוצר הומאופתי מוגמר - (נספחים 1, 1א', 1ב׳).
טופס הוראת רופא עבור יבוא חריג של מוצר הומאופתי - (נספח 2).
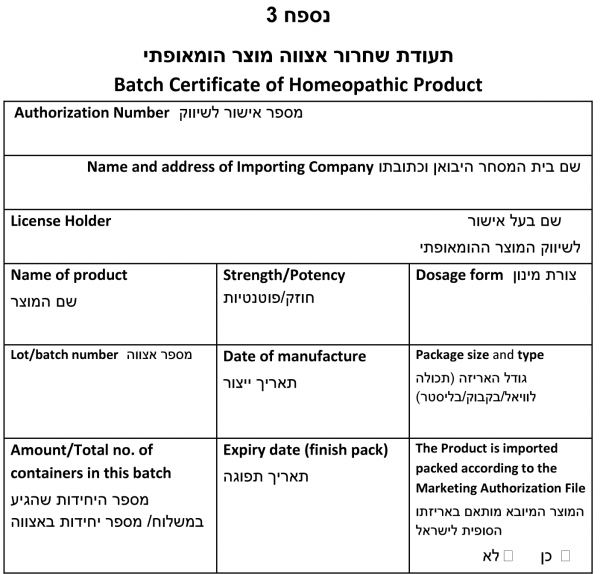
טופס תעודת שחרור אצווה של מוצר הומאופתי - (נספח 3).
מסמכים ישימים
הפרמקופיאה ההומאופתית האמריקאית, האנגלית, הצרפתית והגרמנית.
תקנות הרוקחים (תנאי פתיחה וניהול של בתי מסחר לתרופות, (התשנ"ג-1993).
צו יבוא חופשי (התשל"ח 1978).
נוהל מספר 3 - הודעה על פגם; החזרת תכשיר מן השוק.
נוהל מספר 6 - דיווח תופעות לוואי ומידע בטיחות חדש.
נוהל מספר 128 - שירותי הובלה ומסירת תכשירים מבית מרקחת.
נספחים
ניתן בזאת אישור שיווק / חידוש אישור שיווק* לחומרי הגלם / המוצרים ההומאופתיים * מייבוא / מייצור מקומי * על-פי הרצ"ב תנאי האישור:
- חומר הגלם/המוצר ישווק באריזה עם תווית כמפורט בנוהל וע"פ הצעת התווית שהתקבלה. כל שינוי בתווית זו טעון אישור מוקדם של אגף הרוקחות
- לא תופיע התוויה רפואית או סגולת ריפוי על גבי אריזת מוצר הומאופתי או בפרסום לציבור הרחב
חומר הגלם/המוצר ישווק על ידי מפעלים מאושרים לייצור מוצרים הומאופתים, בתי מסחר לתרופות ובתי מרקחת בלבד על מקבל האישור לשיווק לשמור בתיק המוצר תעודות אנליזה או ספסיפיקציות לחומר הגלם עבור כל אצווה של חומר גלם/מוצר הומאופתי שישווק
- חומר גלם הומאופתי לא ישווק לצרכן
- אין אישור זה בא במקום אישור מיוחד ע"פ צו ייבוא חופשי
- __ לשימוש בבעלי חיים בלבד.
- הערות
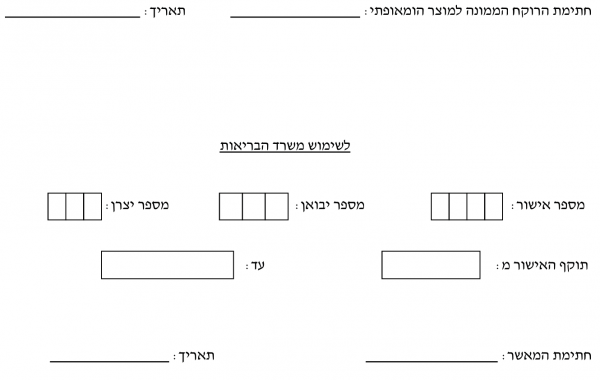
- _____________________________________________________________
תאריך: ____/__/__
חתימת המאשר ____________________
תוקף האישור מ: ____/__/__ עד: ____/__/__
חתימת המאשר ____________________ תאריך: ____/__/__
(לשימוש הרוקח המחוזי)
מאושר / לא מאושר תוקף האישור עד תאריך: ____/__/__
הערות או תנאים לאישור: ____________________________________________________________
תאריך: ____/__/__ חתימה וחותמת הרוקח המחוזי:_________________________
טופס זה איגו מהווה אישור ייבוא
תוקף הבקשה 3 חודשים מתאריך חתימת הרופא
- הצהרת הרוקח האחראי
אני מצהיר בזאת כי כל המידע הנמצא בהודעה הוא נכון ומדויק וכי נסקרו מסמכי היצרן, מסמכי ההובלה והתאמת האריזה (אם ישים) והאצווה עומדת במפרט ובמפורט באישור הייבוא.
המוצר יוצר, נארז ונבדק בהתאם לתנאי ייצור נאותים למוצרים הומאופתיים ובהתאם להוראות נוהל 10 של אגף הרוקחות והחוק בישראל.
- מצורפים בזאת המסמכים הבאים
- תעודת האנליזה של המוצר המוגמר מאתר הייצור
- העתק נתוני אוגרי הטמפרטורה שצורפו למשלוח
אני מצהיר בזאת כי:
- __לא היו חריגות טמפרטורה. תנאי המשלוח המוגדרים על ידי היצרן: _______________________________
- __ היו חריגות טמפרטורה בתהליך ההובלה. (יש לצרף נתונים ורציונל לשחרור האצווה)
- __לא צורפו חיישני טמפרטורה בתהליך ההובלה (יש לצרף נתונים ורציונל לשחרור האצווה)
שם המוצר:
| שמות היצרנים וקבלני המשנה שהיו מעורבים בייצור, בדיקה ושחרור בחו"ל ובארץ וכתובתם. הפרטים יתאימו למידע ברישיון היבואן
All sites involved in the manufacture including packaging and quality control of the batch should be listed with name and address. The name and address must correspond to the information provided on the Manufacturing Authorisation/Establishment Licence. |
| הערות Comments/remarks:
Any additional information that can be of value to the importer and/or inspector verifying the compliance of the batch certificate (e.g. specific storage or transportation conditions). |
שם הרוקח האחראי המשחרר את האצווה לשיווק :
חתימה: _________________ תאריך: ____/__/__


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק