מחלת גושה - Gaucher's disease
| מחלת גושה | ||
|---|---|---|
| Gaucher's disease | ||
| 250px | ||
Acid beta-glucosidase
| ||
| ICD-10 | Chapter E 75.2 (ILDS E75.220) | |
| ICD-9 | 272.7 | |
| MeSH | D005776 | |
| יוצר הערך | פרופ' איין כהן, ד"ר נעה רורמן | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – מחלות אגירה
מחלת גושה (Gaucher's disease) היא מחלת אגירה ליזוזומלית (Lysosomal storage disease) הנגרמת מהצטברות חומר שומני-סוכרי, Glucocerebroside, בתאים שונים בגוף. בבסיס המחלה עומדת פגיעה גנטית בתפקוד האנזים הליזוזומלי Glucocerebrosidase, שתפקידו לפרק את ה-Glucocerebroside. פגיעה זו גורמת להצטברות Glucocerebroside ולהתבטאות המחלה. תסמיני מחלת גושה כוללים אנמיה, ירידה ברמת הטסיות, הגדלה של כבד וטחול ומחלות עצם כגון התקפי כאב בעצמות, שברים, Osteoporosis ועיוותי עצם. המחלה שכיחה בקרב יהודים אשכנזים ומועברת בתורשה אוטוזומלית רצסיבית.
לנוכח שכיחות גבוהה יחסית של המחלה בישראל לצד קיומו של טיפול יעיל ובטוח, קיימת חשיבות מרכזית לאימוץ רמת חשד גבוהה על ידי רופאים בישראל.
אפידמיולוגיה
מחלת גושה היא מחלה גנטית, פנ-אתנית נדירה. שכיחותה בישראל יוצאת דופן בשל היארעות גבוהה במיוחד בקרב יהודים-אשכנזים. בשנת 2016 מספר המאובחנים בישראל עמד על כ-1000 חולים, מהם כשליש תסמיניים ומטופלים באנזים חליפי [ראו גנטיקה ופנוטיפ (Phenotype) בהמשך].
שיעור הנשאות למחלת גושה בקרב יהודים אשכנזים עומד על כ- 1:17. לפי שכיחות זו, ניתן להסיק כי בישראל קיימים חולי גושה רבים שאינם מאובחנים.
מחלת גושה קיימת בשכיחות נמוכה יותר גם בקרב אוכלוסיות שונות בישראל, בהן האוכלוסייה הבדואית בנגב.
אטיולוגיה
פתופזיולוגיה
מחלת גושה נגרמת כתוצאה מפגיעה בייצורו של האנזים הליזוזומלי Glucocerebrosidase. האנזים אחראי לפירוק Glucocerebroside, שהוא מרכיב ספינגוליפידי (Sphingolipid) חשוב בקרום התא. בתאים בריאים, מפורק ה-Glucocerebroside ל-Glucose ו-Ceramid בליזוזום התא. לעומתם, במחלת גושה, פגיעה באנזים ה-Glucocerebrosidase גורמת לאגירת Glucocerebroside. ה-Glucocerebroside נאגר בעיקר במאקרופאגים אשר בולעים ומפרקים תאים מתים. המאקרופאגים העמוסים בחומר שומני מכונים "תאי גושה" (Gaucher cells) והם נאגרים בכבד, בטחול, במח העצם ולעתים אף בריאות. לכן, סובלים חולי הגושה מתסמינים כגון הגדלת כבד (Hepatomegaly) וטחול (Splenomegaly), אנמיה, ירידה ברמת הטסיות (Thrombocytopenia), Osteoporosis, כאבי עצמות, תמט של מפרק הירך וקריסת חוליות עמוד שדרה.
על אף שהמנגנון טרם פוענח, נראה כי Glucoceramide שלא פורק, הופך לחומר בשם Glucosylsphingosine (Lyso-GL-1), שרמתו גבוהה במיוחד בפלזמה (Plasma) של חולי גושה[1]. חומר זה גורם לירידה בפעילותם של תאים שונים. עדות לרעילות של השומנים הנאגרים בפלזמה של החולים ניתן למצוא במחלת גושה המערבת את מערכת העצבים (סוג 2 ו-3; ראו בהמשך), במסגרתה נראה כי ההשפעה על המוח נובעת מהשפעתם הרעילה של Bioactive lipids[1].
מחלת גושה משפיעה גם על מערכת החיסון; נמצא כי החולים סובלים יותר ממיאלומה נפוצה וממצבי Gammopathy (Monoclonal או Polyclonal)[2]. משפחת תסמינים אחרת של המחלה נגרמת כתוצאה מירידה בפעילות Osteoblasts, המתבטאת בדלדול מסת עצם ובהופעת עיוותי שלד כגון Erlenmeyer flask deformity.
מחקרים רבים שנערכו מאז תחילת המאה ה-21, הוכיחו כי קיים קשר בין מחלת הגושה, או מצב של נשאות לגושה , לבין סיכון מוגבר לפתח מחלת פרקינסון. נשאות למוטציות בגן GBA מוגדרת כאחד מגורמי הסיכון הגנטיים השכיחים ביותר למחלת הפרקינסון. נראה כי מוטציות שונות מעלות את הסיכון לפתח מחלה בגיל מבוגר באחוזים שונים (gan-or). מחלת הפרקינסון היא מחלה מולטיפקטוריאלית (רב גורמית) ונשאות למוטציה בגן GBA אין משמעה כי המטופל יחלה בפרקינסון.
הבנת הקשר בין שינויים בגן GBA לבין סיכון מוגבר לפתח פרקינסון, סייעה בהבנת מנגנון מחלת הפרקינסון ובפיתוח טיפולים המסתמנים כיעילים למחלה זו[3][4][5].
גנטיקה ופנוטיפ
מחלת גושה מועברת בתורשה אוטוזומית רצסיבית. מזוהות כ-120 מוטציות גנטיות המוגדרות כגורמות מחלה (לפי אתר CLINVAR), כאשר מדובר בקשר חלקי בין גנוטיפ (Genotype) לפנוטיפ (Phenotype)[1][6].
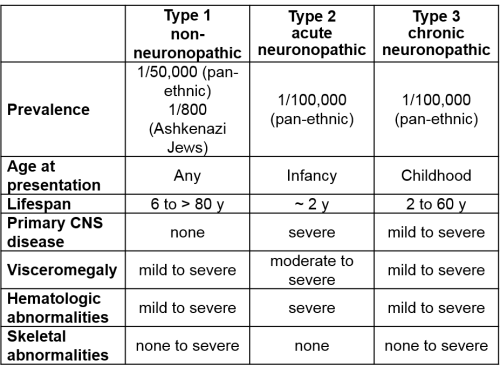
למחלה שלושה סוגים (פנוטיפים) עיקריים, המוגדרים על פי רמת המעורבות של מערכת העצבים המרכזית (טבלה מספר 1). הפנוטיפים הקשים קשורים בנוכחות של מוטציות מסוג פסק (nonsense) הגורמות לירידה חמורה ברמת פעילות האנזים Glucocerebrosidase.
כאשר לפחות אחד מהאללים (Alleles) (עותקי הגן) נושא מוטציה קלה, כזו המאפשרת פעילות שאריתית משמעותית, מופיעה מחלה קלה (סוג 1).
- מחלת גושה מסוג 1 - Non neuropathic Gaucher's disease - אינה מערבת את מערכת העצבים ומהווה 94 אחוזים ממקרי הגושה. בקרב יהודים אשכנזים עומדת שכיחותה על 1 ל-850 בקירוב, לעומת 1 ל-60,000-40,000 בעולם. שכיחותה באוכלוסייה האשכנזית גבוהה משכיחותן של ממאירויות המטולוגיות (Hematologic malignancies)[7]
- מחלת גושה מסוג 2 - Acute infantile neuropathic Gaucher's disease – מתאפיינת במעורבות קשה של מערכת העצבים המרכזית ובתוחלת חיים שאינה עולה על שלוש שנים. מהווה כאחוז אחד ממקרי הגושה[8] ושכיחותה המוערכת עומדת על 1:150,000
- מחלת גושה מסוג 3 – Chronic neuropathic Gaucher's disease – מחלה המערבת את מערכת העצבים המרכזית, אך מתפתחת לאט. פנוטיפ זה מופיע בכחמישה אחוזים מחולי הגושה[8] ומתאפיין בחומרת מחלה משתנה. תת-סוג זה אופייני לחולים הומוזיגוטים למוטציה D409H. תועדו מספר מקרים של מחלה זו בקרב ערביי ישראל
המוטציות השכיחות ביותר בישראל הן: N370S, 84GG, IVS2+1, D409H, L444P, V394L[9]. המוטציה הנפוצה ביותר היא N370S, המצויה בקרב שבעים אחוזים מנושאי הגן המוטנטי, ומגנה מפני פנוטיפ עם מעורבות עצבית. לעומתה, הימצאות מוטציה L444P, ללא מוטציה נוספת מסוג N370S, גורמת בהכרח למחלת גושה מסוג 3.
המוטציה R87W היא מוטציה שכיחה בקרב האוכלוסייה הבדואית בנגב וגורמת לביטוי של גושה סוג 1.
קליניקה
התבטאות מחלת גושה שונה בכל סוג.
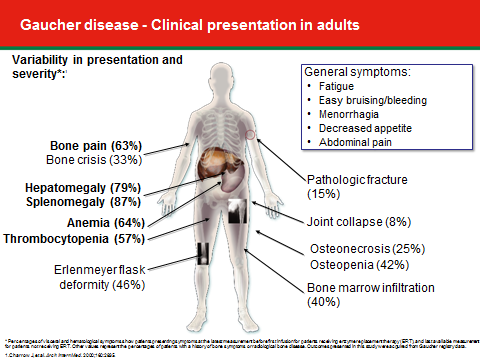
- מחלת גושה מסוג 1 - מחלה בעלת ביטוי רבגוני, במסגרתה תיתכן שונות בעוצמת הופעת התסמינים בין אחים הנושאים את אותן מוטציות ואף בין תאומים Monozygotic[10]. חולים תסמיניים מוגדרים ככאלה בהופעת אחד או יותר מהתסמינים הבאים (תמונה מספר 2): הגדלה של כבד ו/או טחול, אנמיה, ירידה ברמת הטסיות, ירידה בצפיפות עצם, Osteopenia או Osteoporosis, הסננה של מח העצם ב"תאי גושה" (מודגמת באמצעות MRI), עיוותי עצם (כאשר האופייני ביותר הוא ה-Erlenmeyer flask deformity), שברים, תמט מפרקים (בעיקר מפרק הירך), עיכוב בהתפתחות המינית, הפלות או דמם בזמן מחזור ועייפות, הנפוצה מאוד בקרב חולי גושה. גם בחולים הנחשבים לכאורה א-תסמיניים, ניתן למצוא חלק מהתסמינים שהוזכרו, בדרגת חומרה קלה. מחלת גושה יכולה להתבטא בגילים שונים, בעוצמות שונות ובאיברים שונים. הביטוי המשמעותי עשוי להיות מחלת עצם או מחלה המטולוגית[11]
- מחלת גושה מסוג 2 - התסמינים האופייניים כוללים ניוון מהיר של חלקו הקדמי של גזע המוח, עיכוב פסיכומוטורי קשה, התקפים הכוללים רעידות ופרכוסים, לצד פזילה או חוסר תיאום של העיניים, שעלולים לגרום לירידה בחדות ראייה. המחלה מתאפיינת הן בסימנים בולברים והן בסימנים פירמידליים (Pyramidal), הגדלה של כבד וטחול ולעיתים גם אנמיה וירידה ברמת הטסיות. עם זאת, חולים אלה לא סובלים ממחלת העצם האופיינית לגושה מסוג 1 או 3
- מחלת גושה מסוג 3 - בחולים אלה ניכרת מחלה של האיברים הפנימיים (הגדלת כבד ו/או טחול) הדומה לזו המופיעה בחולים מסוג 1 (כולל מחלת עצם), ואכן הם לעיתים מאובחנים כסובלים מסוג 1, כאשר ההתבטאות העצבית מופיעה רק בהמשך חייהם.
אבחנה
ערך מורחב – גלוקו-פסיכוזין - Glucopsychosine
אבחנת המחלה פשוטה ומבוצעת על ידי בדיקת דם הבודקת את פעילות האנזים בלויקוציטים (White blood cells)[7]. בדיקה זו ניתן לבצע גם באמצעות דם יבש על ניירות גוטרי ( Guthrie card, dry blood spots)[12]. עם זאת, בדיקת דם אינה יעילה לאבחון נשאות, שאותה ניתן לבדוק רק באמצעות בדיקה גנטית[1]. ביופסיית מח עצם אינה נדרשת לצורך אבחנה.
על אף שיעור שכיחות גבוה יחסית באוכלוסייה יהודית אשכנזית, ומודעות גבוהה בקרב הקהילה הרפואית בישראל, קיימים עדיין מקרים של אבחון מאוחר. כך, ניתן למצוא חולים שסבלו מתסמיני המחלה שנים טרם אובחנו. במחקר שבחן מודעות למחלת גושה בקרב המטולוגים, נמצא כי עשרים אחוזים בלבד מההמטולוגים העלו את מחלת גושה כאבחנה מבדלת בחולה המתייצג עם ירידה ברמת הטסיות, טחול וכבד מוגדלים וכאבי עצמות. החשד העיקרי היה לוקמיה, לימפומה ומיאלומה נפוצה[13].
משנות האלפיים נוסחו אלגוריתמים אבחנתיים למחלת גושה[14][7], מאמר שפורסם והשתמש באלגוריתם האבחוני במבוגרים, העלה כי ארבעה אחוזים מהחולים המתייצגים עם טחול מוגדל, עם או בלי ירידה ברמת הטסיות, הם למעשה חולי גושה[10]. אוכלוסיית המחקר כללה חולים באיטליה. בישראל, בה שכיחות המחלה גבוהה באופן משמעותי מזו בעולם, עשויים אחוזים אלה להיות גבוהים אף יותר. על כן, יש לשלול מחלת גושה בחולים המופיעים עם טחול מוגדל, עם או בלי ירידה ברמת הטסיות, במקביל לשלילת מחלות כמו ממאירויות המטולוגיות, טלסמיה (Thalassemia), אנמיה המוליטית (Hemolytic anemia), Immune Thrombocytopenic Purpura (ITP), ויתר לחץ דם פורטלי (Portal hypertension).
מעבר לתסמינים שתוארו בתמונה מספר 2, ניתן למצוא סימנים מחשידים לגושה גם בבדיקות הדם. מרבית החולים יבטאו ערכים גבוהים של Angiotensin converting enzyme (ACE), עלייה בפריטין (Ferritin) ורמות נמוכות של כולסטרול HDL (High-Density Lipoprotein) [15].
לרופא המשפחה ולהמטולוג תפקיד חשוב בהעלאת החשד הראשוני.
טיפול
קיימות שתי אפשרויות טיפול במחלת גושה, המבוססות על שני מנגנונים שונים: טיפול באנזים חליפי או טיפול במעכב סובסטרט (Substrate).
הטיפול באנזים חליפי - קיים באופן מסחרי משנת 1991 והוכיח עצמו כטיפול יעיל ובטוח מזה 30 שנה. טיפול באנזים חליפי מסוג Cerezyme (Imiglucerase) היה הראשון שאושר לטיפול.
הטיפול באנזים חליפי מתבצע דרך עירוי, אחת לשבועיים, וניתן לקבלו במסגרת טיפולי בית. האנזים החליפי מגיע באופן סלקטיבי לליזוזום, בו נאגר ה-Glucocerebroside, ובכך מונע את רוב סיבוכי המחלה[16][17].
בין השנים 2010 ל-2015 נוספו ל-Cerezyme שני אנזימים: Vpriv (Velaglucerase alfa) ו-Elelyso (Taliglucerase alfa). בשלושת הטיפולים מותאם המינון לחולה תוך בחינה מתמדת של עצירת ההידרדרות ושיפור המדדים ההמטולוגיים, הגרמיים ואלה הקשורים לאברים פנימיים. בישראל ממומן הטיפול באנזים חליפי על-ידי משרד הבריאות. מטרת הטיפול, בין היתר, היא למנוע נזקים בלתי הפיכים ולכן ישנה חשיבות רבה לאבחון מוקדם.
כניסתו לשוק של הטיפול באנזים חליפי Cerezyme היוותה פריצת דרך מדעית ששינתה את פני המחלה; הטיפול מנע את הצורך בכריתת טחול והפך את מחלת גושה ממחלה יתומה (Orphan disease) לכזו שניתן לחיות עימה.
בשנת 2021 התפרסם בעיתונות המדעית תוצאות מחקר חדש על 20 שנות יעילות הטיפול ב-Cerezyme מתוך מאגר הנתונים הגדול בעולם בחולי גושה, ה- ICGG (The International Collaborative Gaucher Group). מאגר נתונים זה מאגד בתוכו נתונים מקיפים על מהלך המחלה והטיפולים בה עם יותר מ־6,000 חולי גושה מ-60 מדינות שונות, בהן גם ישראל. במחקר זה דווח כי היעילות שהושגה בתחילת הטיפול השתפרה ונשמרה למשך 10 שנים ו- 20 שנות מעקב.
מן המידע שהצטבר במעל 20 שנות טיפול ב-Cerezyme, נראה כי מרבית התסמינים משתפרים באופן משמעותי ואף נמנעים תחת הטיפול באנזים זה[18]. כך, בחולים המטופלים ב-Cerezyme, הודגמו הקטנה של הכבד והטחול, שיפור (לעיתים עד חזרה לתקין) בספירת דם, במסת העצם במבוגרים ובילדים, בגדילה בילדים ובתיקון גיל העצמות. מטופלים אלה מפסיקים לסבול מנטייה לדמם ומהתקפים חריפים של כאבי עצמות (אם היו), על אף שכאבי עצמות עשויים להמשיך. התוצאה החשובה ביותר היא שלרוב לא מופיעים שברים חדשים וכך נמנע נזק בלתי הפיך לעצמות. עם זאת, נזק קיים, כגון תמט של ראש הפמור או שברים בחוליות, הוא בלתי הפיך ולא צפוי להיעלם בזכות הטיפול התרופתי. לכן, קיים עדיין צורך בהתערבות אורתופדית בחולים שלא זכו לקבל טיפול אנזימטי בזמן ופיתחו סיבוכים אלה. פרט ליעילות מרשימה, יש לציין את רמת הבטיחות הגבוהה, את מיעוט תופעות הלוואי המשמעותיות ואת האפשרות לקבל את הטיפול בבית. כמו-כן, הפרופיל הבטיחותי מאפשר לנשים בגיל הפוריות לקבל את הטיפול במהלך הריון והנקה, ולעיתים הוא אף מומלץ למניעת סיבוכים מילדותיים.
עבודה המסכמת 8 שנות מעקב אחר חולים המטופלים ב-velaglucerase ב- "real life" ומבוססת על מאגר הGOS פורסמה ב-2019, גם כאן נצפתה עלייה משמעותית במספר הטסיות וברמות ההמוגלובין וירידה משמעותית בנפח הכבד והטחול וברמות ביומרקרים של גושה. כמו כן דווח על פרופיל בטיחות גבוה[19].
בשנת 2018 פורסם מאמר המסכם מעקב של 5 שנים אחר חולים המטופלים ב-taliglucerase. גם כאן הוכחה יעילות עם שיפור בספירת הדם ובנפח הכבד והטחול וכן בביומרקרים של מחלת הגושה בדומה לאנזימים המקבילים[20].
הטיפול במעכב סובסטרט – טיפול פומי שמטרתו להפחית את כמות ה-Glucocerebroside (או הסובסטרט) הנוצרת בגוף. באופן זה, רמת הפעילות הנמוכה של האנזים המוטנטי במחלת גושה (Glucocerebrosidase), מספיקה כדי לפרק את מעט הסובסטרט (ה-Glucocerebroside) שנוצר בגוף החולה. הטיפול מתבסס על אנלוג (Analog) לא-פעיל של אחד ממרכיבי הסובסטרט, שמתחרה על האנזים המייצר את הסובסטרט ובכך מפחית את כמות ה-Glucocerebroside, המורכב, כאמור, מ-Glucose ו-Ceramide.
בשנת 2014 אושר לשימוש מעכב הסובסטרט Cerdelga (Eliglustat), שהוא אנלוג של Ceramide והתרופה הפומית היחידה בעולם המאושרת לטיפול כקו ראשון במחלת הגושה וזמינה בסל הבריאות משנת 2017.
תוכנית הפיתוח של Cerdelga כללה ארבעה מחקרים בינלאומיים ב־29 מדינות, כולל בישראל[21][17][22][23]. בסה"כ נכללו בתוכנית זו 393 חולי גושה מסוג 1 המבטאים תסמינים בינוניים או קשים של המחלה. מחקרים אלו הוכיחו את יעילותה ובטיחותה של Cerdelga, הן בחולים נאיבים והן בחולים שטופלו באנזים חליפי (ERT) והראו כי טיפול זה הביא לשיפור במדדים המטולוגים, נפח הטחול והכבד, שיפור במדדי העצם וברמות הביומרקרים השונים. יעילות זאת נשמרה לאורך 8 שנים[24].
כמו כן, תוצאות השימוש ב-Cerdelga בעולם האמיתי שנלקחו מתוך רשם נתוני גושה העולמי (ICGG) הראו יעילות עקבית למחקרים הקליניים בכל דרגות החומרה של המחלה[25].
בעבר אושר מעכב הסובסטרט Zavesca (Miglustat), שהוא אנלוג של Glucose. עם זאת, פרופיל הבטיחות שלו לא היה מספק ועל כן כמעט ואינו נמצא בשימוש בישראל בהתוויה זו, ושימושו בעולם מועט ביותר.
טיפולים תסמיניים שאינם ספציפיים לגושה - חולי גושה סובלים ממחלת עצם הנובעת מהסננת מח העצם ב"תאי גושה". ניתן לטפל ב-Osteoporosis שנוצרת באמצעות מתן Bisphosphonates. טיפול בהתקף חריף של כאבי עצמות חייב לכלול, בנוסף לאנזים החליפי, מינונים גבוהים של סטרואידים (Steroids) המפחיתים מיידית את הכאב. טיפול זה יכול למנוע שבועות של אשפוז המתאפיין בכאב בלתי נסבל העמיד אפילו לטיפול ב-Morphine[26]. התאוריה גורסת כי סטרואידים מפחיתים את הבצקת שמתחת לפריאוסט (Periosteum) ובכך משפרים משמעותית ומיידית את הכאב החריף בעצמות.
לרופא המשפחה תפקיד חשוב בניהול המעקב התקופתי של חולי הגושה; עליו לשמור על קשר עם מרפאת הגושה ולדאוג שהחולה יבקר בה לפחות פעם בשנה לצורך הערכת מחלתו, ובאם הוא מטופל באנזים חליפי, לצורך הערכה של הגעה ליעד טיפולי. קשר זה מאפשר מתן טיפול מיטבי.
- מרכזי טיפול בישראל
לאור השכיחות הגבוהה של מחלת הגושה בקרב יהודים אשכנזים, קיימים בארץ מספר מרכזים המטפלים בחולי הגושה: ארבעה מהם בבתי חולים (בילינסון, רמב"ם, איכילוב ושערי צדק), לצד מרפאת גושה נוספת בצפון המטפלת במטופלים של קופות החולים כללית ומכבי. במרכזים אלה עובדים רופאים המתמחים באבחון ובטיפול בחולי גושה מכל רחבי הארץ.
פרוגנוזה
הפרוגנוזה במחלת גושה שונה עבור כל תת-סוג (ראו קליניקה).
דגלים אדומים
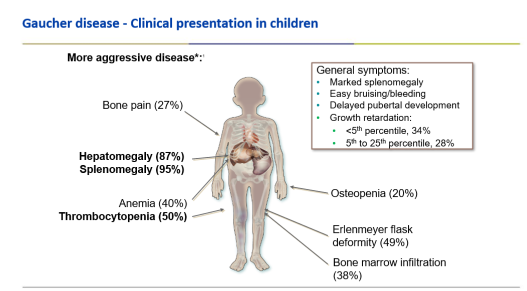
התסמינים האופייניים של מחלת גושה מסוג 1 משתנים מאדם לאדם. חלקם לא יבטאו תסמינים כלל ואצל אחרים עלולים להופיע: ספירה נמוכה של טסיות (טרומבוציטופניה) וכתוצאה מכך נטייה לדמם, הגדלה של הכבד והטחול וכתוצאה מכך: תשישות, אנמיה ובטן תפוחה ותסמיני עצם שונים כולל כאבי עצמות. בילדים, בנוסף לתסמינים אלה, החולים יסבלו לעיתים מעיכוב גדילה ועיכוב התפתחותי[27][28].
במקרה של חשד חשוב לפנות לרופא המטפל על מנת לאבחן או לשלול את מחלת הגושה.
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 Baris HN, Cohen IJ, Mistry PK. Gaucher disease: the metabolic defect, pathophysiology, phenotypes and natural history. Pediatr Endocrinol Rev. 2014;12 Suppl 1:72-81
- ↑ Hughes D, Cappellini MD, Berger M, Van Droogenbroeck J, de Fost M, Janic D, Marinakis T, Rosenbaum H, Villarubia J, Zhukovskaya E, Hollak C. Recommendations for the management of the haematological and onco-haematological aspects of Gaucher disease. Br J Haematol. 2007;138(6):676-86.
- ↑ Goker-Alpan O. Parkinsonism among Gaucher disease carriers. J Med Genet. 2004;41(12):937–40.
- ↑ Sidransky E, Lopez G. The link between the GBA gene and parkinsonism. Lancet Neurol. 2012;11(11):986–98.
- ↑ Gan-Or Z, Giladi N, Rozovski U, Shifrin C, Rosner S, Gurevich T, et al. Genotype-phenotype correlations between GBA mutations and Parkinson disease risk and onset. Neurology. 2008;70(24):2277–83. Behl, T., Kaur, G., Fratila, O. et al. Cross-talks among GBA mutations, glucocerebrosidase, and α-synuclein in GBA-associated Parkinson’s disease and their targeted therapeutic approaches: a comprehensive review. Transl Neurodegener 10, 4 (2021). https://doi.org/10.1186/s40035-020-00226-x
- ↑ Pastores GM, Hughes DA. Gaucher Disease. In: Pagon RA, Bird TD, Dolan CR, Stephens K, editors. GeneReviews [Internet]. Seattle (WA): University of Washington, Seattle; 1993-. 2000 Jul 27 [updated 2011 Feb 01].
- ↑ 7.0 7.1 7.2 Mistry PK1, Cappellini MD, Lukina E, Ozsan H, Mach Pascual S, Rosenbaum H, Helena Solano M, Spigelman Z, Villarrubia J, Watman NP, Massenkeil G. A reappraisal of Gaucher disease-diagnosis and disease management algorithms. Am J Hematol. 2011;86(1):110-5.
- ↑ 8.0 8.1 Tylki-Szymańska A1, Vellodi A, El-Beshlawy A, Cole JA, Kolodny E. Neuronopathic Gaucher disease: demographic and clinical features of 131 patients enrolled in the International Collaborative Gaucher Group Neurological Outcomes Subregistry.J Inherit Metab Dis. 2010;33(4):339-46.
- ↑ Horowitz M1, Pasmanik-Chor M, Borochowitz Z, Falik-Zaccai T, Heldmann K, Carmi R, Parvari R, Beit-Or H, Goldman B, Peleg L, Levy-Lahad E, Renbaum P, Legum S, Shomrat R, Yeger H, Benbenisti D, Navon R, Dror V, Shohat M, Magal N, Navot N, Eyal N. Prevalence of glucocerebrosidase mutations in the Israeli Ashkenazi Jewish population. Hum Mutat. 1998;12(4):240-4.
- ↑ 10.0 10.1 Motta I1,2, Filocamo M3, Poggiali E1,2, Stroppiano M3, Dragani A4, Consonni D5, Barcellini W6, Gaidano G7, Facchini L8, Specchia G9, Cappellini MD1,2; Splenomegaly Gaucher Disease study group. A multicentre observational study for early diagnosis of Gaucher disease in patients with Splenomegaly and/or Thrombocytopenia. Eur J Haematol. 2015
- ↑ Taddei TH, Kacena KA, Yang M, Yang R, Malhotra A, Boxer M, Aleck KA, Rennert G, Pastores GM, Mistry PK. The underrecognized progressive nature of N370S Gaucher disease and assessment of cancer risk in 403 patients. Am J Hematol. 2009;84(4):208-14.
- ↑ Legnini E1, Orsini JJ, Hung C, Martin M, Showers A, Scarpa M, Zhang XK, Keutzer J, Mühl A, Bodamer OA. Analysis of glucocerebrosidase activity in dry blood spots using tandem mass spectrometry. Clin Chim Acta. 2011 30; 412(3-4):343-6.
- ↑ Mistry PK1, Sadan S, Yang R, Yee J, Yang M. Consequences of diagnostic delays in type 1 Gaucher disease: the need for greater awareness among hematologists-oncologists and an opportunity for early diagnosis and intervention. Am J Hematol. 2007;82(8):697-701.
- ↑ Di Rocco M, Andria G, Deodato F, Giona F, Micalizzi C, Pession A. Early diagnosis of Gaucher disease in pediatric patients: proposal for a diagnostic algorithm. Pediatr Blood Cancer. 2014 Nov;61(11):1905-9.
- ↑ Thomas AS1, Mehta AB, Hughes DA. Diagnosing Gaucher disease: an on-going need for increased awareness amongst haematologists. Blood Cells Mol Dis. 2013;50(3):212-7.
- ↑ Weinreb NJ, Camelo JS Jr, Charrow J, et al. Gaucher disease type 1 patients from the ICGG Gaucher Registry sustain initial clinical improvements during twenty years of imiglucerase treatment. Mol Genet Metab. 2021;132(2):100-111. doi:10.1016/j.ymgme.2020.12.295
- ↑ 17.0 17.1 Mistry PK.et al Clinical outcomes after 4.5 years of eliglustat therapy for Gaucher disease type 1: Phase 3 ENGAGE trial final results. AM J Hematol 2021 96(9):1156-1165
- ↑ Weinreb NJ, Goldblatt J, Villalobos J, Charrow J, Cole JA, Kerstenetzky M, vom Dahl S, Hollak C. Long-term clinical outcomes in type 1 Gaucher disease following 10 years of imiglucerase treatment. J Inherit Metab Dis. 2013 May;36(3):543-53.
- ↑ Long-term analysis of velaglucerase alfa-treated patients with Gaucher disease who entered the Gaucher Outcomes Survey (GOS) real-life registry; Heather Lau et al, https://doi.org/10.1016/j.ymgme.2018.12.225
- ↑ Long-term efficacy and safety results of taliglucerase alfa through 5years in adult treatment-naïve patients with Gaucher disease Ari Zimran et al. PMID: 27499018 DOI: 10.1016/j.bcmd.2016.07.002
- ↑ Mistry PK. et al, Effect of oral eliglustat on splenomegaly in patients with Gaucher disease type 1: the ENGAGE randomized clinical trial. JAMA. 2015 17;313(7):695-706.
- ↑ Cox TM. et al ,Eliglustat compared with imiglucerase in patients with Gaucher's disease type 1 stabilised on enzyme replacement therapy: a phase 3, randomised, open-label, non-inferiority trial. Lancet. 2015 13;385(9985):2355-62
- ↑ Cox TM. Et al, Eliglustat maintains long-term clinical stability in patients with Gaucher disease type 1 stabilized on enzyme therapy Blood. 2017 Apr 27;129(17):2375-2383
- ↑ Lukina et al, Outcomes after 8 years of eliglustat therapy for Gaucher disease type 1: Final results from the Phase 2 trial, Am J Hematol. 2018;1–10.
- ↑ Mistry et al, Real‐world effectiveness of eliglustat in treatment‐naïve and switch patients enrolled in the International Collaborative Gaucher Group Gaucher Registry, Am J Hematol. 2020;1–9
- ↑ Cohen IJ.Re: The effect of enzyme replacement therapy on bone crisis and bone pain in patients with type 1 Gaucher disease. Clin Genet. 2007;72(2):160
- ↑ Kaplan P., et al. The Clinical and Demographic Characteristics of Nonneuronopathic Gaucher Disease in 887 Children at Diagnosis. Arch Pediatr Adolesc Med. 2006;160:603-608
- ↑ . Charrow J, Andersson HC, Kaplan P, Kolodny EH, Mistry P, Pastores G, Rosenbloom BE, Scott CR, Wappner RS, Weinreb NJ, Zimran A. The Gaucher registry: demographics and disease characteristics of 1698 patients with Gaucher disease. Arch Intern Med. 2000 Oct 9; 160(18):2835-43
קישורים חיצוניים
- מחלת גושה בילדים בישראל, מדיקל מדיה
- מחלת גושה, האבחון והטיפול בה
המידע שבדף זה נכתב על ידי פרופ' איין כהן - מרפאת גושה, המכון הגנטי ע"ש רקאנטי, המרכז הרפואי בילינסון, ד"ר נועה רורמן שחר - מומחית ברפואה פנימית ובגנטיקה רפואית, מנהלת מרפאת גושה, מכון רפאל רקנאטי לגנטיקה, בי"ח בילינסון, מרכז רפואי רבין


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק