תסמונת גדילת יתר - Overgrowth syndrome
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונuת גדילת יתר | ||
|---|---|---|
| Overgrowth syndromes | ||
| 250px | ||
סינדרום Sotos
| ||
| יוצר הערך | ד"ר חנה וינקלר, ד"ר עמיהוד זינגר 
|
|
תסמונות של גדילת יתר בילדים הן קבוצה לא אחידה ומגוונת של מצבים המאופיינים בגדילה של איברי גוף או בגדילה כללית מעל 2 סטיות תקן לגיל. קבוצת המחלות הקשורה בגדילת יתר מגוונת הן מבחינת המעורבות הנוספת של מערכות גוף פגועות והן מבחינה הגנים המעורבים. עם ההתקדמות בתחום הגנטי וגילוי הגנים השונים ניתנת כיום האפשרות לאישור מדויק כאשר קיים חשד קליני לאחת התסמונות. הבנת התהליכים הגנטיים והביולוגיים המשפיעים על התמונה הקלינית, היא כל העת גורם לשינוי בגישה למטופלים. ייתכן כי בעתיד הבנה זו תאפשר מתן טיפולים גנטיים או רפואיים טובים יותר למטופלים אלה.
אפידמיולוגיה
אטיולוגיה
הגדילה לגובה היא תהליך מורכב התלוי בגורמים גנטיים, תזונתיים, הורמונליים וסביבתיים (כמו מחלות מתמשכות, טיפולי קרינה וכד'). שינוי באחד הגורמים המשפיעים על הגדילה, עלול לגרום האטה בגדילה וקומה נמוכה. נדיר יותר ששינוי כזה יגרום גדילה מואצת. זיהוי של מצבים של גדילה מואצת חשוב לא פחות מזיהוי של מצבים של האטה בגדילה, כי הוא קשור לעתים קרובות במעורבות של מערכות גוף שונות, ומחייב התייחסות טיפולית וייעוץ מתאים של הרופא המטפל בנוגע לפרוגנוזה ולהשלכות על המשפחה.
בעשור האחרון הצטבר מידע המאפשר לנו לזהות את הגורמים הגנטיים לחלק מהמצבים של גדילת יתר. מידע זה נותן בידינו כלים אבחנתיים מצד אחד ומאפשר הבנה מעמיקה יותר של התהליכים העומדים בבסיס הפתולוגי של מצבים אלה, מצד שני. אין ספק, שהבנת התהליכים האלה תאפשר, בסופו של דבר, טיפול טוב יותר במטופלים. למשל, הומוציסטינוריה (Homocystinuria) היא מחלה נסגנית (Recessive) הנגרמת בשל חסר אנזימטי של ציסטתיון בתא סינתאז (Cystathionin beta-synthase) וקשורה בקומה גבוהה ובמראה מרפנואידי (Marphanoid) (וכן במעורבות רב מערכתית). לאחרונה נמצא כי עלייה ברמת הומוציסטאין אצל מטופלים עם הומוציסטינוריה גורמת חיזור של קשרי דיסולפיד באזור ה-cbEGF של הגן פיברילין 1 (Fibrillin 1) הקשור בתסמונת מרפן. לנוכח ההבנה של התהליכים המולקולריים במחלה זו, קיימות אפשרויות טיפוליות הכוללות מתן Betaine, מתן פירידוקסין (ויטמין B6) והגבלת כמות המתיונין (Methionine) בדיאטה. בעבודה מבוקרת נמצא הבדל בגובה הממוצע בין הילדים המטפולים לאלה שאינם מטופלים .
גילוי הבסיס הגנטי של התסמונות השונות מקנה הבנה טובה יותר של התהליכים הביולוגיים התורמים לגדילה התקינה והבלתי תקינה של השלד, מאפשר מעקב נכון ולעתים גם טיפולים מתאימים יותר למטופלים ומקנה את האפשרות לתת ייעוץ גנטי מדויק למשפחות. לא תמיד האבחון המולקולרי (ברמת הגן) נותן כלים נוחים לסיווג. למשל, מוטציה בגן FGFR3 גורמת, מצד אחד, לסוגים שונים של גמדות/קומה נמוכה (Achondroplasia או Hypochondroplasia) ומצד שני, מוטציה באותו גן באזור שונה ובמנגנון אחר גורמת לתסמונת גדילת יתר CATSHL (Camptodactyly, Tall stature, and Hearing Loss). כמו כן, לעתים יש יותר מגן אחד הגורם לאותו חזותי (Phenotype), מצב המוכר כאי אחידות גנטית. למשל, תסמונת מרפן יכולה להיות קשורה בגן FBN1, אבל גם בגנים TGFBR2 ו-TGFBR1.
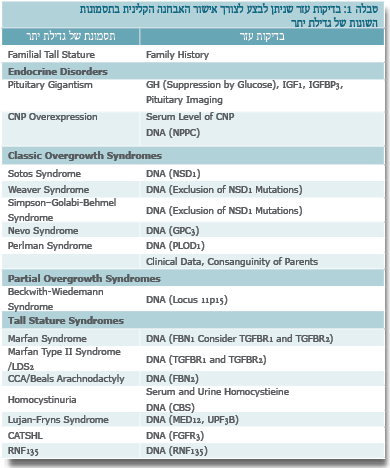
יש מקום לחשוב על בעיות אנדוקריניות באבחנה מבדלת של קומה גבוהה וגדילה מואצת. בנוסף, עוברים או תינוקות גדולים נולדים לאם סוכרתית לא מאוזנת במהלך ההיריון.
קליניקה
ילדים אשר להם תסמונת של גדילת יתר, יכולים להיות גדולים במשקל, בגובה ובהיקף ראש (או בחלק מהמדדים האלה) עוד בחיים התוך-רחמיים ומיד לאחר הלידה או שהם נולדים עם מדדי גדילה תקינים וחוצים את עקומות הגדילה הרגילות בחודשים הראשונים לחייהם.
התסמונות הקשורות בגדילת יתר, המוכרות לנו כיום, מאופיינות במעורבות רב מערכתית הכוללת לעתים גם סיכון יתר לגידולים שונים ולעתים קשורה בבעיות קוגניטיביות שונות. חשוב להכיר את התסמונות השונות כדי לאפשר לילדים אלה מעקב נכון וטיפולים במסגרות מתאימות, כדי לתת ייעוץ גנטי למשפחה בנוגע להריונות נוספים בעתיד וכן כדי לתת הסבר למטפלים ולמשפחות לגבי הפרוגנוזה של המצבים השונים. בחלק גדול של המצבים הגורם ידוע, וניתן לאשר את האבחנה באמצעות בדיקות.
ישנם בנוסף מצבים הקשורים בענקות ראש (Macrocephaly) כממצא עיקרי ותסמונות הנובעות משינויים כרומוזומליים, כגון: תסמונת קליינפלטר או תסמונת הקשורה בקריוטיפ 47 ,תסמונת ה-X המשולש.
אבחנה
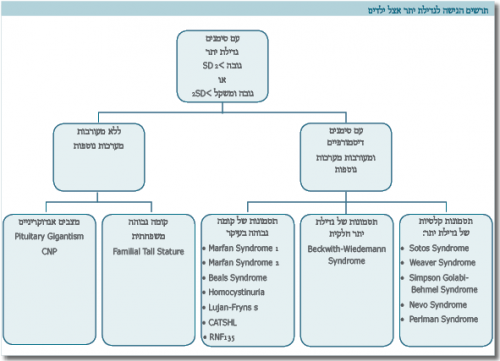
האבחנה ההתחלתית נקבעת על סמך מדידות האורך בעת ההיריון או מדידות הגובה לאחר הלידה. אנחנו מגדירים קומה גבוהה כאשר התוצאה המתקבלת היא מעל 2 סטיות תקן, לגיל, למין ולמוצא האתני. בהיעדר סימנים לשינויים מבניים (Dysmorphic) ומעורבות של מערכות אחרות זולת השלד, יש לשלול תבנית משפחתית. בעת הבדיקה יש למדוד משקל, היקף ראש, לציין סימנים של שינויים מבניים ולבחון מעורבות של מערכות נוספות, כמו: עיניים, לב, טחול, כבד, כליות ומערכת השתן, מערכת העצבים (בעיות התפתחות). כמו כן, יש לשקול ביצוע בירור של המערכת ההורמונלית לשלילת מצבים אנדוקריניים נדירים (טבלה 1).
טיפול
חשוב להדגיש את המעקבים הנדרשים והטיפולים הקיימים במצבים השונים כיום, הדורשים התייחסות של הרופא המטפל וההתייחסות לייעוץ הגנטי בהתאם לאופן ההורשה והמנגנון הגנטי בבסיס המחלות השונות.
פרוגנוזה
תסמונות הקשורות בקומה גבוהה
;תסמונת MFS (Marfan)
{{הפניה לערך מורחב|ערך=תסמונת מרפן - Marfan syndrome
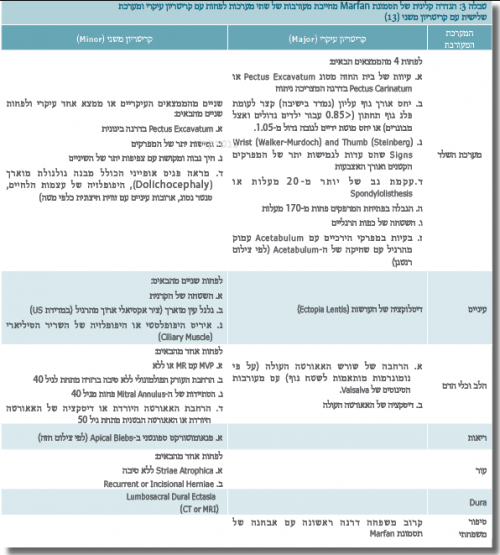
תסמונת Marfan (MIM 154700) היא תסמונת גנטית המועברת בתורשה אוטוזומלית דומיננטית (AD). שכיחותה באוכלוסייה הכללית היא 1:5,000-10,000. רק ברבע מהמקרים (25%) לא קיים סיפור משפחתי ואז מדובר במוטציה חדשה (de novo) שמעתה תעבור הלאה בתורשה האופיינית (AD). הלוקים בתסמונת הם ברוב המקרים בעלי קומה גבוהה עם אורך גפיים חריג ביחס לשלד (Dolichostenomelia). במעקבי גדילה רובם הגדול יימצא סביב אחוזון 95 ואילך. כיום, מתבצעת האבחנה הקלינית לפי הקריטריונים שנקבעו ע"י הקבוצה הבלגית, De Paepe et al., בשנת 1996 (טבלה 3). הקריטריונים נקבעו כדי להגיע לדיוק באבחון הקליני, כך שלא כל פרט גבוה בעל מבנה פנים מוארך ו/או מוטת ידיים גדולה (Marfan Habitus) יקבל את האבחון הקליני כלוקה בתסמונת. הגן לתסמונת מופה והוא נמצא על כרומוזום 15, סימונו FBN1 והוא מקודד לחלבון 1 Fibrillin. במצב תקין החלבון נמצא בחומר החוץ-תאי, והוא מהווה מרכיב חשוב במבנה המכונה Microfibrils.
מבנה זה נמצא ברקמות שונות בגוף ולו תפקידים חשובים ביצירה ובהומאוסטזיס (Homeostasis) של החומר האלסטי, בחיבור בין התא לחומר החוץ-תאי וברגולציה של פקטורי גדילה (Growth Factors) שונים. מוטציות בגן גורמות ליצירת תוצר (=חלבון) לא תקין אשר מתערב עם התוצר (=חלבון) התקין שנוצר בהשראת הגן השני התקין, ובמנגנון המכונה Dominant Negative מפריע ליצירה תקינה של ה-Microfibrils. עבודות שונות הראו במקביל כי לחולי מרפן גם כמות מופחתת של רקמת חיבור, ויש הטוענים כי הדבר נובע מחשיפת יתר של הרקמה הלא תקינה לפרוטאוליזה. יש לציין כי הדבר לא מסביר את מנגנון גדילת היתר בחולי מרפן. לאחרונה דווח על אינטראקציה בין פיברילין לפקטור הגדילה TGF-β, ומוטציות בגן המקודד לרצפטור של TGF-β TGFBR2 נמצאו כגורמות לתסמונת Marfan Type II) MFS II), תסמונת הדומה למרפן ללא Ectopia Lentis ומינימום או היעדר עירוב של מבנה השלד החריג ביחס לגפיים - Dolichostenomelia.
תסמונת ע"ש Loeys-Dietz
תסמונת נדירה אשר כיום מוכרים בה 2 סוגים עיקריים: LDS (Loeys-Dietz) Type I, II, המועברים בתורשה אוטוזומלית דומיננטית (AD). המערכות העיקריות המעורבות בחולי LDS הן:
- המערכת הווסקולרית - הרחבה או דיסקציה של שורש האאורטה (95% מהמקרים). אנוריזמות או פיתול (Tortuosity) של כלי הדם העורקיים באזורי גוף שונים.
- מערכת השלד, כגון: עקמת, מבנה לא תקין של בית החזה, ארכנודקטלי וכד'.# גולגולת/פנים - היפרטלוריזם, חייך שסוע או ענבל מפוצל (Bifid Uvula), תפרים לא תקינים בגולגולת (Craniosynostosis).
- העור - עור דק/שקוף, ניזוק בקלות, צלקות לא תקינות.
ב-2 הסוגים אופייני למצוא פגיעה במערכת הווסקולרית ובשלד. ב-LDS1 אופייני נוסף על כל אלה, עירוב של גולגולת/פנים, ואילו ב-LDS2 עירוב של העור.
בשנים האחרונות התברר כי הסיבה לתסמונות הן מוטציות בגנים TGFBR2 ו-1 TGFBR (Transforming Growth Factor ß Receptor) הנמצאים על כרומוזום 9q ו-3p בהתאמה.
תסמונת LDS2 דומה בחלק מהמאפיינים הקליניים שלה לתסמונת Marfan ונקראת גם Marfan Type II. בספרות קיימים דיווחים על חולים שענו לקריטריונים של תסמונת מרפן, אולם לא נמצאו נושאים מוטציה בגן FBN1, ובבדיקה נמצאה אצלם מוטציה בגן TGFBR2.
תסמונת CCA (Congenital contractural arachnodactyly) (Beals Syndrome)
תסמונת CCA (MIM 121050) העוברת בתורשה אוטוזומלית דומיננטית, מתאפיינת בקומה גבוהה, קונטרוקטורות מהלידה (בברכיים, במרפקים ובאצבעות) אצבעות ארוכות, היפוטוניה, קיפוסקוליוזיס מתקדמת ומבנה לא תקין של אפרכסות האוזניים (Crumpled Ears). בצורתה הקלסית התסמונת אינה כוללת מעורבת של המערכת הקרדיו-וסקולרית, אולם תוארו מספר מקרים של חולים עם CCA אשר נמצאה אצלם הרחבה של שורש האאורטה.
הגן המעורב בתסמונת זו הוא FBN2 המקודד לחלבון Fibrillin 2 אשר נמצא על הזרוע הארוכה של כרומוזום 5. מנגנון הפגיעה ברקמת החיבור דומה לזה של FBN1. ההנחה היא כי הביטוי הפנוטיפי שונה בשל עיתוי שונה של התבטאות הגן בעת התפתחות העובר והתבטאותו ברקמות שונות מאלה של FBN1.
הומוציסטינוריה
הומוציסטינוריה (MIM 236200) היא תסמונת נדירה העוברת בתורשה אוטוזומלית רצסיבית. היא מאופיינת בקומה גבוהה מעל אחוזון 95, אוסטאופורוזיס, סקוליוזיס, מעורבות של העיניים Ectopia Lentis) וקוצר ראייה) מעורבות של כלי דם (Livido Reticularis) וכן מעורבות נוירולוגית הכוללת פיגור שכלי ומחלות פסיכיאטריות.
התסמונת נגרמת ממוטציות בגן המקודד לאנזים Cystathionine Beta-Synthase. בשל ירידה בפעילות האנזים, נמצא בבדיקת דם רמות גבוהות מאוד של הומוציסטאין ומתיונין ורמות נמוכות של Cysteine ו-Cystathinine. כפי שכבר תיארנו, ניתן לטפל בחלק מהתופעות של המחלה באמצעות תרופות. גם במחלה זו נמצא קשר לתסמונת Marfan - הרמות הגבוהות של הומוציסטאין גורמות חיזור של גשרי דיסולפיד על החלבון פיברילין ומשנה את המבנה שלו, ובשל כך משנות גם את תפקודו.
תסמונות נדירות יותר
תסמונת LFS (Lujan-Fryns)
תסמונת LFS (MIM 309520) היא נדירה המועברת בתאחיזה לכרומוזום X. התסמונת כוללת קומה גבוהה, אצבעות ארוכות וגמישות יתר של המפרקים הקטנים ומבנה מרפנואידי המופיע לאחר גיל ההתבגרות. בשונה מתסמונת Marfan לחולים אלו פיגור שכלי. לאחרונה ידוע על שני גנים הקשורים בתסמונת: MED12 ו-UPF3B. ביטוי יתר של הגן NPPC (Natriuretic Peptide Precursor C) מדובר במצב נדיר אשר תואר בחולים בודדים בעולם. הביטוי כולל גדילת יתר לאחר הלידה מעבר לשתי סטיות תקן בגובה, Marfanoid Habitus, סקוליוזיס, אגודלים ארוכים וMetaphyseal-Epiphyseal Dysplasia. הגן מקודד לחלבון שלו תפקיד בבקרה על גדילה של העצמות, ולכן מוטציה בו גורמת לגדילת יתר.
תסמונת CATSHL
תסמונת CATSHL (MIM 610474) מועברת בתורשה אוטוזומלית דומיננטית. התסמונת כוללת קמפטודקטיליה, קומה גבוהה וליקוי שמיעה סנסורינאורלי. נוסף על כך, לחלק מהחולים פיגור שכלי, מיקרוצפליה ושינוי במבנה בית החזה (Pectus Excavatum). הגורם לתסמונת הוא מוטציה בגן FGFR3 באזור הטירוזין קינז של הרצפטור במנגנון Negative Dominant (הסבר לגבי מנגנון זה ראה בפרק הדן בתסמונת Marfan). מעניין לציין כי לגן זה תפקיד ידוע בגדילה של השלד, ומוטציות שונות באלל זה נותנות תמונה קלינית של גמדות או קומה נמוכה.
RNF135
תסמונת זו (MIM 611358) נדירה ותוארה עד כה בשישה חולים. הגן נמצא על כרומוזום 17. לחולים קומה והיקף ראש מעל הנורמה בשתי סטיות תקן. נוסף על כך, סימנים דיסמורפיים הכוללים מצח רחב, קצה אף רחב, פילטרום ארוך, ארובות עיניים Downslanting, שפה עליונה צרה ושפה תחתונה מלאה. לחלק החולים פיגור שכלי, גיל עצמות מתקדם, בעיות שמיעה וראייה. קיימת חפיפה פנוטיפית עם תסמונת Sotos ועם תסמונת Weaver, אולם לא נמצאה מוטציה בגן NSD1 בחולים אלו. תפקיד הגן אינו ידוע.
סיכום
דגלים אדומים
ביבליוגרפיה
קישורים חיצוניים
- תסמונות של גדילת יתר, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר חנה וינקלר, ד"ר עמיהוד זינגר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק