אוקסי-סטרול - Oxysterol
| מדריך בדיקות מעבדה | |
| אוקסי-סטרול | |
|---|---|
| Oxysterol | |
| מעבדה | כימיה בדם וכימיה ב-CSF. |
| תחום | נגזרות כולסטרול במחלות שונות. |
| יוצר הערך | פרופ' בן-עמי סלע |
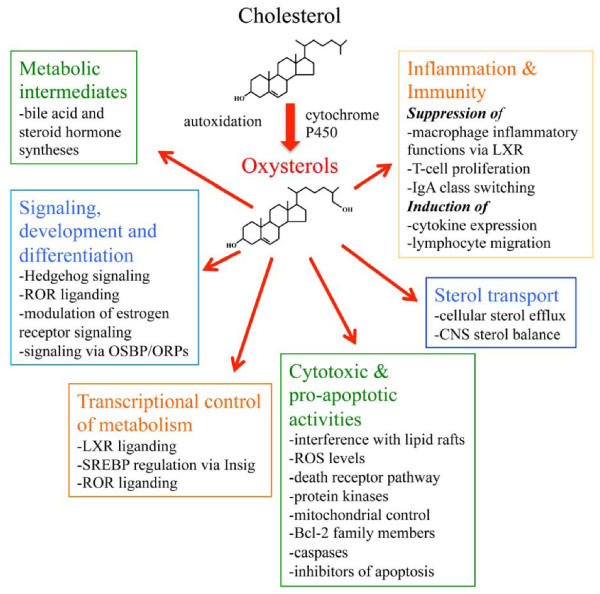
Oxysterol היא נגזרת של כולסטרול המושגת על ידי חמצון הכרוך באנזימים או ב־pro-oxidants בתהליכים רדיקליים. חומרים אלה הם בעלי תפקידים חשובים בתהליכים ביולוגיים שונים כגון הומאוסטאזיס של כולסטרול, מטבוליזם של ליפידים (כגון ספינגוליפידים וחומצות שומן), אפופטוזיס, אוטופגיה, ופרנילציה של חלבונים. צורת הפעולה של אוקסי-סטרולים בהשפעות אלו עדיין לא ברורה בשלמותה. מספר אוקסי-סטרולים כרוכים במחלות של הגיל המתקדם כגון מחלות קרדיו-וסקולריות, מחלות עיניים (כגון ירוד, וניוון המקולה התלוי בגיל (ARMD), במחלות נוירו-דגנרטיביות וסרטן (Samadi ב-Curr Med Chem משנת 2021). הפעילויות של אוקסי-סטרולים במחלות אלו יכולות להתרחש כתוצאה מהפעילות מקדמת החמצון ותומכת הדלקת שלהם, ויכולתם לפעול על אברונים תאיים כגון מיטוכונדריה, פראוקסיזומים וליזוזום, שיכולים לתרום לשפעול של אפופטוזיס ואוטופגיה. יש אף תמיכה בכל שאוקסי-סטרולים הם בעלי תפקיד חשוב בהתפתחות טרשת עורקים ובמחלה קרדיו-וסקולרית (Schroepfer ב־Physiol Rev משנת 2000, ו-Björkhem ו-Diczfalusy ב־Arterioscl Thromb Vasc Biol משנת 2002).
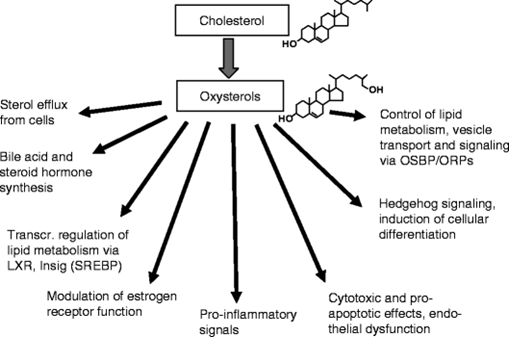
אוקסי-סטרולים נכללים במשפחה גדולה של ליפידים (osysterome) וכרוכים בתהליכים פיזיולוגיים רבים, תוך שהם פועלים דרך קולטנים הקשורים לחלבוני G (כגון EBI2, SMO ו-CXCR2), דרך קולטנים של גרעין התא (LXR, ROR ו-ERα) ודרך טרנספורטרים או חלבונים רגולטוריים. ההשפעות הפיזיולוגיות של אוקסי-סטרולים מקיפות כולסטרול, ליפידים ואת ההומאוסטאזיס של גלוקוזה. בנוסף, הראו שהם כרוכים בתהליכים אחרים כגון וויסות החסינות וההומאוסטאזיס המוחי. לראשונה, הם נלמדו כקודמנים של חומצות מרה, אך עד מהרה הם התגלו כתווכים של ליפידים. רמותיהם משתנות באופן בולט במספר פתולוגיות, וחלק מהאוקסי-סטרולים (כגון 4β-hydroxycholesterol או 7α-hydroxycholestenone) משמשים כסמנים של פתולוגיות שונות. בשני איברים עיקריים, יש לאוקסי-סטרולים פעילות מטבולית ניכרת (כבד ומוח), אך הם משמעותיים גם בפלזמה ובנוזל השדרה (Crick וחב' ב-Steroids משנת 2015).
הפיזיולוגיה של אוקסי-סטרולים
אוקסי-סטרולים הם מולקולות עם 27 פחמנים אשר בדומה לכולסטרול בנויים משלד סטרואידי, ושרשרת צדדית של methylheptan-2-yl-6. פחמן 3 של המרכיב הסטרואידי יכול להיות מוחלף על ידי הידרוקסיל בדומה לכולסטרול, או על ידי ketone. יתרה מכך, קבוצת ה-3-הידרוקסיל מאפשרת אסטריפיקציה או סולפציה של אוקסי-סטרולים כמו גם של כולסטרול. מבחינה כימית, היכולת להבדיל בין אוקסי-סטרול לבין כולסטרול, מבוססת על התפקיד החמצוני הנוסף המצוי באוקסי-סטרולים. אף על פי שבפרסומים רבים המושג hydroxycholesterol (להלן OHC) משמש לרוב לתאר אוקסי-סטרולים בהקשר של הידרוקסילציה נוספת, מבחינה כימית אוקסי-סטרולים אינם מוגבלים להוספה של קבוצת הידרוקסיל בודדת. אכן, בנוסף לתרכובות שעברו הידרוקסילציה (דוגמת 4β-OHC, 7α-OHC ו- 7α,25-dihydroxycholesterol), ישנם גם אוקסי-סטרולים עם קבוצת ketone (כגון ketocholesterol-7, ו-7α-hydroxycholestenone) ואפוקסידים (דוגמת epoxycholesterol-5,6 ו-24(S),25-epoxycholesterol) וכן מולקולות עם שתי קבוצות תפקודיות שונות כגון keto-27-hydroxycholesterol-7 (Luu ב־Steroid Biochem Mol Biol משנת 2013). נמצא שאוקסי-סטרולים הם גם תוצרי ביניים של pregnenolone בסינתזת הורמונים סטרואידיים (Iuliano ב־Chem Phys Lipids משנת 2011), ושהם מסוגלים גם להגיב עם קולטנים ספציפיים. כקבוצה, האוקסי-סטרולים האנדוגניים יכולים להיווצר או דרך חמצון על ידי רדיקלים חופשיים, או על ידי מנגנונים המתווכים בעזרת אנזימים. החמצון הכימי מאותחל כאשר אטום מימן בעמדה C-7 מותקף על ידי מולקולה חמצונית פעילה (ROS) כגון OH, או על ידי מולקולת חנקן פעילה (RNS) כגון ONOO− (Diczfalusy ב-Biochimie משנת 2013, ו-Hashimoto וחב' ב-J Lipid Res משנת 2013). בנוסף, פחמנים C-20 ו- ו-C-25 נמצאו in vitro להיות חשופים לחמצון על ידי רדיקלים חופשיים על ידי התקפה דו-רדיקלית של חמצן. עם זאת, בניגוד לעמדה 7, in vivo, ריאקציה רדיקלית זו אינה נראית אחראית לשיעור גדול של השפעה על ה-25-OHC האנדוגני (Schwartz וחב' ב-J Biol Chem משנת 1996). יתרה מכך, אין עדיין דיווחים על כימות in vivo של 20(S)-OHC.
המטבוליזם של אוקסי-סטרולים בעכברים ובאדם
בחינה של המטבוליזם המורכב המוביל מכולסטרול והקודמנים שלו למספר ניכר של אוקסי-סטרולים אנדוגניים, מצביעה על כך שהאנזימים העיקריים הכרוכים בתהליך זה יכולים להתחלק ל-3 קבוצות: Oxidoreductases (כגון ציטוכרום P-450), הידרוקסילזות של כולסטרול (hydroxysteroid dehydrogenases ו-(squalene epoxidase, הידרלזות (כגון cholesterol epoxide hydrolase ו־cholesterol esterase), וטרנספרזות כגון hydroxysteroid sulfotransferases.
Amyotrophic lateral sclerosis (להלן ALS)
מחקרים עדכניים על נסיוב/פלזמה ו-CSF של מטופלים עם ALS, מצאו רמות מוגברות של כולסטרול חופשי ב-CSF של חולי ALS בהשוואה לקבוצת ביקורת לא מחלה נוירו-דגנרטיבית (Abdel-Khalik וחב' ב-J Lipid Res משנת 2013). אנליזה של הנסיוב הראתה ש-26-HC ו-3β-hydroxycholest-5-en-(25R)26-oic acid (להלן 3β-HCA), שני מטבוליטים הנובעים מחמצון של כולסטרול על ידי האנזים cytochrome P450 27A1 היו מופחתים בחולי ALS, מה שמציע דיס-רגולציה או פעילות מופחתת, של האנזים המופיע ב-ALS. הגן CYP27A1 הוא גן רגיש ב-ALS על פי מחקר genome-wide (Diekstra וחב' ב-PLos ONE משנת 2012).
אוקסי-סטרולים ומחלת אלצהיימר (להלן AD)
כולסטרול נקשר שנים רבות לאטיולוגיה של AD עם האלל ε4 של אפוליפרוטאין E, שהוא גורם הסיכון החזק ביותר של AD (Corder וחב' ב-Science משנת 1993). הריכוזים של סך 24-HC מוגברים ב-CSF של מטופלים עם AD, אך מופחתים בנסיוב/פלזמה של חולים אלה, בעוד שהריכוזים של סך 26-HC נמצאו מוגברים ב-CF ובמוח של חולי AD (Heverin וחב' ב-J Lipid Res משנת 2004). בעוד ש-CYP46A1 מבוטא באופן נורמלי בנוירונים, הוא פעיל גם באסטרוציטים של החולים עם AD. אחד הגורמים המעטים המשפיעים על השעתוק של CYP46A1 היא עקה חמצונית (Ohyama וחב' ב-J Biol Chem משנת 2006), כנראה כמנגנון הגנה כנגד התפתחות מחלה נוירו-דגנרטיבית. נתונים עדכניים מראים שהמטבוליט של 26-HC שהוא 7α-25-dihydroxy-3-oxocholest-4-en-26-oic acid, מופחת ב-CSF של חולי AD (Griffiths וחב' ב-Free Rad Biol Med משנת 2018). עובדה זאת יכולה להסביר חלקית את הרמות המוגברות של 26-HC במוחות של חולי AD הנובע מהפינוי המופחת שלו. מחקרים in vitro ו-in vivo במכרסמים הראו ש-26-HC פוגע במורפולוגיה הנוירונלית וכן בהיפוקמפוס, וכן ברמות של החלבון הבתר-סינפטי PSD95 (Merino-Serrais וחב' ב-Cereb Cortex משנת 2019). החלבון האחרון הוא אחד החלבונים הנפוצים ביותר בבתר-סינפסבה, והוא נחשב קריטי להתבגרות תקינה של הסינפסה ולפלסטיות שלה. חוקרים אלה סבורים שעיכוב CYP27A1, האנזים האחראי להפיכת כולסטרול ל-26-HC, עשוי להיות מהלך מעכב להפחתת הסיכון של שיטיון או לשפר תרפיות לשחזור התפקוד הנוירונלי. בעוד ש-26-HC ו-CYP27A1 עשויים להיכרך עם הסיבה לשיטיון, CYP46A1 עשוי להיות בעל פוטנציאל תרפויטי ב-AD. Djelti וחב' הראו ב-Brain משנת 2015, שבמודל העכבר APP למחלת AD, השפעה של פפטידים מסוג amyloid-β המוגברים בעקבות העיכוב של CYP46A1. AD מאופיין על ידי פתולוגיה של amyloid ו-Tau. תוצאות אלו המריצו את Burlot וחב' בפרסום ב-Hum Mol Genet משנת 2015, לבחון את השפעת ההחדרה של CYP46A1 בעזרת הווקטור adeno virus להיפוקמפוס של עכבר שהוא מודל של פתולוגיה של Tau דמוית-AD עם רמות נמוכות של S-24-HC בהיפוקמפוס, מה שהפחית את הפגיעה הקוגניטיבית ואת הפגמים בעמוד השדרה האופייניים למודל עכברים זה. מסקנות חוקרים אלה היא ש-CYP46A1 עשוי להיות היעד של טיפול תרפויטי ב-AD. בהקשר זה, הוצע שתכשיר אנטי-HIV הידוע כ-efvirenz, המשפעל את CYP46A1 עשוי להיות טיפול ב-AD (Mast וחב' ב-Neuropharmacology משנת 2017).
אוקסי-סטרולים וסרטן
אוקסי-סטרולים, ובעיקר HC-25 ו-HC-26 נכרכו עם האטיולוגיה של סרטן השד (Nelson וחב' ב-Science משנת 2013, Wu וחב' ב-Cell Rep מאותה שנה ו-Simigdala וחב' ב-Breast Cancer Res משנת 2016), ואילו מטבוליטים של epoxycholesterol-5,6 (להלן (5,6-EC נכרכו הן בדיכוי (Segala וחב' ב-Nat.Commun משנת 2017), או בסיוע להתרחשות סרטן השד (Voisin וחב' ב-Proc Natl Acad Sci USA משנת 2017). מחקר עדכני כרך את HC-26 בגרורתיות של תאי סרטן דרך פעילותו על תאי חיסון (Back וחב' ב-Nat Immun משנת 2017). חוקרים אלה הראו במודל של חיות שההשפעה הגרורתית של דיאטה עתירת-שומן, מתבצעת דרך HC-26 ושגרורות יכולות מופחתות על ידי עיכוב של CYP27A1. נמצא גם שהפעילות מקדמת הגרורות של נויטרופילים פולי-מורפו-נוקלאריים ושל תאי γδ-T הוגברה על ידי 26-HC. נמצא ש-7α,26-dihydroxycolsterol ו-7beta,26-diHC, הם משפעלים של תגובה קולטן הגרעיני RORγ, הפועלת ליצירת IL-17 בתאי Th17 CD4+ או ליצירת IL-17 בסוגי תאים אחרים כגון γδ-T, ואין זה בלתי סביר ששני סוגי מולקולות אלה שיצירתם נתמכת על ידי חמצון של CYP27A1 במצעי 7hyroxy, עשויים להניע את הפעילות המקדמת גרורות של תאי γδ-T (Soroosh וחב' ב-Proc Natl Acad Sci USA משנת 2014). Baek וחב' הראו במחקרם שעיכוב של CYP2A1 על ידי המולקולה הקטנה GW273297X עיכב משמעותית את הגרורות של סרטן השד בריאות בשני מודלים של חיות, מה שמצביע על כך ש-CYP27A1 יכול לספק גישה תרפויטית. כתמיכה בהשערתו של Baek, נמצא שנטילת תכשירים להפחתת כולסטרול, הייתה כרוכה בפרק זמן מוגבר נטול הישנות המחלה, בנשים בגיל המעבר עם סרטן שד גרורתי בשלב המוקדם של טיפול הורמונלי (Borgquist וחב' ב-J Clin Oncol משנת 2017).
אוקסי-סטרולים הם צורות מחומצנות של כולסטרול ושל הקודמנים שלו (Schropefer ב-Physiol Rev משנת 2000). הם כוללים 1α,25-dihydroxyvitamin D3, הצורה הפעילה ביולוגית של ויטמין D3, S-hydroxycholesterol24, הידוע גם כ-cerebrosterol שהוא המטבוליט העיקרי של כולסטרול הנמצא במוח (Bjorkhem ב-Lipids משנת 2007), 25hydroxycholesterol המסונתז על ידי מקרופאגים כתוצאה מהדבקה על ידי חיידקים או נגיפים (Bauman וחב' ב-Proc Natl Acad Sci USA משנת 2009, ו-Blanc וחב' ב-Immunity שנת 2013), ו-22hydroxycholesterol שהוא המטבוליט הראשון של כולסטרול במסלול הסינתזה של הורמונים סטרואידים (Chaudhuri וחב' ב-J Biol Chem שנת 1962). α-hydroxycholesterol הוא הוא החבר הראשון של המסלול הנויטרלי של הסינתזה של חומצות מרה, ו-26hydroxycholesterol הוא החבר הראשון של המסלול החומצי בביו-סינתזה של חומצות מרה (Vaz ו-Ferdinandusse ב-Mol Aspects Mede Lipid Res משנת 2017). כמו כן, cholestenoic acid בה הפחמן הטרמינלי של שרשרת הכולסטרול הצדדית חומצן לחומצה קרבוקסילית במשפחת האוקסי-סטרולים. אוקסי-סטרולים הן מולקולות ביו-אקטיביות. השרשרות הצדדיות של אוקסי-סטרול בהן התרחש חמצון, הן ליגנדים ידועים של קולטני X בכבד, כדוגמת LXRα ,NR1H3 ,LXRβ ו־NR1H2 (Lehmann וחב' ב-J Biol Chem משנת 1997), ומשמשים לעיכוב ההפיכה של SREBP-2 (או sterol regulatory element-binding protein-2) לצורה הפעילה כפקטור השעתוק לביטוי הגנים במסלול ה-mevalonate של סינתזת כולסטרול (Radhakrishnan וחב' ב-Proc Natl Acad Sci USA משנת 2007), כמו גם כמאפננים אלוסטריים פוטנטיים של הקולטנים של NMDA (אוN-methyl-d-aspartate (Paul וחב' ב-J Neurosci משנת 2013, ו-Linsenbardt וחב' ב-Neuropharmacology משנת 2014).
אוקסי-סטרולים ומחלת פרקינסון (להלן PD)
כאשר מודדים את סך המטבוליט 24-HC הוא נמצא מוגבר ב-CSF של חולים במחלות נוירו-דגנרטיביות שונות, ייתכן כתוצאה מהפרשתו מנוירונים מתים, או לחלופין כתוצאה מהמטבוליזם של CYP46A1 או מהפרשה של כולסטרול מתאים אלה (Björkhem וחב' ב-Mol Aspects Med משנת 2009). נתון זה מנוגד למצב בצירקולציה בה רמת 24-HC מופחתת, כנראה תוך שהיא משקפת את המספר המופחת של נוירונים פעילים מטבולית. במחקר עדכני יותר, נמצאה עלייה משמעותית של סך 24-HC ב-CSF של מטופלים עם PD בהשוואה לקבוצת הביקורת (Bjorkhem וחב' ב-Front Neurol משנת 2018). חוקרים אלה מצאו מתאם משמעותי בין 24-HC ו-Tau ב-CSF של חולי PD. מתאם דומה נמצא גם בין 24-HC ו-P-Thr181 Tau. Tau הוא סמן כללי לנוירודגנרציה ולפוספורילציה לא נורמלית נוירונלית, מה שגורם לאי-יציבות ולרמות מוגברות של Tau ושל phospho-Tau ב-CSF.
הקשר בין צריכת אוקסי-סטרולים ומחלת לב
בשנת 1957 פרסם Johnston ב-Science מאמר על הנוכחות של חומצות שומניות מסוג trans ברקמת אדם. הסיבה לפיה כולסטרול נחשב גורם סיכון למחלת לב מבוסס על מחקרים שעשו שימוש בכולסטרול מחומצן. דיאטות עשירות בחומצות שומן מחומצנות מגבירות את רובדי השומן באבי העורקים של ארנבות מוזנות עם כולסטרול. ארנבות שהוזנו בדיאטה שהייתה מורכבת מכולסטרול שנשמר בטמפרטורה של מינוס 70 מעלות, כדי למנוע חמצונו (Staprans וחב' ב-Mol Nutr Fod Res משנת 2015). קבוצת ארנבות שנייה הוזנה באותה דיאטה, פרט לכך שבערך 0.5% מהכולסטרול (או 25 מיליגרם כולסטרול מחומצן ליום) המוסף למזון היה מחומצן. חמישה סוגי אוקסי-סטרולים נמצאו בפלזמה של הארנבות מהקבוצה השנייה: 7α-hydroxycholesterol, 7β-hydroxycholesterol, beta-epoxycholesterol ,α-epoxycholesterol, ו-25β-hydroxycholesterol. אחוז השטח של אבי העורקים שהיה מכוסה ברבדי טרשת שומניים, היה גדול פי-2 בארנבות שהוזנו עם כולסטרול מחומצן, מאשר בקבוצת הביקורת.
בשנת 1979 התבקש Kummerow על ידי העורך של American Journal of Clinical Nutrition להסביר את הפגיעה במאזן התזונתי ואת תופעת האנגיו-טוקסינים כגורמי סיכון תזונתיים. הוא הדגים שהפגיעה במאזן האמור נוצרה כתוצאה מכמות מוגברת של שומנים צמחיים בדיאטה ובצריכה של עודף אוקסי-סטרולים, הכוללים את הטוקסינים הללו במהלך טיגון של מצרכי מזון. חזירים שהוזנו בדיאטה נטולת כולסטרול, פיתחו את אותו סוג של טרשת עורקים שניתן היה לראות על ידי בחינה במיקרוסקופ אלקטרוני, במטופלים שנפטרו ממחלת עורקים כליליים. Kummerow הבין אז שכולסטרול במזון אינו הכרחי ליצירת טרשת עורקים באדם. בשנת 2013 פרסם Kummerow ב-American Journal of Cardiovascular Disease מאמר בו הוא קבע שטרשת עורקים באדם המודרני מבוססת ביוכימית על ההרכב והמבנה של שלושה מתוך חמישה פוספוליפידים בממברנות של תאים בעורקים הכליליים. ממצאיו הראו שמזון מטוגן, אבקת חלמון ביצים, עודף של שומן צמחי, שומן צמחי שעבר הידרוגנציה חלקית ועישון סיגריות כגורמים העיקריים של מחלת לב. מזון מטוגן הוא מקור תזונתי של אוקסי-סטרולים המשנים את הפוספוליפידים בממברנות בעורקי אדם, באופן המגביר משקעי סידן, יסוד מרכזי בטרשת עורקים. צריכה של כמות מוגברת של שומנים רב-בלתי-רוויים, מעודדת את יצירת אוקסי-סטרולים בגוף האדם.
חוקר זה הדגים שכולסטרול מחומצן בנסיוב של ארנבות מסונתז אנדוגנית ומגיע גם מהמזון. אוקסי-סטרולים מסונתזים אנדוגנית דרך חמצון מתווך על ידי רדיקלים חומציים. נמצא, ששבעה אוקסי-סטרולים (שניים מהם, chlestane-3β,5α,7β-triol ו-27-hydroxycholestero נמצאו באבקת ביצים או בשומנים מטוגנים, בהתאמה), ונמצאו בריכוזים מוגברים בפלזמה של מטופלים אנושיים שעברו ניתוח מסתמי לב CABG)) מה שמעיד על כך שהם חשובים בהתפתחות של טרשת עורקים הן בחיות כמו גם באדם.
מחקר של Shah ו-Schulman ב-Lipids משנת 1967, הדגים שספינגומיאלין עובר הידרוגנציה בנוכחות מי-מלח, הדומים בהרכבם לפלזמת אדם, תוך אספקת המטען היוני שיכול להגיב עם סידן. בוצעה אנליזה של הפלזמה ושל רקמת העורקים של אלה העוברים ניתוח מעקפי-לב, על מנת לבחון כיצד רקמות אלו שונות מאלו של רקמת ביקורת ללא היצרות כגון עורקי השלייה. הקבוצה הראשונה הכילה רמות גבוהות יותר של ספינגומיאלין בעורקים ובפלזמה שלהם, מאשר בקבוצת הביקורת. על מנת לבחון האם האוקסי-סטרולים בפלזמה היו אחראים לשינויים בממברנות פוספוליפידיות ולהופעת טרשת עורקים, הודגרו תאי עורקים עם אוקסי-סטרולים. התברר שהאחרונים הגבירו את הסינתזה ואת תכולת ספינגומיאלין בממברנות, כמו גם את צריכת סידן. יתרה מכך, כאשר תאים הודגרו עם כולסטרול שלא חומצן, אפילו בריכוזי אוקסי-סטרולים הגבוהים פי-12, לא נמצאה כל השפעה על תכולת הספינגומיאלין (Zhou וחב' ב-Exp Biol Med משנת 1993). נתון זה מוכיח שכולסטרול כשלעצמו אינו הגורם לתחלואת לב, אלא שהוא צריך לעבור חמצון כדי לגרום נזק לבבי.
אוקסי-סטרולים ו-Hereditery spastic paraplegia type 5 (או SPG5)
בדומה ל-ALS, היא צורה של מחלת motor-neuron, אך בניגוד ל-ALS מדובר במחלה מונוגנית הנובעת מחסר של CYP7B1 (או cytochrome P450 family 7 subfamily B member 1), האוקסי-סטרול 7α-hydroxylase (Schols וחב' ב-Brain משנת 2017). בניגוד ל-ALS הסך והצורה החופשית של HC-26 ושל 3β-HCA מוגברים בריכוז בדם וב-CSF של חולים ב-SPG5. בריכוזים נמוכים הרמות של HC-26 הנמדדות בנסיוב, מסתבר שמולקולה זו טוקסית לשורת תאים של motor-neuron, מה שמעיד על כך שמדובר במטבוליט טוקסי גורם-מחלת SPG5. חולים מאובחנים עם cerebrotendinous xanthomatosis (להלן CTX), מפגע בו יש חסר של CYP27A1, בדומה למטופלים עם SLS, עלולים לסבול מתפקוד מוטורי לקוי, והחולים בשתי המחלות חסרים חומצה cholestenoic. נמצא שחומצה זו מספקת הגנה לנוירונים ה-oculomotor דרך מנגנון הכורך LXRs, מה שמציע שחסר החומצה האחרונה ב-CTX וב-SPG5 עלול לגרום לפחות בחלקו לפנוטיפ המוטורי הלקוי בשתי המחלות (Thefilopoulos וחב' ב-J Clin Invest משנת 2014). חסר של ACOX2 (או acyl-coA oxidase-2) שהיא טעות מולדת של מטבוליזם של כולסטרול, בדומה ל-CTX בא לביטוי כשגשון (ataxia) (Vilarinho וחב' ב-Proc Natl Acad Sci USA משנת 2016), אך בניגוד ל-CTX יש בו רמות מוגברות בדם של חומצות C27. שני האפימרים, S25 ו-25R מתחמצנים במוח לקבלת האקווי-ולנטים שלהם מסוג 3-oxo-4-ene והחומצה 7-alfa-hydroxy-3-oxocholest-4-en-26-oic נמצאה מופרשת מהמוח לתוך הצירקולציה כנגד גרדיאנט ריכוזים הנגרם מהזיקה הגבוהה של החומצה לאלבומין (Iuliano וחב' ב-Steroids משנת 2015, ו-Saeed וחב' ב-J Lipid Res משנת 2017).
מחלת Huntington (להלן HD): זו מחלה נוירו-דגנרטיבית אוטוזומלית-דומיננטית הנגרמת על ידי החזרים מוארכים של polyglutamine בחלבון huntingtin (Bates וחב' ב-Nat Rev Dis משנת 2015). המחלה בדרך כלל מופיעה באמצע החיים עם פגיעה קוגניטיבית ונוירופסיכיאטורית. עודף של החזרי 36CAG, שהוא קודון DNA של גלוטמין ב-exon 1 של הגן המקודד ל־HTT huntingtin)) מוביל לשכיחות של HD של 1:10,000 באוכלוסיות מערביות. במודלים בעכברים של HD, יש ראיות טובות להפחתת הרמות של קודמנים של כולסטרול ב-striatum (האזור במוח שמראה אטרופיה ב-HD) (Valenza וחב' ב-Hum Mol Genet משנת 2007), וכן דיס-רגולציה בגנים של ביוסינתזה של כולסטרול בשורות תאים של HD במודל של עכברים (Sipione וחב' באותו כתב עת משנת 2002, ו-Valenza וחב' ב-J Neurosci משנת 2010). הרמות של 24S-HC בפלזמה נמוכות במטופלים עם HD, ייתכן כתוצאה ממספר מופחת של נוירונים פעילים מטבולית. במטופלים לפני אבחון המחלה ישנם בפלזמה ערכי S-HC24 דומים לאלה שבקבוצת הביקורת (Leoni וחב' ב-Brain משנת 2008). בבני-אדם, נמצאה רמה מוגברת של סך כולסטרול, באזור ה-caudate שהוא תת-אזור של ה-striatum בחולים עם HD (Del Toro וחב' ב-J Neurochem משנת 2010).
בהתבסס על נתוני הכולסטרול, Valenza וחב' הציעו בפרסום ב-EMBO Mol Med משנת 2015, מתן מקומי של כולסטרול במוח כטיפול בחולי HD. חוקרים אלה הראו שהחדרה של כולסטרול בעזרת ננו-חלקיקים למוח של חולים אלה, מפחיתה את הפגיעה בתפקוד הסינפטי והקוגניטיבי בעכברים מסוג R6/2. HD אלטרנטיבית, הוצע שהאנזים CYP46A1 המבצע הידרוקסילציה של כולסטרול ב-C-24S במוח, עשוי להיות תרפויטי בחולי HD (Boussicault וחב' ב-Brain משנת 2016). חוקרים אלה הדגימו באופן אלגנטי שהחדרה על ידי נגיף דמוי Adeno של האנזים CYP46A1 ל-striatum של מודל העכבר R6/2 HD, הפחיתה את האטרופיה של תאי העצב ושיפרה פגמים מוטוריים, וכצפוי הגבירה רמות של 24-HC. גם הרמות של סך desmosterol הוגברו, מה שמצביע על אפשרות של טיפול פוטנציאלי של HD עם האנזים CYP46A1 או עם המטבוליטים שלו.
מדידה של אוקסי-סטרולים, כולל חומצות C27 בציקולציה או ב-CSF, חיונית לאבחון של משגים מולדים נדירים של טרנספורט של כולסטרול, ושל הביוסינתזה והמטבוליזם שלו (Schule וחב' ב-J Lipid Res משנת 2010, Jiang וחב' באותו כתב עת משנת 2011, Xu וחב' באותו כתב כת מאותה שנה, Sidhu וחב' באותו כתב עת משנת 2015, Bleyle וחב' ב-Mol Genet Metab Rep משנת 2016). בנוסף, מדידות אלו הן בעלות ערך בהגדרת סמנים של התקדמות המחלה, ובעיקר חשובות בפיתוח תכשירים תרפויטיים חדשים לטיפול במחלות נוירו-דגנרטיביות. אוקסי-סטרולים בדרך כלל נמדדים בשיטת Dzeletovic) GC-MS וחב' ב-Anal Biochem משנת 1995,ו- Schott ו-Lutjohann ב-Steroids משנת 2015), או בשיטת liquid chromatography tandem-Mass spectrometry (או LC-MS/MS) Stiles) וחב' ב-Proc Natl Acad Sci USA משנת 2014). כאשר נכללת הידרוליזה בסיסית סך האוקסיסטרול (שעבר או שלא עבר אסטריפיקציה) נמדד. בהיעדר הידרוליזה, נמדדות המולקולות שלא עברו אסטריפיקציה (החופשיות). בעוד שדריבטציה היא דרישה של ביצוע מדידות בשיטת GC-MS. אין הדבר כך לגבי ביצוע של LC-MS/MS, אם כי חוקרים רבים מבצעים דריבטיזציה להגביר את רגישות המדידה (Roberg-Larsen וחב' ב-J Lipid Res משנת 2014, ו-Griffiths וחב' ב-Biochim Biophys Acta משנת 2019). המגוון הגדול מאוד של איזומרים של אוקסי-סטרולים מאתגר הפרדה כרומטוגרפית שלהם (Diaz וחב' ב-Biochimie משנת 2018).
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק