מטהמוגלובין - Methemoglobin
הופניתם מהדף מטהמוגלובין לדף הנוכחי.
| מדריך בדיקות מעבדה | |
| מטהמוגלובין | |
|---|---|
| Methemoglobin | |
| שמות אחרים | MetHB |
| מעבדה | המטולוגיה בדם |
| תחום | בעיות של המוגלובין לא סדיר, וליקויים בחמצון רקמות |
| טווח ערכים תקין | בדם מלא- 0.06-0.24 גרם/דציליטר (או 9.3-37.2 מיקרומול/ליטר). |
| יוצר הערך | פרופ' בן-עמי סלע |
מנגנון החמצון של המוגלובין ויצירת מטהמוגלובין
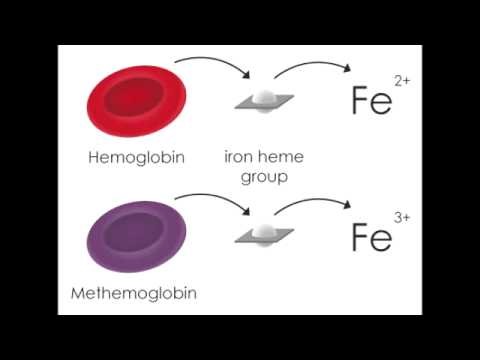
אריתרוציטים מכילים המוגלובין בעל מבנה רביעוני. כל מולקולת המוגלובין מורכבת מ-4 שרשרות פפטידיות (שתי שרשרות α ושתי שרשרות β) המאוחדות על ידי גרעין heme, המכיל ברזל בצורה מחוזרת של +2Fe. בצורה זו הברזל יכול לקשור מולקולת חמצן על ידי שיתוף אלקטרון, ליצירת אוקסי-המוגלובין. כאשר צורת ביניים זו משחררת חמצן לרקמות, מולקולת הברזל שבה לצורת ה-ferrous המקורית. כאשר המוגלובין מאבד אלקטרון ומתחמצן, אטום הברזל עובר לצורת +3Fe החסרה את האלקטרון הנחוץ ליצירת קשר עם חמצן, וכך אובדת היכולת לשאת חמצן לרקמות, ומובילה למצב של היפוקסיה (Darling ו-Roughton ב-Am J Physiol משנת 1942). הגוון של דם מיובש על נייר סופג הוא חום "שוקולד" במקום הגוון האדום הטבעי.
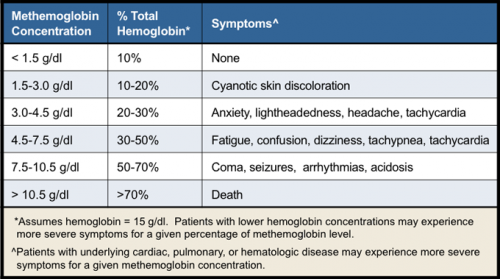
במטהמוגלובין (להלן MethHb), הברזל בגרעין ה-heme מחומצן ממצב-ferrous הנורמאלי למצב ferric, והוא אינו מסוגל לקשור ולהעביר חמצן. בתנאים פיזיולוגיים תקינים MethHb מהווה פחות מ-1% מכלל רמת Hb בדם, והתסמינים מתחילים כאשר רמת MethHb עולה מעל אחוז זה. יכולת התא לשמור על רמה נמוכה של MethHb נשמרת על ידי 2 מנגנונים:
- הראשון הוא מסלול hexose-monophosphate shunt בתוך האריתרוציט בו חומרים מחמצנים מחוזרים על ידי גלוטתיון.
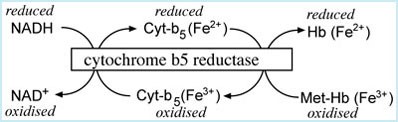
- המנגנון השני והחשוב יותר, כורך 2 מערכות אנזימטיות, diaphorase I ו-diaphorase II, כאשר מנגנון זה זקוק ל-NADH ול-NADPH בהתאמה, על מנת לחזר MethHb לצורת ferrous המקורית שלו. ה-NADPH נוצר בתא על ידי hexose-monophosphate shunt.
החיזור של MethHb על ידי NADH (מסלול diaphorase I) הוא החשוב מבין שני המנגנונים (Mansouri ו-Lurie ב-Am J Hematol משנת 1993). האנזים cytochrome b5 reductase משחק תפקיד עיקרי על ידי שהוא מעביר אלקטרון מ-NADH ל-MethHb ובכך מחזר את המולקולה האחרונה להמוגלובין. מערכת אנזימטית זו אחראית להרחקת 95-99% מה-MethHb הנוצר בתנאים נורמאליים. החיזור של MethHb במסלול התלוי ב-NADPH (מסלול ה-diaphorase II) הוא בעל תפקיד משני בהרחקת MethHb. מערכת זו מנצלת יצירת גלוטתיון ואת האנזים G6PD לחיזור המולקולה להמוגלובין. מערכת זו תופסת חלק נכבד יותר באלה עם חסר של cytochrome b5 reductase.
מסלול החיזור של MethHb התלוי ב-NADPH יכול להיות מוחש על ידי קו-פקטורים אקסוגניים כמו methylene blue פי-5 מפעילותו הרגילה (Curry ב-Ann Emerg Med משנת 1982, ו-Goluboff ו-Wheaton ב-J Pediatr משנת 1961). בהיעדר הצטברות מתמשכת של MethHb, שני מנגנוני החיזור המתוארים של מולקולה זו יכולים לפנות אותה מהתא בקצב של 15% לשעה. מתילן כחול פועל על ידי שהוא מספק קולט מלאכותי של אלקטרון כמתילן כחול עצמו או flavin לצורך פעולת האנזים NADPH MethHb reductase.
הטיפול במקרים של מטהמוגלובינמיה
הטיפול נעשה על ידי אספקת חמצן ומתילן כחול בתמיסה של 1% או 1-2 מיליגרם הניתנת בעירוי ורידי איטי למשך 5 דקות. למרות שהתגובה בדרך כלל מהירה, ייתכן שיש צורך לחזור על העירוי אם רמת מטהמוגלובין עדיין גבוהה. מתילן כחול מעכב את האנזים monoamine oxidase, לכן יש להקפיד להימנעות מטוקסיות של סרוטונין שיכולה להתרחש אם הטיפול עם מתילן כחול מתבצע במקביל לנטילת תכשירי SSRI או selective serotonin reuptake inhibitors (על פי Gilman ב-Anaesthesia משנת 2006).
פרוגנוזה
אלה עם type I MethHb ומחלת המוגלובין M הם בדרך כלל בעלי מהלך תקין. לעומת זאת type II MethHb מחלה רצינית יותר, העלולה לגרום מוות בשנות החיים הראשונות. אלה עם מטהמוגלובינמיה (כחלת) נרכשת, בהם זוהה ונמנעת החשיפה לגורם המחלה (תרופה, מזון או כימיקל) יחוו מהלך מחלה מאוד קל. הפרוגנוזה של מקרים קלים של מטהמוגלובינמיה בהחלט טובה. במקרים חמורים, הפרוגנוזה נקבעת על ידי הנזק שגורמת אנוקסיה לאיברי קצה. סיבוכים של מטהמוגלובינמיה עלולים לכלול אוטם שריר לב, פרכוסים, תרדמת ומוות. ככל שגדלים ריכוזי MethHb ההיפוקסיה התאית חמורה יותר. מוות עלול להתרחש כאשר רמת MethHb מגיעה ל-70% מרמת סך ההמוגלובין. המהלך הקליני של הצורות המוּלָדוֹת של מטהמוגלובינמיה הוא בדרך כלל שפיר. הלוקים במפגע הם בדרך כלל א-תסמיניים פרט לגוון העור הכחלכל הכרוני בגין ציאנוזיס. עם זאת, אלה עם חסר של ציטוכרום אוקסידאז type IIb5 הם בעלי תוחלת חיים קצרה משמעותית בעיקר בגין סיבוכים נירולוגיים משולבים. תרחיש של מטהמוגלובינמיה קלה-עד-מתונה חולפת עלול לחמוק מהאבחון הרפואי, לכן צריך להקפיד על רמת חשדנות סבירה , כמו במקרים של מטהמוגלובינמיה חולפת עם חמצת בתינוקות (Yano וחב' ב-J Pediatr משנת 1982).
העובדה ש-MethHb אינו קושר ומעביר חמצן גורמת לאנמיה תפקודית (do Nascimento וחב' ב-Rev Bras Anestesiol משנת 2008). בנוסף, MethHb גורם לסטייה שמאלה בעקומת הדיסוסיאציה חמצן-המוגלובין, מה שמפחית את שחרור החמצן ברקמות. אנמיה וציאנוזיס למרות טיפול בחמצן, נובעים משתי ההשפעות האחרונות (Percy וחב' ב-Blood Rev משנת 2005). מטהמוגלובינמיה יכולה לנבוע מסיבות מולדות, מחשיפה לתרופות מסוימות ולטוקסינים, מסינתזה מוגברת או מפינוי מועט של המולקולה.
מטהמוגלובינמיה יכולה להופיע במטופלים עם חסר האנזים pyruvate kinase כתוצאה מיצירה לקויה של NADH, שהוא קו-פקטור הכרחי של האנזים diaphorase I. בדומה, באלה עם חסר האנזים G6PD עלולים להיות בחסר של יצירת קו-פקטור אחר, NADPH.
מטהמוגלובינמיה מולדת (hereditary)
קיימות לפחות 2 צורות של חסר מולד של Ib5R, ושתיהן מועברות בהורשה אוטוזומאלית-רצסיבית. בצורתtype 1 של החסר של Ib5R שהיא הצורה השכיחה יותר, האנזים cytochrome b4 reductase חסר רק באריתרוציטים, וההומוזיגוטים נראים ציאנוטים, אך פרט לכך הם א-תסמיניים. באלה רמת מטהמוגלובין באופן אופייני היא בתחום של 10-35% מסך המוגלובין, וההריונות אינם מסתבכים. אך הטרוזיגוטים של צורה זו, עלולים לפתח מטהמוגלובינמיה חריפה ותסמינית לאחר חשיפה לתרופות מסוימות או לטוקסינים.
בצורת type 2 של המחלה המולדת IIb5R שכיחה פחות באופן משמעותי, ומוצאים אותה רק ב-10-15% מהמקרים של חסר מולד של cytochrome b5 reductase. בצורת מחלה זו חסר האנזים בא לביטוי בכל התאים, לא רק באריתרוציטים. צורה זו כרוכה גם עם מספר בעיות רפואיות נוספות בעיקר של המוח כולל פיגור שכלי, מיקרוצפאלוס, וסיבוכים נירולוגיים נוספים. תוחלת החיים מתקצרת משמעותית, ומתרחשת בדרך כלל בגיל צעיר ביותר. המנגנון המדויק של הסיבוכים הנירולוגיים אינו ברור לפרטיו.
הנתונים בארה"ב מדגימים את הנדירות של מטהמוגלובינמיה תורשתית-מולדת. הצורה השכיחה ביותר של צורה זו של מטהמוגלובינמיה נובעת מחסר של type Ib5R cytochrome b5 reductase. חסר אנזים זה אנדמי ב-2 שבטים של אינדיאנים (Navajo ו-שבט המתגורר באלסקה הידוע כ-Athabaskan).
מטהמוגלובינמיה יכולה להיות כרוכה בהימצאות של המוגלובין בלתי-נורמאלי (Hb M). ברוב צורות ההמוגלובין הבלתי תקינות שייר טירוזין בא במקום שייר היסטידין, הקושר את גרעין heme לחלבון גלובין. שחלוף אחרון זה, מאפשר את החמצון של הברזל ב-heme לדרגת ferric התלת ערכית, ולכן Hb M עמיד יותר לחיזור על ידי האנזימים המחזרים את מטהמוגלובין להמוגלובין. ההורשה של הוואריאנטים של Hb M היא אוטוזומאלית-דומיננטית. אלה עם Hb M נראים ציאנוטים, אך פרט לכך הם בדרך כלל א-תסמיניים. ישנם 3 סוגים פנוטיפיים של Hb M, בתלות בגן הפגום המקודד ל-globin (α, β ו-γ) הגורמים למחדלים הבאים:
- וואריאנטים של שרשרת α כבר בשלב הנאונאטלי לציאנוזיס עיקש;
- וואריאנטים של שרשרת β אינם גורמים לציאנוזיס אלא אם כן חלפו מספר חודשים מהלידה, כאשר רמת ההמוגלובין העוברי פחתה;
- וואריאנטים של שרשרת γ גורמים לציאנוזיס חולף לאחר הלידה, אך זו מתפוגגת ברגע שהמוגלובין העוברי פחת (Gebara ו-Goetting ב-Clin Pediatr משנת 1994, ו-Bento וחב' ב-J Pediatr Hematol Oncol משנת 2013).
וואריאנט נוסף של המוגלובין הידוע כ-Hb E, כרוך אף הוא במטהמוגלובינמיה. מחקר מהמרכז הלאומי לחקר תלסמיה ב-Sri Lanka, בחן 45 מטופלים המאובחנים עם Hb E thalassemia ומצא שהם הכילו רמות גבוהות משמעותית של מטהמוגלובין (2.7% לעומת 0.3%) בהשוואה לנבדקים בריאים ולאלה עם המוגלובינופתיות אחרות. יתרה מכך, רמות מטהמוגלובין היו מוגברות משמעותית במטופלים תלסמיים שעברו קודם לכן כריתת טחול (Allen וחב' ב-Blood משנת 2012). גם אלה עם המוגלובין H חשופים יותר למטהמוגלובינמיה, שכן גם המוגלובין זה מגיב פחות טוב לחיזור למרות שמערכת הרדוקטאזות תקינה.
מטהמוגלובינמיה נרכשת (acquired)
רוב המקרים של מטהמוגלובינמיה הם נרכשים והם עולים בהרבה על מקרי מטהמוגלובינמיה תורשתית, כיוון שהם נובעים מחשיפה לתרופות שונות או לטוקסינים. אחת הצורות השכיחות ביותר של המפגע הנרכש היא כתוצאה מחשיפה לטיפול מקומי ב-benzocaine. ההערכה היא ש-0.115% מאלה שעוברים הליך של TEE (transesophageal echocardiography) מפתחים מטהמוגלובינמיה (Grauer ו-Giraud ב-J Am Soc Echocardiogr משנת 1996, Jiminez וחב' ב- Proc West Pharmacol Soc משנת 2007, ו-Vallurupalli וחב' ב-Echocardiography משנת 2009), זאת עקב שימוש ב-benzocaine כמאלחש מקומי. מחקר רטרוספקטיבי גדול מצא שכיחות גבוהה של עד 19.8% מטהמוגלובינמיה ב-167 ילדים שטופלו ב-dapsone למניעת Pneumocystis carinii Pneumonia (Esbenshade וחב' ב-Cancer משנת 2011). ההתרחשות של מטהמוגלובינמיה הייתה מוגברת במטופלים ב-dapsone במינון שמעל 2 מיליגרם/ק"ד/יום. Dapsone משמשת גם כתרופה לצרעת ולחטטת הפנים (acne), כך שיש צורך להקפיד בטיפול עם dapsone במקרים ידועים של חסר G6PD, באלה עם חסר של methHb reductase או באלה עם המוגלובין M (Wattan וחב' ב-N Eng J Med משנת 2015, ו-Skold ו-Klein ב-Am J Ther משנת 2011). בשני בתי חולים גדולים בארה"ב אותרו 138 מקרים של מטהמוגלובינמיה נרכשת בפרק זמן של 28 חודש (Ash-Bernal וחב' ב-Medicine משנת 2004). גם ברחבי העולם חסר האנזים type Ib5R מתגלה באופן נדיר, והוא אנדמי באנשי שבט Yakutsk במרחבי סיביר.
תכשירים שעלולים לגרום למטהמוגלובינמיה נרכשת
Acetanilide, acetaminophen, aminophenol, p-aminosalicylic acid, amyl nitrate, ammonium carbonate, arsine, benzocaine, cetacaine, chloroquine, chlorobenzene, cocaine,dapsone, ,cyclophosphamide , hydroxylamine ,2,4-dinitrophenol,,isobutyl nitrite indoxacarb, ifosfamide , lidocaine, mafenide acetate, menadione, metoclopramide, naphthalene, naphthoquinone, nitric oxide, nitroaniline, nitrobenzene, nitroethane, nitrofurane, nitroglycerine, nitroprusside, paraquat, phenacetin, phenazopyridine, phenylamine, prilocaine, primaquine, resorcinol, silver nitrate, sodium nitrate, sodium nitrite, sodium valproate, ,sodium chlorite sitamaquine thiosemicarbazone, אנטיביוטיקה ממשפחת ה-sulphonamide, trinitrotoluene ו-zopiclone.
דמוגרפיה התלויה בגיל
תינוקות בגיל פחות מ-4 חודשים, רגישים במיוחד למטהמוגלובינמיה, שכן המנגנון העיקרי באריתרוציטים למניעת עקה חמצונית היא מערכת NADH. בתינוקות מערכת זו אינה בשלה דיה, והפעילות של NADH methemoglobin reductase נמוכה. עדיין לא ברור מדוע אנשים מסוימים מפתחים methemoglubinemia תסמינית כאשר הם נחשפים לכימיקאלים ותרופות מחמצנות, בעוד שאחרים אינם מפתחים תסמינים. לעומת זאת, במקרה של יילודים ישנן 2 סיבות פיזיולוגיות לרגישותם המוגברת למפגע זה: במהלך ההתפתחות העוברית וכן ב-3-6 חודשי החיים הראשונים, כדוריות הדם מכילות המוגלובין עוברי (Hb F) ולא המוגלובין בוגר (Hb A). כיוון ש-Hb F מתחמצן בקלות רבה יותר מאשר Hb A. בנוסף, האנזים cytochrome b5 reductase לא פעיל בתקופת החיים המוקדמת, וכן יש סברה שחיידקים מייצרי-ניטראטים במעי, או גורמים מחמצנים אנדוגניים אחרים הקשורים בשלשולים, עלולים להגביר דווקא בתינוקות בגיל הרך את החמצון של המוגלובין למטהמוגלובין (Gebara ו-Goetting ב-Clin Pediatr משנת 1994). תינוקות בגיל נמוך מ-6 חודשים חשופים במיוחד למטהמוגלובינמיה נרכשת עקב תכולת ניטראטים במי שתייה, או חשיפה לבנזוקאין להפחתת כאבים בעת בקיעת שיניים (Manassaram וחב' ב-Environ Health משנת 2010).
ממצאים פיזיים במטהמוגלובינמיה
גוון העור וצבע הדם הם לבטח הממצא הפיזי-מעבדתי הבולט ביותר; ציאנוזיס-מופיע כאשר רמת methHb עולה על 1.5 גרם/דציליטר. אי ספיקה לבבית או נירולוגית. פרכוסים, הפרעות קצב הלב, חמצת, תרדמת. לעתים חיוורון עור המצביע על אנמיה, או אפשרות של המוליזה. סימנים אפשריים נוספים כוללים אי-סדירות של השלד או פיגור שכלי.
בדיקות מעבדה שיכולות להיות מוזמנות לבירור מטהמוגלובינמיה
רמות בנסיוב של ניטריטים ותרופות אחרות הידועות כתומכות במפגע זה;
משטח לצביעה לגילוי גופיפי Heinz;
בדיקת היריון בדגימת שתן;
אלקטרופורזה של המוגלובין לגילוי אפשרי של Hb M;
בדיקות לזיהוי כשל או אי-תפקוד איברים, כגון תפקודי כבד, ריכוזי אלקטרוליטים, רמת שתנן וקראטינין;
בדיקות לשלילת המוליזה-CBC, ספירת רטיקולוציטים, LDH, בילירובין בלתי-ישיר, haptoglobin.
בחינת צבע הדם על נייר סופג לאחר חשיפה של 60 דקות לאוויר, או לאחר ריווי הדם בחשיפה ל-100% חמצן: אם הדם נותר בגוון חום כהה לאחר טיפולים אלה יש סבירות גבוהה לתרחיש של מטהמוגלובינמיה.
כושר נשיאת החמצן של הדם יכול להיקבע בעזרת הבדיקות הבאות: קביעת גז עורקי (ABG), קביעת Co-oximetry, קביעת Pulse-oximetry, מבחן אשלגן ציאניד להבדלה בין methHb לבין sulfhemoglobin.
מקרים ייחודיים של מטהמוגלובינמיה
- The blue Fugates: משפחת Fugates שהתגוררה בהרי האפלאצ'ים של Kentucky, היא הדוגמה הטובה ביותר של הצורה המולדת של מטהמוגלובינמיה. אבי המשפחה, Martin Fugates התיישב באזור בסביבות שנת 1800, ואשתו הייתה נשאית של הגן הרצסיבי של המפגע בדומה למשפחה אחרת שהתגוררה בקרבת מקום והיו קשרי נישואין רבים בין 2 המשפחות. כתוצאה מכך נולדו צאצאים רבים שהיו הומוזיגוטיים לגן הפגום.
- הגברים הכחולים של Lurgan: שני גברים שהתגוררו ב-Lurgan באירלנד, אובחנו בשנת 1942 כלוקים במטהמוגלובינמיה בגלל גוון עורם הכחול. הם טופלו בוויטמין C ובסודיום ביקרבונאט, מה שהביא לנורמליזציה של גוון עורם תוך 12-30 יום מתחילת הטיפול (Deeny ב-Dublin A & A Farmac משנת 1995).
הוראות לביצוע הבדיקה
בדם מלא-נוטלים את דגימת הדם במבחנת ספירת-דם (פקק סגלגל, EDTA), או במבחנת הפארין (פקק ירוק) או במבחנת ציטראט (פקק תכלת). הדגימה יציבה למשך 1 שעה בטמפרטורת החדר. הבדיקה מתבצעת בשיטה ספקטרופוטומטרית. חייבים לבצע את הבדיקה סמוך ככל האפשר לנטילת הדם, שכן MethHb אינו יציב. בדיקת אלקטרופורזה על מצע עמילן ב-pH7.0 משמשת לקבוע את האחוז של MethHb ביחס ל-total-Hb כאשר במצב נורמאלי יחס זה אינו עולה על 0.37%±0.78.
ראו גם
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק