מניעת כאב ביילודים - הנחיה קלינית
|
| ||
|---|---|---|
| מניעת כאב ביילודים | ||
| 250px | ||
| הוועדה המקצועית | האיגוד הישראלי לניאונטולוגיה | |
| עריכה | *ד"ר איריס מורג
| |
| תחום | נאונטולוגיה | |
| קישור | באתר ההסתדרות הרפואית | |
| תאריך פרסום | דצמבר 2020 | |
| הנחיות קליניות מתפרסמות ככלי עזר לרופא/ה ואינן באות במקום שיקול דעתו/ה בכל מצב נתון | ||
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – כאב
חברי וועדת הכתיבה
- ד"ר איריס מורג - מחלקת פגים, מרכז רפואי "שמיר" (אסף הרופא)
- ד"ר איילה גובר - מחלקת פגים, המרכז הרפואי כרמל
- גב' סופי דומבה - דורון, PhD ,RNN-מחלקת פגים, מרכז רפואי "שמיר" (אסף הרופא)
- ד"ר סילביה פולדי - מחלקת פגים, בית חולים הלל יפה
- גב' אדינה דרומבוס RNN - מחלקת פגים, שערי צדק
- ד"ר איריס פריד - המטואונקולוגיה, טיפול תומך, שערי צדק
- ד"ר גדי אבבה קמפינו - המטואונקולוגיה, טיפול תומך, שיבא
- גב' דליה זילברשטיין PhD ,RN - מחלקת פגים, המרכז הרפואי מאיר
- פרופ' מתי ברקוביץ - היחידה לפרמקולוגיה קלינית, מרכז רפואי "שמיר" (אסף הרופא)
- מגר' מאיה ברלין - רוקחת, היחידה לפרמקולוגיה קלינית, מרכז רפואי "שמיר" (אסף הרופא)
- מגר' עדה גלוזמן חן - רוקחת, שירותי רוקחות, מרכז רפואי "שמיר" (אסף הרופא)
- גב' אירנה קליינמן - רוקחת, שירותי רוקחות, מרכז רפואי "שמיר" (אסף הרופא)
רקע מדעי
המערכות הנוירואנטומית והנוירואנדוקרינית מאפשרות העברת גירויי כאב בפגים החל משבועות צעירים מאד.
פעולות המעוררות כאב במבוגרים מעוררות כאב גם בפגים אולם, בניגוד למבוגרים, תחושת הכאב בפגים חזקה יותר וסף הגירוי הנדרש לגרימת כאב נמוך יחסית[1][2][3][4].
חשיפה חוזרת ונשנית לכאב ודחק (סטרס) בתינוקות ופגים, הנמצאים ממילא בסיכון התפתחותי, קשורה בתחלואות בטווח הקצר ובשינויים בעיבוד ובוויסות כאב וסטרס, הפרעה לקשב וליכולות הקוגניטיביות בטווח הארוך. מניעת כאב יכולה להוביל להפחתת תחלואות אלו[5][6][7][8][9][10].
פגים ותינוקות, לא רק שאינם יכולים לדווח על תחושת כאב ודחק, אלא שלעיתים, התגובות האופייניות לכאב ודחק בתינוקות בריאים, אינן נצפות בפגים או בתינוקות חולים. מכאן, שזיהוי כאב ודחק, הערכת עצמתם ומניעתם הכרחיים ותלויים בעיקר בצוותים הרפואיים[11]. גם טיפולים שגרתיים כגון שינויי מנח, החתלה או רחצה עלולים להוביל לדחק באוכלוסייה זו[12].
מחקרים מראים כי קיים יחס הפוך בין שבוע הלידה, הגיל הכרונולוגי וחומרת התחלואה לבין שכיחות הטיפול למניעת כאב הניתן על ידי הצוותים[13]. דהיינו, בימים הראשונים לחייהם, דווקא פגים צעירים, חולים ומונשמים אינם מקבלים טיפול מספק למניעת כאב ודחק[14][15].
מטרת המסמך
יצירת בסיס מדעי, שישמש את המחלקות המטפלות ביילודים ובפגים לצורך הכנת נוהל מחלקתי פנימי למניעה, טיפול בכאב ודחק באוכלוסייה זו.
עקרונות והמלצות
מניעת כאב עדיפה על טיפול בכאב. יש לחתור למניעת כאב לפני ובמהלך כל טיפול הכרוך בכאב בתינוקות ופגים. השימוש המשולב בתרופות ובטיפולים שאינם תרופתיים עדיף על כל אחד בנפרד.
כללי
- מומלץ, שכל פגייה תנהיג תוכנית כתובה למניעת כאב שתכלול את הנושאים הבאים:
- הפחתת מספר הפעולות המכאיבות
- ניטור סדיר לזיהוי כאב ביילודים המאושפזים ביחידה (שימוש בסולמות כאב)
- מניעת כאב אקטיבית ואלקטיבית בטרם ובעת ביצוע כל פעולה פולשנית
- הערכת כאב לאחר ניתוח ומניעתו (המסמך לא יעסוק בכך בהרחבה)
- התייחסות לכאב כרוני/סטרס ומניעתו (המסמך לא יעסוק בכך)
- מתן טיפול תומך (פליאטיבי) לאוכלוסייה ייעודית (ראו נספח מספר 3)
פירוט העקרונות והמלצות
- הפחתת מספר הפעולות המכאיבות:
- תכנון מראש היא הדרך היעילה ביותר למניעת כאב. לשם כך, נדרשת ערנות. עלינו לוודא שהבדיקה אכן נחוצה ולברר האם תוביל לשינוי בטיפול
- שימוש בשיטות ניטור שאינן פולשניות כגון מד סטורציה, בילירובין עורי, מד CO2 עורי
- הרכבת עירוי עורקי לתינוקות הזקוקים לבדיקות תכופות
- הרכבת עירוי מרכזי לתינוקות הזקוקים לעירוי ממושך
- ניטור סדיר לזיהוי כאב ביילודים המאושפזים ביחידה (שימוש באומדן כאב) - מחקרים מראים, כי כאב בפגים אינו מתועד דיו ואינו מטופל דיו. ההנחה היא, כי ניטור ותיעוד טוב יותר, יוביל לשיפור בטיפול[15]. מומלץ, להשתמש באומדן כאב הכולל מדדים פיזיולוגיים והתנהגותיים ומותאם למצבו וגילו של היילוד. הערכת כאב צריכה להתבצע בזמנים קבועים ולפני ואחרי כל פעולה פולשנית/או שינוי בטיפול האנלגטי. יש לתעד את התוצאות. אם מדד הכאב גבוה, מומלצת, התערבות ולאחריה הערכה מחדש במטרה לוודא את יעילות ההתערבות. דוגמאות לאומדני כאב תקפים לשימוש בפגים מובאות בנספח מספר 1. (N-PASS או PIPP-R)[16][17]. קיים אומדן להערכת כאב ודחק מתמשך בפגים ויילודים, וכן, קיימים אומדנים נפרדים לתינוקות פגים מונשמים אך אלו נבדקו על קבוצות קטנות[18][19][20]. מומלצת, היכרות עם סולמות שונים והתאמת הסולם להתוויה הנדרשת[21]
- מניעת כאב אקטיבית ואלקטיבית בטרם ביצוע פעולה פולשנית:
- מומלצת מניעת כאב לפני כל פעולה הקשורה בכאב או דחק
- בכל פעולה הקשורה בכאב או דחק יש לשלב התערבויות שאינן תרופתיות דהיינו, סביבתיות והתנהגותיות (פירוט בהמשך)
- מומלץ, שילוב שיטות (תרופתיות ושאינן תרופתיות) בשל האפקט הסינרגיסטי והאדיטיבי
- שימוש באנלגזיה בדרגת השפעה עולה (ראו בהמשך)
- ריכוז ותכנון הפעולה/ות לזמן אחד, תוך מתן תשומת לב למצבו של הפג/יילוד
- תכנון מועד הדקירה והימנעות מדקירה בזמן שינה או האכלה. הזמן העדיף לדקירות הוא כאשר הפג/יילוד ערני ורגוע
- הגבלת מספר ניסיונות כושלים
- שימוש בדוקרנים לדקירת עקב עדיף על פני דקירת עקב באמצעים אחרים
- שימוש מושכל בדקירת וריד המכאיבה פחות מדקירת עקב
סוגי ההתערבויות והטיפולים
התערבויות סביבתיות והתנהגותיות[22][23][24][25]
בכל פעולה הקשורה בכאב או דחק, יש לשלב התערבויות סביבתיות והתנהגותיות שמטרתן לקדם את נוחיותו של הפג/יילוד (comfort measures).
להלן עקרונות מנחים להתערבויות מסוג זה (לדוגמה דגימת דם, הרכבת עירוי, שאיבת הפרשות):
- יש לבצע את ההליך באווירה נינוחה, ככל שניתן, תוך הפחתת גירויים עוינים (מניעת תאורה חזקה ישירה ורעש) בסביבת הפג/יילוד. כשנדרשת תאורה בעוצמה גבוהה, יש לספקה באופן המיטבי לביצוע ההליך תוך הגנת עיני הפג/יילוד על ידי כיסוין בבד עדין. מומלץ, להשתמש בתאורה ממוקדת ומתכווננת
- יש לגשת לפג/יילוד בהדרגה, להימנע ממגע או שינויי מנח פתאומיים ובכך, לאפשר הסתגלות
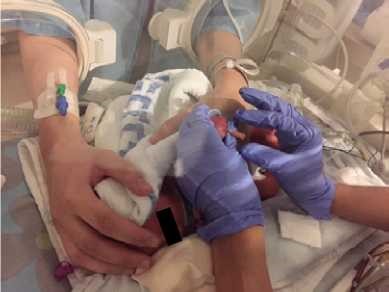
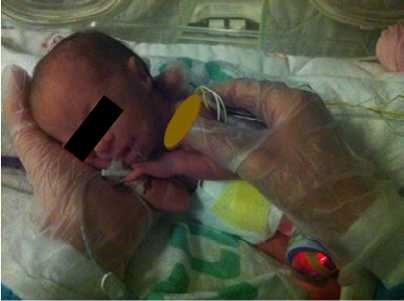
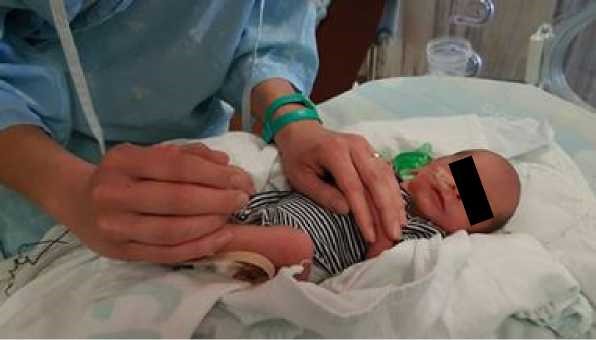
- יש להשתמש במנחים המקדמים את נוחות התינוק: גפיים בכיפוף קל ולכיוון קו האמצע, גו מעוגל, ראש וצוואר בקו המשכי עם הגו. בהליך שיש בו צורך למתוח את אחת הגפיים, יש להמשיך להקפיד על המנח ולהימנע ממתיחה קיצונית של הגפה. להשתמש בתיחום הפג/יילוד בידיים (containment, facilitated tucking) ובעיטוף עדין בשמיכה לתמיכה במנח התינוק (ראו תמונות מספר 1–3)
- בהליכים מתוכננים, יש לבדוק האם ההורים מעוניינים לתמוך בתינוק, ולהנחותם בהתאם
- מומלץ, שכל הליך יערב אדם שתפקידו לשמור על נוחות ורגיעת הפג/יילוד לפני ההליך, במהלכו ובסיומו. זוג ידיים נוספות נדרש, כדי לבצע את ההתערבויות ההתנהגותיות באופן מיטבי. כשההנחיה רגישה ונכונה, ההורים יכולים למלא תפקיד זה במגוון הליכים
- יש לתכנן את ההליכים השונים תוך התחשבות בתופעת הדחק המצטבר הנובע מריבוי הליכים המתבצעים בזמן קצר. בריכוז פעולות, יש לשקול בקפידה, האם הפג/יילוד מסוגל לעמוד ברצף הפעולות/בדיקות, ולאפשר פסק זמן (time out) להתאוששות ביניהן על פי סימני התינוק במטרה למנוע אפקט העצמה (wind up)
- לאחר ההליך, יש לעודד את הרגעת הפג/יילוד על ידי ההורים (עיטוף, תיחום עם ידיים, ערסול, החזקה עור לעור)
- בהליך המערב מתן תמיסה ממותקת כגון סוכרוז, יש להציע מציצה, לשלב תמיכה מוטורית להשגת של תנוחה אסופה (פלקסורית), ולהמתין כ-2 דקות טרם הדקירה
התערבויות לא תרופתיות (פרוט בהמשך)[26]
הטיפולים הבאים נחשבים ל"טיפולים שאינם תרופתיים". לשילובם עם התערבויות אחרות, השפעה סינרגיסטית: סוכרוז, הנקה, מציצה, מגע עור אל עור ("קנגורו").
טיפולים תרופתיים (פרוט בהמשך)
- טיפול טופיקלי כגון משחת Lidocaine/Prilocaine (EMLA/DuoCaine)
- מתן Acamol והימנעות מ-NSAIDS
- טיפול תוך ורידי כגון Morphine או Fentanyl
- מתן תת-עורי כגון Lidocaine
- הרדמה מלאה
לפירוט הטיפולים התרופתיים שלעיל ראו נספח מספר 2.
סיכום והמלצות על פי פעולות שכיחות (*)[26][27]
| פעולה | המלצות למניעת כאב |
|---|---|
| שאיבת הפרשות (סקשן) | סוכרוז + התערבויות לא תרופתיות |
| הכנסת זונדה[28][29] | סוכרוז + התערבויות לא תרופתיות |
| הסרת קיבוע | שימוש במסיר דבק ייעודי + התערבויות לא תרופתיות |
| דקירת עקב[30] | חימום העקב עם כרית ייעודית טרם הפעולה, שימוש בדוקרן ייעודי סוכרוז או הנקה ישירה אם מדובר בפעולה בודדת + התערבויות לא תרופתיות מומלץ, להימנע, ככל האפשר, מסחיטת העקב, פעולה זו מסבה כאב רב |
| דקירת וריד פריפרי[30] | סוכרוז או הנקה ישירה אם מדובר בפעולה בודדת + התערבויות לא תרופתיות |
| הכנסת צנטר ורידי או עורקי מלעורי (PICC)[31] | סוכרוז+ התערבויות לא תרופתיות משחה טופיקלית Lidocaine/Prilocaine (EMLA / DuoCaine) יש לשקול מתן אופיואיד בהכנסת צנתר מרכזי במונשמים |
| צנטר טבורי | התערבויות לא תרופתיות, לשקול סוכרוז. מומלץ, להימנע מתפר עור |
| הזרקה לשריר/לתת עור | סוכרוז או הנקה ישירה אם מדובר בפעולה בודדת + התערבויות לא תרופתיות + אלחוש מקומי Lidocaine/Prilocaine
(EMLA / DuoCaine) |
| ניקור מתני (LP - lumbar Puncture) דיקור שלפוחית שתן[26] |
סוכרוז + התערבויות לא תרופתיות + משחה טופיקלית Prilocaine/Lidocaine |
| החדרת נקז[26] | סוכרוז + Lidocaine לתת עור + לשקול מתן אופיאטים עדיפות לאופיאטים בעלי השפעה מהירה בזמן החדרת הנקז (בתינוקות לא מונשמים לתת מינון נמוך) יש לשקול טיפול באופיאטים במשך המצאות הנקז |
| חבישות/טיפול בפצעים/ ביופסיה | סוכרוז + התערבויות לא תרופתיות, אקמול, יש לשקול אופיאטים במצבים מורכבים |
| בדיקת עיניים ל-ROP[32][33][34] | סוכרוז + התערבויות לא תרופתיות + אלחוש מקומי בטיפות מתן דגש על שימוש בתאורה עמומה לפני ואחרי הבדיקה |
| טיפול לייזר/אווסטין ל-ROP[33] | אלחוש מקומי + יש לשקול מתן Atropine בשילוב עם סדציה קצרה לאחר הטיפול, paracetamol או אופיאטים בהתאם למדדי כאב |
| מניעת כאב לאחר ניתוח[35] | שילוב תרופות עדיף: אופיאטים + paracetamol + טיפול מקומי |
| דלקת מעי נמקית NEC
(Necrotizing Enterocolitis)[36] |
מצב ייחודי זה קשור בכאב עז אך בתנועתיות מופחתת של המטופל ולכן, עלול להטעות ולהוביל למדד כאב נמוך ולטיפול שאינו תואם את חומרת הכאב האמיתי במצב לאחר ניתוח, שילוב של אופיאטים וסדטיבים (באופן מתמשך) וכן, אקמול תוך ורידי |
| פרמדיקציה לצנרור קנה אלקטיבי[37][38][39][40][41][20][42] | צינרור קנה ללא שימוש באנלגזיה / סדציה צריכים להתבצע רק במקרי חרום.
פרהמדיקציה צריכה לכלול נוגדי כאב (Remifentanil, Morphine, Fentanyl, Propofol ,Ketamine) |
(*) בכל פעולה מומלצות התערבויות סביבתיות והתנהגותיות (ראו סעיף א').
נספח מספר 1. סולם הערכת כאב וסדציה לתינוקות ופגים: N-PASS 17
| כלי הערכה | הערכת כאב | הערכת סדציה | |||
|---|---|---|---|---|---|
| 2 | 1 | 0 | 1 | 2 | |
| בכי/אי שקט | בכי בקול גבוה, או שקט, מתמשך, לא נרגע | אי שקט/ בכי לפרקים, ניתן להרגעה | ללא סימני כאב/ ללא סדציה | בוכה או מייבב מעט בתגובה לפעולה מכאיבה | אינו בוכה בתגובה לפעולה מכאיבה |
| מצב התנהגותי ושינה (STATE) | התקשתויות ובעיטות או לחלופין לא מתעורר/זז (ללא סדציה) | אי שקט, מתפתל, יקיצות תכופות | ללא סימני כאב/ ללא סדציה | תגובה מינימלית לגירוי, מיעוט תנועות ספונטאניות | אינו מתעורר לגירוי אין תנועות ספונטאניות |
| הבעות פנים | הבעות כאב מתמשכות | הבעות כאב לסירוגין | ללא סימני כאב/ ללא סדציה | הבעה מינימלית כתגובה לגירוי | נטול הבעה |
| טונוס ותנועות גפיים | מתמשך: איגרוף/פריסת אצבעות ובהונות. הגוף אינו נוקשה |
לסירוגין: איגרוף/פריסת אצבעות ובהונות. הגוף אינו נוקשה | ללא סימני כאב/ ללא סדציה | רפלקס אחיזה חלש | ללא רפלקס אחיזה טונוס נמוך |
| סימנים חיוניים: דופק, נשימות, לחץ דם, סטורציה | עליה של < 20 אחוזים מבסיס ירידת סטורציה מעבר ל-75 אחוזים, התאוששות איטית |
עליה 20-10 אחוזים מבסיס ירידת סטורציה ל-85-76 אחוזים התאוששות מהירה (פחות מ-2 דקות) |
ללא סימני כאב/ ללא סדציה | <10 אחוזים שינוי מבסיס בתגובה לגירוי | אין שינוי בתגובה לגירוי מיעוט נשימות עצמוניות - אפנאה |
בפגים >30 שבועות יש להוסיף נקודה.
- הערכת כאב
- ניקוד מ-0 ועד 2+ לכל מדד
- לפגים ניתן ניקוד נוסף בשל יכולתם המוגבלת להראות סימני כאב התנהגותיים
- סכום הניקוד נע בין 0 ל-11+
- טיפול / התערבות מומלצים כשהתוצאה <3+
- בטרם ביצוע פעולות מכאיבות מומלץ, להתערב טרם ההגעה ל-3+
- המטרה בעת ביצוע פעולה מכאיבה להגיע ל->3
- המלצה להעלות תכיפות לכל 2–4 שעות בשימוש בסולם כאשר:
- המצאות נקז חזי העלול להוביל לכאב בעת תנועה
- טיפול בסדציה או אנלגזיה
- 30-60 דקות לאחר מתן אנלגזיה לכאב
- לאחר פעולה כירורגית
סולם הערכת כאב - PIPP-R[37]:
| מדדי יילוד | קידוד | תוצאת בדיקת היילוד | |||
|---|---|---|---|---|---|
| 0 | +1 | +2 | +3 | ||
| השינוי בקצב הלב (פעימות/ דקה) בסיס | 0-4 | 5-14 | 15-24 | 24< | |
| ירידה בסטורציה (%) בסיס | 0-2 | 3-5 | 6-8 | >8 או עלייה ב-02 | |
| קמטוטי מצח (שניות) | ללא (>3) | מינימלי (3–10) | בינוני (11–20) | מקסימלי (<20) | |
| כווץ עיניים (שניות) | ללא (>3) | מינימלי (3–10) | בינוני (11–20) | מקסימלי (<20) | |
| קמט פה-אף (שניות) | ללא (>3) | מינימלי (3–10) | בינוני (11–20) | מקסימלי (<20) | |
| (*) ערך ביניים | |||||
| שבוע הלידה (שבועות+ ימים) | >36 שבועות | 32 עד 35+6 שבועות | 28 עד 31+6 שבועות | 28 שבועות | |
| מצב ערות | פעיל וערני | שקט וערני | פעיל וישן | שקט וישן | |
| (**) ערך סופי | |||||
(*) ערך ביניים למדדים התנהגותיים ופיזיולוגיים. אם ערך ביניים <0, יש להוסיף ניקוד על שבוע הלידה ומצב ערנות.
(**) ערך סופי: ערך ביניים + ניקוד שבוע הלידה + ניקוד מצב ערנות.
- הנחיות לקידוד
- שלב 1 - צפה בתינוק 15 שניות במנוחה, הערך מדדים חיוניים (קצב לב מקסימלי, סטורציה מינימלית) ומצב ערנות
- שלב 2 - צפה בתינוק 30 שניות אחרי הפעולה והערך את השינוי במדדים חיוניים (דופק מקסימלי, סטורציה מינימלית, משך השינוי בהבעות הפנים)
אם יש צורך בהעלאת החמצן הניתן לתינוק טרם או במהלך הטיפול, יש לתת 3 נקודות על החלק של ירידה בסטורציה - שלב 3 - נקד עבור שבוע הלידה ומצב ערנות באם ערך הביניים < 0
- שלב 4 - חשב ערך סופי על ידי חיבור ערך הביניים + שבוע הלידה + מצב ערות
נספח מספר 2 - פרוט בנוגע לסוכרוז ותרופות שכיחות המשמשות בפגיות בישראל ומחוץ לה
סוכרוז[30][43][44][45][46][47][48]
- דרך הפעולה המשוערת של סוכרוז היא מסלולים אופיואידים. הספרות חלוקה באשר לאופן השפעתו (ישירה על אזורי מח סנסוריים או רק דיכוי התגובה ההתנהגותית לכאב)
- מתאים כטיפול בתינוקות מונשמים ושאינם מונשמים לפני שאיבת הפרשות, הכנסת זונדה, בדיקת עיניים, חיסון, החלפת חבישה או ביצוע כל פעולה מכאיבה הקשורה בפגיעה בשלמות העור
- המינון המקובל של סוכרוז 30-24 אחוזים הוא 0.05 עד 0.5 מיליליטר/למנה לפגים ו-1–2 מיליליטר/למנה ליילודים
- דווח כי מנות מינימליות של 0.1 מיליליטר של סוכרוז 24 אחוזים היו יעילות באותה מידה כמו מנות גדולות יותר
- יש לתת על הקצה הקדמי של הלשון כשתי דקות לפני כל דקירה, בשילוב עם מציצה במידת האפשר
- למנות חוזרות השפעה אנלגטית טובה יותר
- מתן סוכרוז בשילוב הטיפולים ה"לא תרופתיים" המתוארים לעיל מעצים את האפקט האנלגטי
- לא מתוארות תופעות לוואי למעט, השתנקויות בודדות וירידות חולפות בסטורציה ודופק
- סוכרוז אינו מעלה סיכון להיפרגליקמיה או NEC
- המידע בספרות על ההשפעות לטווח ארוך של מנות חוזרות של סוכרוז, אינו מספק. מחקר אחד דיווח כי מתן מנות חוזרות של סוכרוז בפגים מתחת לשבועות 31 נמצא בקורלציה עם תוצאות פחות טובות של מדדים מוטוריים וערנות בשבועות 36 ושבועות 40 מתוקן
- יש לתעד מתן סוכרוז בגיליון הרפואי (מועד ומינון)
- יש להימנע ממתן סוכרוז שלא למטרת מניעת כאב
- ביילודים, במועד שימוש בחלב אם/ הנקה, פורמולה או גלוקוז 30 אחוזים מהווים תחליף (כנראה פחות יעיל) לסוכרוז אין מספיק מידע בנוגע ליעילות תחליפים אלו בפגים
משחת (Lidocaine/Prilocaine (EMLA/DuoCaine[35][49][50][51][52][53]
תערובת של Prilocaine + 2.5% Lidocaine 2.5%
- מתאים לאלחוש לפני מילה, החדרת עירוי, לקיחת דם ורידי/עורקי או ניקור מתני
- אינו מומלץ, בדקירת עקב בשל וזוקונסטריקציה מקומית ובנוסף, בהליך זה, עיקר הכאב נובע מהליך הסחיטה
- מחקרים לא הראו יתרון לטיפול זה ביחס לטיפולים שאינם תרופתיים
- תופעת לוואי עיקרית היא חוורון מקומי ומתהמוגלובינמיה
- יש למרוח על עור שלם ובריא בלבד במקום הדקירה המתוכנן ועל שטח המוגבל למקום הדקירה
- כמות מקסימלית למריחה ביילודים - 1 גרם, שטח מריחה מקסימלי הוא 10 סנטימטר רבוע
- יש למרוח כ-60 דקות טרם ביצוע הפעולה ולכסות במשטח בלתי חדיר כגון ניילון
- אין לתת מנה נוספת במשך 24 שעות
- אין למרוח על ריריות, סמוך לעיניים, באוזן התיכונה או על פצעים
- יעילותו בדקירת עורק פחותה
- יש להימנע משימוש במקביל בתרופות אחרות הקשורות במתהמוגלובנמיה
- אין התווית נגד למריחת קרם בילדים ובתינוקות עם חסר באנזים G6PD, במינון המקובל
- השימוש בפגים צעירים מ־37 שבועות שגילם >3 חדשים לא נבדק דיו ועל כן, לא ניתן להמליץ על טיפול זה באוכלוסיות אלו (>3 חדשים או >37 שבועות). אם ניתן, לשקול למרוח כמות של כ-0.5 גרם
- ניתן להשתמש ביילודים שנולדו פגים לאחר הגעתם ל-37 שבועות גיל מתוקן, אין לתת מנה נוספת במשך 24 שעות
תרופות סיסטמיות
טיפול תרופתי סיסטמי בתרופות מקבוצות האופיאטים ושאינם אופיאטים משפיע על מערכת העצבים המרכזית אשר נמצאת בשלבי התפתחות קריטיים בפגים. המידע על השפעתן של חלק מתרופות אלה לטווח ארוך אינו ברור, ומבוסס בעיקר על עבודות בבעלי חיים. האיגוד האמריקאי לרפואת ילדים (AAP - American Academy of Pediatrics) ממליץ, על שימוש זהיר תוך מודעות להיות מערכת העצבים בשלב רגיש וקריטי בהתפתחותה. הפרמקוקינטיקה והפרמקודינמיקה של תרופות אלו ביילודים ופגים שונה מאשר בבוגרים, בשל פינוי שונה בכבד ובכליה ומשתנה בהתאם לשבועות היריון שונים.
NSAID's
אינן מומלצות לשימוש אנלגטי בתינוקות ובפגים עקב החשש להפרעה בפרפוזיה מוחית וריאתית.
Paracetamol) Acetaminophen)[54][55][56][57]
- השפעה אנלגטית חלשה ואנטיפירטית
- אופן הפעולה מובן חלקית ומשלב אנלגזיה מרכזית במסלולים סרוטונינוגניים יורדים, דיכוי סינתזה של פרוסטאגלנדינים, מטבוליטים פעילים המשפיעים על רצפטורים קנאבינואידים, וגם אפקט אינהיביטורי לא סלקטיבי על COX פריפרי
- המטבוליזם תלוי גיל וכולל מטבוליזם ראשון בכבד ופינוי בכליה. 10-8 אחוזים עובר חימצון למטבוליט טוקסי (NAPQI)
- במתן תוך ורידי (אך לא רקטלי) בשילוב עם אופיאטים, קיים אפקט "חוסך אופיאטים" (opioid sparing effect) המאפשר מינון נמוך יחסית של אופיאטים להשגת אנלגזיה
- מתן תוך ורידי בשילוב עם אופיאטים יכול להתאים לטיפול בכאב כרוני בדרגה בינונית (אינו מתאים לטיפול בכאב חריף כגון החדרת עירוי או נקז)
- השפעה כ-30 דקות לאחר מתן
- מומלץ, לאחר ניתוחים קטנים, ברית מילה (בשילוב עם אחרים) וכדומה
- יכול לסייע בשלבי גמילה מאופיאטים ומאפשר הפחתת ריכוז האופיאטים
- תופעות הלוואי בפגים ובתינוקות נדירות, נדרשת ערנות לאפשרות של פגיעה כלייתית ו/או כבדית
- התוויות נגד: מחלת כבד חריפה
- התוויה ללקיחת רמות בדם- חשד להרעלה
- תופעות לוואי ארוכות טווח עדיין נלמדות (בפרט הקשר לאטופיה, פריון והפרעות נוירו-התנהגותיות)
מינונים: ראו NEOFAX.
Opiates[20][39][47][58][59][60][61][62][63][64][65][66][67][68]
- מנגנון פעולה בעיקר דרך קלטנים אופיואידים
- פרמקוקינטיקה דומה לזו שבמבוגרים, אך בתינוקות ובפגים זמן מחצית החיים ארוך מאשר במבוגרים, וזה אף ממשיך לעלות במתן מתמשך. הסיבה לכך, היא מטבוליזם איטי משני לפעילות איטית של האנזים CYP3A4, חוסר בשלות של הכבד, וכן, תפקוד כלייתי שאינו בשל
- השפעתם מאלחשת ומרדימה והחלון התרפויטי רחב
- יעילים למניעה וטיפול בכאב בינוני- קשה אך לא כאב חד (דקירת עקב)
- מומלץ, להגיע למינון טיפולי בו נצפית השפעה מאלחשת/ סדטיבית ולאחריה להפחית מינונים למינימום הנדרש
- יש לשאוף לטפל במינון הנמוך ביותר שיוביל להפחתת כאב והסיבוכים הקשורים בו
- הספרות הרפואית חלוקה באשר להעדפת הזלפה קבועה לעומת בולוסים, מומלץ, לכל מחלקה לגבש מדיניות בנושא. היתרון בהזלפה קבועה - שליטה טובה בכאב אך התפתחות עמידות מהירה ביחס לבולוסים. במתן בולוסים שליטה פחות טובה בכאב וסיכוי גבוה יותר למצב של תסמונת גמילה במיוחד, כשהדווח על הבולוסים אינו אחיד
- ניתן לשלב טיפול מתמשך עם מתן בולוסים, אולם, שיטה זו קשורה בסיכון למתן מינונים גבוהים במיוחד, של אופיאטים ולהתפתחות של סבילות (tolerance)
- תופעות הלוואי העיקריות קשורות בירידה בלחץ דם וברדיקרדיה, כמו כן, אצירת שתן ולכן, בעת מתן יש לעקוב באופן הדוק אחר מצב הנשימה והמצב הקרדיווסקולרי של המטופל וכן, מתן שתן ויציאות
- בפגים מונשמים, נמצא שאופיאטים מאריכים את משך ההנשמה, וכן, את הזמן להתחלת כלכלה. מאידך, הם אינם מעלים את שכיחות התמותה, IVH או PVL וגם לא משפיעים לרעה על התפתחות לטווח ארוך. לאור ממצאים אלה בפגים (אך לא בתינוקות במועד) לא מומלץ, להשתמש באופיאטים כטיפול שגרתי מתמשך בעת הנשמה
- הספרות חלוקה באשר להשפעת אופיאטים (Fentanyl, Morphine) על נפח המח, הצרבלום. וההתפתחות. מאחר שחשיפה לכאב קשורה גם היא בהשפעות שליליות מהסוג הנזכר למעלה, ההמלצה היא למנוע כאב ודחק תוך שימוש במינונים הנמוכים ביותר האפשריים. אין עדיפות ל-Fentanyl לעומת Morphine
- מניעת סבילות (Tolerance)
- עמידות לאופיאטים מתפתחת בתוך 3–5 ימים. לכן, בשימוש מעל 5 ימים יש להיות ערניים לצורך בהעלאת מינונים להשגת מניעת כאב או לחלופין, בהחלטה על הפסקת טיפול, יש צורך בגמילה הדרגתית תוך ערנות לתסמיני גמילה
- הפחתת עמידות מומלצת על ידי התאמת המינונים. עדיף להתחיל עם מינון ראשוני גבוה להשגת שליטה טובה בכאב ובהמשך, להוריד מינונים בהתאם לחומרת הכאב, כפי שנמדד על פי סולם הכאב
- שימוש בתרופות קצרות טווח לטיפול בכאב פרוצדורלי ותרופות ארוכות טווח לכאב מתמשך
- גמילה
מומלץ, להשתמש בפרוטוקול גמילה בכל שימוש מעל 5 ימים.
בשימוש נפוץ נמצאים Morphine ו-Fentanyl:
- מנגנון פעולה: אגוניסט אופיאטי. קשירה לרצפטורים אופיאטיים במערכת העצבים המרכזית, גורם לסטימולציה של הרצפטורים. גורם לשחרור היסטמין ומדכאי הטון האדרנרגי
- המטבוליזם מתרחש בכבד ואינו תלוי בתפקוד כלייתי. המטבולי הפעיל הוא M6G, בעל פעולה חזקה של דיכוי מערכת הנשימה ומשכך כאבים
- זמן מחצית חיים משתנה באופן ניכר: פגים 10–20 שעות, יילודים בממוצע 7.6 שעות (טווח נע בין 13-4.5 שעות)
- יש להתאים מינון בהפרעה בתפקודי הכליה (מתונה 75 אחוזים, חמורה 50 אחוזים) והכבד
- הפרמקודינמיקה (השפעה ותופעות לוואי) שונה בין המטופלים. דהיינו, למינונים זהים השפעה שונה על פרטים שונים
- השפעת התרופה חלה כ-5–20 דקות לאחר המתן ומשך האלחוש עד 9 שעות
- מומלץ, לשימוש בפעולות בהן ניתן להמתין לתחילת ההשפעה וכן, כאשר דרושה השפעה ממושכת
- מומלץ, בתינוקות העוברים ניתוחי בטן ונמצאים בסיכון לעלייה בלחץ תוך בטני
- מינונים: ראו NEOFAX
- הטיפול בתופעות הלוואי: Naloxone
- אופיאט סינתטי, תחילת השפעה תוך דקות בודדות ונמשכת עד כשעה
- פרמקוקינטיקה: וריאביליות גבוהה בזמן מחצית חיים T1/2, 15-1 שעות. מתארך באי ספיקת כבד
- בהשוואה למורפין, דווחו פחות תופעות לוואי (תת לחץ דם, שינויים בתנועתיות המעי, אצירת שתן)
- ביחס למורפין, הסבילות מתפתחת מהר יותר ותסמיני הגמילה משמעותיים יותר
- הזרקה מהירה של התרופה עלולה לגרום ל-chest wall rigidity המתבטאת בהתכווצות שרירי בית החזה ולרינגוספזם. מניעת מצב זה אפשרית על ידי מתן איטי על פני 3–5 דקות במיהול של 1 mcg/ml (מיקרוגרם למיליליטר)
- הטיפול בתופעות הלוואי: Naloxone
- יתרון בכאלו הסובלים מתת לחץ דם, ופגיעה בתנועתיות המעי
- קיימים דווחים על מתן Fentanyl באף. אך המידע בתינוקות ובפגים אינו מספק. אם מתקבלת החלטה על טיפול בדרך זו המינון המומלץ, דומה למינון התוך ורידי או 0.1-0.3 ml בכל נחיר
- ניתן לשימוש כאשר יש צורך באלחוש מהיר/טיפול פליאטיבי ואין וריד פתוח
תרופות נוספות ממשפחת האופיאטים עליהם לא נרחיב במסגרת זו הם Remifentanil[78][79] שהוא נגזרת של Fentanyl אך פעילותו קצרה יותר וכן, Hydromorphone[80] שהוא פוטנטי פי 5–7 מ-Morphine (נדרש נפח מאוד קטן להזרקה לקבלת אפקט) ועיקר השימוש בו הוא כאלטרנטיבה למורפין בכאב בינוני עד חמור, במיוחד, במקרים הדורשים רוטציה אופיאטית.
- גמילה מטיפול ממושך באופיואידים[63]
- דרושה ערנות לתסמונת גמילה המתבטאת באי-שקט ופעילות יתר של מערכת העצבים האוטונומית
- בטיפול קצר מ־5-3 ימים ניתן להפסיק ללא תהליך גמילה
- בטיפול מתמשך אך < 5 ימים: מומלץ, להפחית מינון בהדרגה דהיינו, ב-25 אחוזים (מהמינון הראשון) כל 8–10 שעות ולהפסיק כאשר המינון הוא רבע מהמינון הטיפולי המומלץ
- בטיפול שנמשך > 5 ימים מומלץ, להפחית ב-10 אחוזים (מהמינון הראשון) כל 10–12 שעות ולהפסיק כשמגיעים לרבע מהמינון הטיפולי המומלץ
- לאחר ניתוחים גדולים המלווים בכאב מתמשך, ניתן להוסיף Acetaminophen בשל השפעתו כ-Opioid Sparing
- כאשר מתבצעת גמילה ממספר תרופות לדוגמה אופיאט ו-Benzodiazepines - ניתן לגמול כמתואר לעיל אך לא בו זמנית. לדוגמה, בערב אופיאט ו-12 שעות אחר כך בנזודיאזפין. ניתן לשלב גם Clonidine בתהליך הגמילה
- מומלץ, להעריך את התגובה לגמילה בסולמות ייעודיים, לדוגמה Finnegan
תרופות סדטיביות
הן תרופות המאפשרות סדציה, מפחיתות חרדה, ואמנזיה, אולם, אינן מפחיתות כאב ואף עלולות למסך סימני כאב. תרופות אלו עלולות להחמיר דיכוי נשימתי ותת לחץ דם ולכן, יש לנתר את המטופלים. בנוסף השפעתן על יילודים ופגים לא נלמדה דייה.
Midazolam[21][66][81][82][83][84]
- בנזודיאזפין קצר פעולה, תחילת השפעה מהירה
- תכונות סדטיביות ואנטיאפילפטיות עקב עלייה ב-GABA, ללא אפקט אנלגטי
- משך פעולה: 6-2 שעות
- זמן מחצית חיים כ-4–6 שעות ביילודים במועד אך בפגים/יילודים עם תפקוד כבדי לקוי, עלול להתארך עד 22 שעות
- בפגים במתן מתמשך, תרופה זו נמצאה קשורה בעלייה בשיעורי תמותה, דימומים מוחיים קשים ו-PVL. לאור אלו ומתוך מידע מבעלי חיים, ה-AAP (2016) ו-COCHRANE (2017) ממליצים, להימנע משימוש מתמשך
- לא ידוע על קשר לתחלואות המתוארות לעיל בשימוש חד פעמי, לדוגמה טרם אינטובציה ובשילוב עם אנלגזיה (אופיאט)
- שילוב עם אופיאט, יכול לאפשר מינונים נמוכים של אופיאטים ותופעות הלוואי הקשורות בהם
מינון: ראו NEOFAX
תופעות לוואי: דיכוי נשימה ותת לחץ דם, תופעות אלו נפוצות יותר בשימוש במקביל לאופיואידים, או לאחר בולוס מהיר
התרופות Clonidine ,Propofol ,Ketamine ו-Dexmedetomidine
הן תרופות המשמשות למניעת כאב בילדים. הניסיון בפגים וביילודים מועט וקיים סיכון תאורטי להיותן נוירוטוקסייות, עם זאת, הדיווחים בספרות על שימוש בהן בפגיות עולים ולכן, החלטנו להציגן בקצרה כאלטרנטיבות אפשריות למצבי קיצון. יש לנקוט בזהירות רבה בשימוש בהן שכן, לא ניתן לשלול אפקט נוירוטוקסי.
Ketamine[85][86][87][88][89]
- משמש לסדציה ואנלגזיה לפני פעולות (procedural sedation)
- נקרא גם dissociative anesthetic וגורם למצב דמוי "טראנס" ואמנזיה
- הוא אנטגוניסט לא תחרותי לקולטנים של NMDA
- התווית נגד: מצבים בהם עלייה בלחץ הדם עלולה לסכן
- השימוש במטופלים עם מחלת ריאה פעילה או בפרוצדורות כגון אנדוסקופיה, מעלה סיכון ל-laryngospasm. עלול לגרום לעלייה בלחץ תוך גולגולתי. מתן I.V מהיר או מינון יתר עלולים לגרום לדיכוי נשימתי או אפניאה
- השפעה תוך כ-30 שניות למשך עד 5–10 דקות
Propofol[90][91][92][93][94][95][96][97]
- מנגנון הפעולה לא מובן עד הסוף, ככל הנראה השפעה דרך GABA נוירוטרנסמיטר
- עובר מטבוליזם בעיקר דרך קוניוגציה בכבד כשלב ראשון ובהמשך פינוי דרך הכליות
- התווית נגד: אלרגיה לביצים, סויה
- משמש לסדציה ומפחית חרדה לפני פעולות כואבות ומעוררות דחק כגון אינטובציה ביילודים
- השפעתו מהירה ומשך ההשפעה קצר (10–20 דקות)
- בשילוב עם סדטיבים ואופיאטים אחרים מאפשר שימוש במינון נמוך של midazolam ,ketamine, opiates) propofol)
- בתינוקות יכול לשמש לאינטובציה בשילוב עם מינון נמוך של fentanyl
- תופעות לוואי, במיוחד בהזרקה מהירה, כוללות דיכוי נשימתי, הפרעות קצב (טכיקרדיה, ברדיקרדיה), תת-לחץ דם או יתר לחץ דם, כאב בעת ההזרקה, אי שקט, רעד
- יש להימנע מהפסקה פתאומית שכן, יכולה להוביל לאי שקט, ברדיקרדיה, איריטביליות והתנגדות למכשיר הנשמה ביילודים המונשמים
clonidine ו- Dexmedetomidine[21][84][98][99][100][101][102][103][104][105][106][107][108][109]
- התרופות פועלות על קולטנים אדרנרגים מסוג a2 וכנראה, משפיעות ספציפית על פעילות נוירונים ב-locus ceruleus במח ומביאות להפחתת הפרשת norepinephrine ללא אפקט של דיכוי נשימתי
- משמשות לסדציה, אנלגזיה ולהפחתת חרדה לפני פעולות פולשניות
- יתרונן בכך, שעוזרות בהפחתת מינוני תרופות המשמשות לסדציה ואנלגזיה וכן, בעת גמילה מאופיאטים
- ייתכן אפקט נוירופרוטקטיבי ואנטי-אינפלמטורי
- Dexmedetomidine פעילות יותר ספציפית על קולטני a2
- תופעות לוואי קשורות בברדיקרדיה וירידה בלחץ הדם (האחרון מוגבר ע״י שימוש במשתנים ובתרופות המורידות לחץ דם(
- הפינוי ביילודים איטי ביחס למבוגרים ויכול להגיע ל-24 שעות, עקב מערכת מטבולית לא בשלה
- ובאי ספיקת כליות להתארך יותר
- עלולות לגרום להולכה ירודה בין הפרוזדורים לחדרי הלב (בחולים הסובלים ממחלות של מערכת ההולכה או מטופלים בתרופות המשפיעות על ההולכה(
- קיים רק מחקר רנדומלי אחד שבדק את יעילות והשפעת הטיפול ביילודים מונשמים. לא נמצאו תופעות לוואי וגם לא יתרונות
- הפסקת הטיפול איטית ולא פתאומית עקב תופעות כמו, אגיטציות, רעידות, עלייה פתאומית בלחץ דם
Phenobarbital[110]
אינו אנלגטי אלא סדטיבי ובנוסף, מעלה תגובה לכאב, לכן, אין להשתמש בתרופה לסדציה או לטיפול בכאב
נספח מספר 3 - הטיפול התומך - גישה כוללת לתינוקות בעלי פרוגנוזה קשה/ במצבים מסכני חיים
ביבליוגרפיה והערות שוליים
- ↑ Prevention and management of pain in the neonate: An update. Adv Neonatal Care. 2007. doi:10.1097/01.ANC.0000278214.49133.7d.
- ↑ Ruda MA, Ling QD, Hohmann AG, Peng YB, Tachibana T. Altered nociceptive neuronal circuits after neonatal peripheral inflammation. Science )80- (. 2000. doi:10.1126/science.289.5479.628
- ↑ Anand KJS, Scalzo FM. Can Adverse Neonatal Experiences Alter Brain Development and Subsequent Behavior? Neonatology. 2000. doi:10.1159/000014197.
- ↑ Anand KJS. Clinical importance of pain and stress in preterm neonates. Biol Neonate. 1998. doi:10.1159/000013953.
- ↑ Johnston CC, Stevens BJ. Experience in a neonatal intensive care unit affects pain response. Pediatrics. 1996. doi:10.1542/peds.107.1.105.
- ↑ Brummelte S, Grunau RE, Chau V, et al. Procedural pain and brain development in premature newborns. Ann Neurol. 2012. doi:10.1002/ana.22267.
- ↑ Valeri BO, Holsti L, Linhares MBM. Neonatal pain and developmental outcomes in children born preterm: A systematic review. Clin J Pain. 2015. doi:10.1097/AJP.0000000000000114.
- ↑ Eckstein Grunau R. Neonatal Pain in Very Preterm Infants: Long-Term Effects on Brain, Neurodevelopment and Pain Reactivity. Rambam Maimonides Med J. 2013. doi:10.5041/RMMJ.10132.
- ↑ Vinall J, Grunau RE. Impact of repeated procedural pain-related stress in infants born very preterm. Pediatr Res. 2014. doi:10.1038/pr.2014.16.
- ↑ Ranger M, Chau CMY, Garg A, et al. Neonatal Pain-Related Stress Predicts Cortical Thickness at Age 7 Years in Children Born Very Preterm. PLoS One. 2013. doi:10.1371/journal.pone.0076702.
- ↑ Newnham CA, Inder TE, Milgrom J. Measuring preterm cumulative stressors within the NICU: The neonatal infant stressor scale. Early Hum Dev. 2009. doi:10.1016/j.earlhumdev.2009.05.002.
- ↑ Bellieni C V., Iantorno L, Perrone S, et al. Even routine painful procedures can be harmful for the newborn. Pain. 2009. doi:10.1016/j.pain.2009.08.025.
- ↑ Cruz MD, Fernandes AM, Oliveira CR. Epidemiology of painful procedures performed in neonates: A systematic review of observational studies. Eur J Pain (United Kingdom). 2016. doi:10.1002/ejp.757.
- ↑ Carbajal R, Rousset A, Danan C, et al. Epidemiology and treatment of painful procedures in neonates in intensive care units. JAMA - J Am Med Assoc. 2008. doi:10.1001/jama.300.1.60.
- ↑ 15.0 15.1 Carbajal R, Eriksson M, Courtois E, et al. Sedation and analgesia practices in neonatal intensive care units )EUROPAIN(: Results from a prospective cohort study. Lancet Respir Med. 2015. doi:10.1016/S2213- 2600)15(00331-8.
- ↑ Gibbins S, Stevens BJ, Yamada J, et al. Validation of the Premature Infant Pain Profile-Revised )PIPP-R(. Early Hum Dev. 2014. doi:10.1016/j.earlhumdev.2014.01.005.
- ↑ Hummel P, Puchalski M, Creech SD, Weiss MG. Clinical reliability and validity of the N-PASS: Neonatal pain, agitation and sedation scale with prolonged pain. J Perinatol. 2008. doi:10.1038/sj.jp.7211861.
- ↑ Hunseler C, Merkt V, Gerloff M, Eifinger F, Kribs A, Roth B. Assessing pain in ventilated newborns and infants: Validation of the Hartwig score. Eur J Pediatr. 2011. doi:10.1007/s00431-010-1354-9.
- ↑ Milesi C, Cambonie G, Jacquot A, et al. Validation of a neonatal pain scale adapted to the new practices in caring for preterm newborns. Arch Dis Child Fetal Neonatal Ed. 2010. doi:10.1136/adc.2008.144758.
- ↑ 20.0 20.1 20.2 20.3 Ancora G, Lago P, Garetti E, et al. Evidence-based clinical guidelines on analgesia and sedation in newborn infants undergoing assisted ventilation and endotracheal intubation. Acta Paediatr. 2018. doi:10.1111/ apa.14606.
- ↑ 21.0 21.1 21.2 Statement P. Prevention and Management of Procedural Pain in the Neonate: An Update. Pediatrics. 2016;137)2(:e20154271-e20154271. doi:10.1542/peds.2015-4271.
- ↑ Bellieni C V., Buonocore G. What we do in neonatal analgesia overshadows how we do it. Acta Paediatr Int J Paediatr. 2018. doi:10.1111/apa.14125.
- ↑ Pillai Riddell RR, Racine NM, Gennis HG, et al. Non-pharmacological management of infant and young child procedural pain. Cochrane Database Syst Rev. 2015. doi:10.1002/14651858.CD006275.pub3.
- ↑ Bembich S, Cont G, Causin E, Paviotti G, Marzari P, Demarini S. Infant Analgesia With a Combination of Breast Milk, Glucose, or Maternal Holding. Pediatrics. 2018. doi:10.1542/peds.2017-3416.
- ↑ Locatelli C, Bellieni CV. Sensorial saturation and neonatal pain: a review. J Matern Neonatal Med. 2018. doi:10.1080/14767058.2017.1366983.
- ↑ 26.0 26.1 26.2 26.3 Witt N, Coynor S, Edwards C, Bradshaw H. A Guide to Pain Assessment and Management in the Neonate. Curr Emerg Hosp Med Rep. 2016;4)1(:1-10. doi:10.1007/s40138-016-0089-y.
- ↑ S Anand KJ. Consensus Statement for the Prevention and Management of Pain in the Newborn. Vol 155.; 2001.
- ↑ Pandey M, Datta V, Rehan HS. Role of sucrose in reducing painful response to orogastric tube insertion in preterm neonates. Indian J Pediatr. 2013. doi:10.1007/s12098-012-0924-4.
- ↑ McCullough S, Halton T, Mowbray D, Macfarlane PI. Lingual sucrose reduces the pain response to nasogastric tube insertion: A randomised clinical trial. Arch Dis Child Fetal Neonatal Ed. 2008. doi:10.1136/adc.2006.110338.
- ↑ 30.0 30.1 30.2 Stevens B, Yamada J, Gy L, Ohlsson A. Sucrose for analgesia in newborn infants undergoing painful procedures - The Cochrane Library - Stevens - Wiley Online Library. Cochrane Database Syst Rev 2013. 2013. doi:CD001069 [pii]\r10.1002/14651858.CD001069.
- ↑ Lago P, Garetti E, Boccuzzo G, et al. Procedural pain in neonates: The state of the art in the implementation of national guidelines in Italy. Paediatr Anaesth. 2013. doi:10.1111/pan.12107.
- ↑ Disher T, Cameron C, Mitra S, Cathcart K, Campbell-Yeo M. Pain-Relieving Interventions for Retinopathy of Prematurity: A Meta-analysis. Pediatrics. 2018. doi:10.1542/peds.2018-0401.
- ↑ 33.0 33.1 Pirelli A, Savant Levet P, Garetti E, et al. Literature review informs clinical guidelines for pain management during screening and laser photocoagulation for retinopathy of prematurity. Acta Paediatrica, International Journal of Paediatrics. 2018.
- ↑ Chuang LJ, Wang SH, Ma MC, Lin CN, Chen CL, Huang MC. A modified developmental care bundle reduces pain and stress in preterm infants undergoing examinations for retinopathy of prematurity: A randomised controlled trial. Journal of Clinical Nursing. 2018.
- ↑ 35.0 35.1 Association of Paediatric Anaesthetists of Great Britain and Ireland. Good Practice in Postoperative and Procedural Pain Management 2nd Edition, 2012 A. Pediatr Anesth. 2012.
- ↑ Meesters NJ, Van Dijk M, Knibbe CAJ, Keyzer-Dekker CMG, Tibboel D, Simons SHP. Infants Operated on for Necrotizing Enterocolitis: Towards Evidence-Based Pain Guidelines. Neonatology. 2016. doi:10.1159/000445284.
- ↑ 37.0 37.1 Stevens BJ, Gibbins S, Yamada J, et al. Initial Validation and Feasibility.; 2013. www.clinicalpain.com.
- ↑ P Kumar, S E Denson, T J Mancuso, L A Papile, A R Stark, D H Adamkin, J E Baley, V K Bhutani, W A Carlo, R A Polin, R C Tan, K L Watterberg, D G Batton, E Bell, W E Engle, G I Martin, W D Barfield, A L Jefferies, S Kilpatrick, T N K Raju, C Wallman, K S W LL. Clinical report - Premedication for nonemergency endotracheal intubation in the neonate. Pediatrics. 2010. doi:doi:10.1542/peds.2009-2863.
- ↑ 39.0 39.1 Zeller B, Giebe J. Opioid Analgesics for Sedation and Analgesia During Mechanical Ventilation. Neonatal Netw. 2015. doi:10.1891/0730-0832.34.2.113.
- ↑ Perlman JM, McMenamin JB, Volpe JJ. Fluctuating cerebral blood-flow velocity in respiratory-distress syndrome. Relation to the development of intraventricular hemorrhage. N Engl J Med. 1983. doi:10.1056/ nejm198307283090402.
- ↑ Ozawa Y, Ades A, Foglia EE, et al. Premedication with neuromuscular blockade and sedation during neonatal intubation is associated with fewer adverse events. J Perinatol. 2019. doi:10.1038/s41372-019- 0367-0.
- ↑ Raban MS, Joolay Y, Horn AR, Harrison MC. Newborns should be receiving premedication before elective intubation. S Afr Med J. 2014. doi:10.7196/SAMJ.8305.
- ↑ Reece-Stremtan S, Gray L. ABM Clinical Protocol #23: Nonpharmacological Management of Procedure- Related Pain in the Breastfeeding Infant, Revised 2016. Breastfeed Med. 2016. doi:10.1089/ bfm.2016.29025.srs.
- ↑ Holsti L, Grunau RE. Considerations for Using Sucrose to Reduce Procedural Pain in Preterm Infants. Pediatrics. 2010. doi:10.1542/peds.2009-2445.
- ↑ Taddio A, Shah V, Shah P, Katz J. p-Endorphin Concentration after Administration of Sucrose in Preterm Infants. Arch Pediatr Adolesc Med. 2003. doi:10.1001/archpedi.157.11.1071.
- ↑ Gao H, Gao H, Xu G, et al. Efficacy and safety of repeated oral sucrose for repeated procedural pain in neonates: A systematic review. Int J Nurs Stud. 2016. doi:10.1016/j.ijnurstu.2016.07.015.
- ↑ 47.0 47.1 McPherson C, Inder T. Perinatal and neonatal use of sedation and analgesia. Semin Fetal Neonatal Med. 2017. doi:10.1016/j.siny.2017.07.007.
- ↑ Harrison DM. Oral sucrose for pain management in infants: Myths and misconceptions. J Neonatal Nurs. 2008. doi:10.1016/j.jnn.2007.12.002.
- ↑ NeoFax, IBM Micromedex. Lidocaine/Prilocaine monograph. 2019.
- ↑ LexiComp online. Lidocaine/Prilocaine, pediatric drug information. 2019.
- ↑ Tec-O-Pharm-Libra Ltd. EMLA 5% Cream, Prescribing information. 2014.
- ↑ שימוש בקרם EMLA בילדים הלוקים בחסר אנזים G6PD - נייר עמדה, 2018
- ↑ Shahid S, Florez ID, Mbuagbaw L. Efficacy and Safety of EMLA Cream for Pain Control Due to Venipuncture in Infants: A Meta-analysis. Pediatrics. 2019. doi:10.1542/peds.2018-1173.
- ↑ Allegaert K, van den Anker JN. Perinatal and neonatal use of paracetamol for pain relief. Semin Fetal Neonatal Med. 2017. doi:10.1016/j.siny.2017.07.006.
- ↑ Cook SF, Stockmann C, Samiee-Zafarghandy S, et al. Neonatal Maturation of Paracetamol )Acetaminophen( Glucuronidation, Sulfation, and Oxidation Based on a Parent-Metabolite Population Pharmacokinetic Model. Clin Pharmacokinet. 2016. doi:10.1007/s40262-016-0408-1.
- ↑ Ohlsson A, Shah PS. Paracetamol )acetaminophen( for prevention or treatment of pain in newborns. Cochrane Database Syst Rev. 2014. doi:10.1002/14651858.CD011219.
- ↑ NeoFax, IBM Micromedex. Acetaminophen monograph. 2019.
- ↑ Van Den Anker JN, Van Dijk M, Tibboel D. Impaired neurodevelopmental outcomes in very preterm infants: Much too easy to blame it just on morphine! J Pediatr. 2016. doi:10.1016/j.jpeds.2016.01.071.
- ↑ Zwicker JG, Miller SP, Grunau RE, et al. Smaller cerebellar growth and poorer neurodevelopmental outcomes in very preterm infants exposed to neonatal morphine. J Pediatr. 2016. doi:10.1016/j. jpeds.2015.12.024.
- ↑ Ranger M, Zwicker JG, Chau CMY, et al. Neonatal Pain and Infection Relate to Smaller Cerebellum in Very Preterm Children at School Age. J Pediatr. 2015. doi:10.1016/j.jpeds.2015.04.055.
- ↑ 61.0 61.1 McPherson C, Haslam M, Pineda R, Rogers C, Neil JJ, Inder TE. Brain Injury and Development in Preterm Infants Exposed to Fentanyl. Ann Pharmacother. 2015. doi:10.1177/1060028015606732.
- ↑ Krekels EHJ, Tibboel D, De Wildt SN, et al. Evidence-based morphine dosing for postoperative neonates and infants. Clin Pharmacokinet. 2014. doi:10.1007/s40262-014-0135-4.
- ↑ 63.0 63.1 63.2 Anand KJS, Willson DF, Berger J, et al. Tolerance and Withdrawal From Prolonged Opioid Use in Critically Ill Children. Pediatrics. 2010. doi:10.1542/peds.2009-0489.
- ↑ De Graaf J, Van Lingen RA, Valkenburg AJ, et al. Does neonatal morphine use affect neuropsychological outcomes at 8 to 9 years of age? Pain. 2013. doi:10.1016/j.pain.2012.12.006.
- ↑ Bouwmeester NJ, Hop WCJ, Van Dijk M, Anand KJS, Van Den Anker JN, Tibboel D. Postoperative pain in the neonate: Age-related differences in morphine requirements and metabolism. Intensive Care Med. 2003. doi:10.1007/s00134-003-1899-4.
- ↑ 66.0 66.1 Anand KJS, Barton BA, McIntosh N, et al. Analgesia and sedation in preterm neonates who require ventilatory support: results from the NOPAIN trial. Neonatal Outcome and Prolonged Analgesia in Neonates. Arch Pediatr Adolesc Med. 1999. doi:10.1001/archpedi.153.4.331.ABSTRACT.
- ↑ Verghese S. Acute pain management in children. J Pain Res. 2010. doi:10.1016/B978-032304184- 3.50030-3.
- ↑ Kart T, Christrup LL, Rasmussen M. Recommended use of morphine in neonates, infants and children based on a literature review: Part 1 - Pharmacokinetics. Paediatr Anaesth. 1997. doi:10.1046/j.1460-9592.1997.d01-30.x.
- ↑ NeoFax, IBM Micromedex. Morphine monograph. 2019.
- ↑ LexiComp online. Morphine, pediatric drug information. 2019.
- ↑ Chen J, Lau E, Sickkids the Hospital for Sick Children. Drug Handbook and Formulary. Sickkids the Hospital for Sick Children.; 2017.
- ↑ Saarenmaa E, Huttunen P, Leppaluoto J, Meretoja O, Fellman V. Advantages of fentanyl over morphine in analgesia for ventilated newborn infants after birth: A randomized trial. J Pediatr. 1999. doi:10.1016/ S0022-3476)99(70407-5.
- ↑ Franck LS, Vilardi J, Durand D, Powers R. Opioid withdrawal in neonates after continuous infusions of morphine or fentanyl during extracorporeal membrane oxygenation. Am J Crit Care. 1998.
- ↑ Hall RW, Shbarou RM. Drugs of Choice for Sedation and Analgesia in the Neonatal ICU. Clin Perinatol. 2009. doi:10.1016/j.clp.2009.04.001.
- ↑ Ancora G, Lago P, Garetti E, et al. Efficacy and safety of continuous infusion of fentanyl for pain control in preterm newborns on mechanical ventilation. J Pediatr. 2013. doi:10.1016/j.jpeds.2013.02.039.
- ↑ Ancora G Lago P Garetti E Pirelli A Merazzi D Mastrocola M Pierantoni L Giacomo F, Ancora G, Lago P, et al. Follow-up at the corrected age of 24 months of preterm newborns receiving continuous infusion of fentanyl for pain control during mechanical ventilation. Pain. 2017.
- ↑ NeoFax, IBM Micromedex. Fentanyl monograph. 2019.
- ↑ 78.0 78.1 LexiComp online. Fentanyl, pediatric drug information. 2019.
- ↑ NeoFax, IBM Micromedex. Remifentanil monograph. In: ; 2019.
- ↑ LexiComp online. Remifentanil, pediatric drug information. 2019.
- ↑ Ng E, Taddio A, Ohlsson A. Intravenous midazolam infusion for sedation of infants in the neonatal intensive care unit. Cochrane Database Syst Rev. 2017. doi:10.1002/14651858.CD002052.pub3.
- ↑ NeoFax, IBM Micromedex. Midazolam monograph. 2019.
- ↑ LexiComp online. Midazolam, pediatric drug information. 2019.
- ↑ 84.0 84.1 Flerlage, Jamie E, Engorn, Branden E, Harriet Lane Service )Johns Hopkins Hospital( A. The Harriet Lane Handbook : A Manual for Pediatric House Officers. Twentieth. United States: Philadelphia, PA : Saunders / Elsevier, [2015]; 2015.
- ↑ Cravero JP, Havidich JE. Pediatric sedation - Evolution and revolution. Paediatr Anaesth. 2011. doi:10.1111/j.1460-9592.2011.03617.x.
- ↑ Milesi C, Baleine J, Mura T, et al. Nasal midazolam vs ketamine for neonatal intubation in the delivery room: a randomised trial. Arch Dis Child Fetal Neonatal Ed. 2018. doi:10.1136/ archdischild-2017-312808.
- ↑ Pirelli A, Savant Levet P, Garetti E, et al. Literature review informs clinical guidelines for pain management during screening and laser photocoagulation for retinopathy of prematurity. Cochrane Database Syst Rev. 2018;8)1(:1-7. doi:10.1111/apa.14523.
- ↑ LexiComp online. Ketamine, pediatric drug information. 2019.
- ↑ IBM Micromedex. Ketamine Drug Monograph. 2019.
- ↑ Smits A, Thewissen L, Caicedo A, Naulaers G, Allegaert K. Propofol Dose-Finding to Reach Optimal Effect for )Semi-(Elective Intubation in Neonates. J Pediatr. 2016. doi:10.1016/j.jpeds.2016.07.049.
- ↑ Ps S, Vs S. Propofol for procedural sedation / anaesthesia in neonates ) Review (. Management. 2011. doi:10.1002/14651858.CD007248.pub2.
- ↑ Durrmeyer X, Breinig S, Claris O, et al. Effect of atropine with Propofol vs Atropine with atracurium and sufentanil on oxygen desaturation in neonates requiring nonemergency intubation a randomized clinical trial. JAMA - J Am Med Assoc. 2018. doi:10.1001/jama.2018.3708.
- ↑ Papoff P, Mancuso M, Caresta E, Moretti C. Effectiveness and safety of propofol in newborn infants. Pediatrics. 2008. doi:10.1542/peds.2007-3132.
- ↑ Welzing L, Kribs A, Eifinger F, Huenseler C, Oberthuer A, Roth B. Propofol as an induction agent for endotracheal intubation can cause significant arterial hypotension in preterm neonates. Paediatr Anaesth. 2010. doi:10.1111/j.1460-9592.2010.03330.x.
- ↑ Simons SHP, Van Der Lee R, Reiss IKM, Van Weissenbruch MM. Clinical evaluation of propofol as sedative for endotracheal intubation in neonates. Acta Paediatr Int J Paediatr. 2013. doi:10.1111/apa.12367.
- ↑ LexiComp online. Propofol, pediatric drug information. 2019.
- ↑ David Osborn, Julee Oei, Hari Ravindranathan, et al. Propofol Newborn Use Only.; 2018.
- ↑ Hunseler C, Balling G, Rohlig C, et al. Continuous infusion of clonidine in ventilated newborns and infants: A randomized controlled trial. Pediatr Crit Care Med. 2014. doi:10.1097/PCC.0000000000000151.
- ↑ NeoFax, IBM Micromedex. Clonidine monograph. 2019.
- ↑ NeoFax, IBM Micromedex. Dexmedetomidine monograph. 2019.
- ↑ LexiComp online. Dexmedetomidine, pediatric drug information. 2019.
- ↑ Romantsik O, Calevo MG, Norman E, Bruschettini M. Clonidine for sedation and analgesia for neonates receiving mechanical ventilation. Cochrane Database Syst Rev. 2017. doi:10.1002/14651858. CD012468.pub2.
- ↑ S.M. H, G.M. K. Dexmedetomidine: A review of its use for sedation in mechanically ventilated patients in an intensive care setting and for procedural sedation. Drugs. 2011. doi:10.2165/11207190-000000000- 00000.
- ↑ Mantz J, Josserand J, Hamada S. Dexmedetomidine: New insights. Eur J Anaesthesiol. 2011. doi:10.1097/EJA.0b013e32833e266d.
- ↑ Virtanen R, Savola JM, Saano V, Nyman L. Characterization of the selectivity, specificity and potency of medetomidine as an a2-adrenoceptor agonist. Eur J Pharmacol. 1988. doi:10.1016/0014- 2999)88(90744-3.
- ↑ O’Mara K, Gal P, Ransom JL, et al. Successful use of dexmedetomidine for sedation in a 24-week gestational age neonate. Ann Pharmacother. 2009. doi:10.1345/aph.1M245.
- ↑ Chrysostomou C, Schulman SR, Herrera Castellanos M, et al. A phase II/III, multicenter, safety, efficacy, and pharmacokinetic study of dexmedetomidine in preterm and term neonates. J Pediatr. 2014. doi:10.1016/j.jpeds.2013.10.002.
- ↑ O’Mara K, Gal P, Wimmer J, et al. Dexmedetomidine Versus Standard Therapy with Fentanyl for Sedation in Mechanically Ventilated Premature Neonates. J Pediatr Pharmacol Ther. 2012. doi:10.5863/1551- 6776-17.3.252.
- ↑ Ibrahim M, Jones LJ, Lai NM, Tan K. Dexmedetomidine for analgesia and sedation in newborn infants receiving mechanical ventilation. Cochrane Database Syst Rev. 2016. doi:10.1002/14651858. CD012361.
- ↑ Neonatal Medicines Formulary Consensus Group. Phenobarbital )Phenobarbitone( 2016.; 2016.


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק