סרטן הריאה - טיפול - Lung cancer - treatment
| סרטן הריאה - טיפול | ||
|---|---|---|
| Lung cancer - treatment | ||

| ||
| ICD-10 | C33-C34 | |
| ICD-9 | 162 | |
| MeSH | D002283 | |
| יוצר הערך | ד"ר תמי בירנבוים גל וד"ר אליזבטה דודניק | |
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סרטן ריאה
סרטן הריאה מהווה את אחד הגידולים הנפוצים ביותר בעולם. שיעור התחלואה בסרטן הריאה מצוי בעלייה מתמדת, וממאירות זו מהווה כיום את גורם התמותה המוביל מסרטן בקרב גברים ונשים כאחד. לפי הערכה סטטיסטית מבוססת על נתוני עבר, 228,820 אנשים יאובחנו עם סרטן ריאה בארה"ב במהלך 2020 ו-135.720 ימותו כתוצאה מהמחלה [1]. לפי נתוני הרישום הלאומי לסרטן, בישראל מאובחנים מדי שנה כ-2,500 מקרים חדשים של שאת ריאה[2].
קיימים מספר גורמי סיכון להתפתחות סרטן ריאות. העיקרי בהם הוא עישון כתלות במספר שנות העישון ובכמות הסיגריות ליום. עישון אחראי על התפתחות כ-85% מכלל מקרי סרטן ריאה [3]. עישון פאסיבי גם הוא מעלה סיכון לחלות בסרטן ריאה [4]. גורמי סיכון נוספים הם זיהום אוויר, חשיפה תעסוקתית (כגון לאזבסט, סיליקה, סולר, גז רדון) וחשיפה לקרינה מייננת (כגון קרינה טיפולית בשל מחלת הודג'קין או במסגרת תאונות עבודה). סיפור משפחתי של סרטן ריאה ואבחנה של מחלת ריאות כרונית על רקע עישון (Chronic obstructive pulmonary disease - COPD) נספרים גם הם עם גורמי סיכון להתפתחות שאת ריאה. אנו עדים לעליית השיעור של מקרי סרטן ריאה בקרב לא מעשנים.
התסמינים השכיחים של סרטן ריאה כוללים שיעול, קוצר נשימה, כיח דמי, כאבים בחזה, דלקות ריאה נשנות, חוסר תיאבון, ירידה במשקל וחולשה כללית. בחולים עם תסמינים לרוב מאובחנת המחלה בשלב מתקדם, בעוד אבחון המחלה בטרם התפתחות התסמינים אפשרי ומומלץ. כך, אבחון מוקדם (סקרינינג/בדיקת סקר) של סרטן ריאה מבוסס על טומוגרפיה ממוחשבת של בית החזה באנשים בקבוצת הסיכון להתפתחות סרטן ריאה (כגון מעשנים כבדים עם היסטוריית עישון של 30 שנות/חפיסה ויותר) מעלה שיעור המקרים המאובחנים בשלבים מוקדמים וכתוצאה מכך גורם לירידה של 20% בשיעור התמותה מסרטן ריאה [5].
האבחנה של סרטן ריאה מבוצעת לרוב על ידי נטילת ביופסיה באמצעות בדיקת שקיפת סימפונות (Bronchoscopy) או דיקור מונחה טומוגרפיה ממוחשבת (Computed tomography (CT) - guided lung biopsy), אשר באמצעותם ניתן לקבוע גם את סוג ההיסטולוגי של הגידול. לקביעת שלב המחלה ודרגת ההתפשטות של הגידול משתמשים בבדיקות הדמיה כגון טומוגרפיית פליטת פוזיטרונים עם פלואורודיאוקסיגלוקוז (FDG-positron emission tomography–computed tomography) ותהודה מגנטית (Magnetic Resonance Imaging - MRI) [6].
סיווג גידולי סרטן הריאה
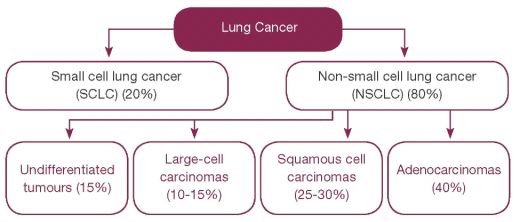
לפי המלצת הארגון הבריאות העולמי (World Health Organization – WHO) משנת 2015 מקובל לחלק גידולי ריאה לשני סוגים עיקריים [6]:
- סרטן ריאה בנוי תאים שאינם קטנים (Non-small cell lung carcinoma – NSCLC המהווים כ-80% ממקרי סרטן ריאה)
- גידולים נוירו-אנדוקריניים בתוכם השולט הוא סוג סרטן ריאה בנוי תאים קטנים (Small-cell lung carcinoma – SCLC).
בנוסף לקביעת הסוג ההיסטולוגי (Histological) של הגידול, נערכת בדיקה לתאי הגידול לנוכחות מוטציה (Mutation) בקולטן לגורם גדילה אפידרמלי (EGFR ,Epidermal Growth Factor Receptor), אשר קיימת בכ-15 אחוזים מחולי סרטן ריאה של תאים שאינם קטנים (NSCLC ,Non-Small-Cell Lung Carcinoma). נוכחות תשנית זו חשובה לצורך בחירת הטיפול המערכתי המתאים ביותר לחולים בשלב מחלה מתקדם.
המוטציה מביאה לפעילות יתר של הקולטן אליו נקשר גורם הגדילה, ובעקבות כך מופעלת שרשרת של תהליכים אשר מעודדים את גדילת והתרבות התאים הממאירים והתפתחות גרורות.
קבוצת החולים בעלי השתנית ב-EGFR (Epidermal Growth Factor Receptor) מפיקה תועלת קלינית ייחודית מטיפול התחלתי עם תרופות מקבוצת מעכבי Tyrosine-Kinase (TKI ,Tyrosine-Kinase Inhibitors), המהווים את טיפול הבחירה בקו ראשון בחולים אלו.
שלבי המחלה
דירוג התפשטות המחלה (Staging) נקבע על סך שלושה מאפיינים[2]:
- T: מידת החדירה של הגידול הראשוני.
- N: מיקום בלוטות הלימפה המעורבות.
- M: הימצאות גרורות מרוחקות.
עקרונות הטיפול ופרוגנוזה
הטיפול נקבע בהתאם לשלב המחלה ומשלב ניתוח, קרינה, כימותרפיה (Chemotherapy), אימונותרפיה (Immunotherapy), טיפול ביולוגי (Biological) מכוון מטרה וטיפול תומך (Palliative care) לפי הצורך. במרבית המקרים (מלבד השלבים המוקדמים של המחלה בהם עיקר הטיפול הוא ניתוחי או קרינתי הניתן לבדו), הטיפול בסרטן ריאה משלב שיטות טיפול שונות (Multi-modality treatment)[3].
טיפול כימותרפי
משלבים מבוססי-פלטינום (Platinum-based antineoplastic) הכוללים Cisplatin (Abiplatin)} או Carboplatin הניתנים עם אחת מבין התרופות הבאות: Vinblastine, (Blastovin), Vinorelbine, (Navelbine), Pemetrexed, (Alimta), Etoposide, Paclitaxel, Gemcitabine או Docetaxel.
בטיפול בקו ראשון בחולים עם מחלה מתקדמת, ניתן להוסיף למשלב גם Bevacizumab (Avastin).
לאחר התקדמות המחלה ניתן בדרך כלל טיפול עם תרופה כימותרפית בודדת או TKI.
חידושים בטיפול בשלב מתקדם
יותר ממחצית מחולי סרטן ריאה מאובחנים בשלב שבו המחלה התפשטה לאיברים מרוחקים, כגון שלד, ריאה, כבד, בלוטות יותרת הכליה ומוח .עד לפני כעשור, הגישה הטיפולית בשלב זה התבססה על טיפול כימותרפי. שינוי מהפכני שחל בעשור השני של המאה ה-21 הביא לשיפור משמעותי בתחזית כלל התפחות שיטות הטיפול בשני כיוונים עיקריים:
- טיפולים ביולוגים מכווני מטרה – השיטה כאן מבוססת על זיהוי של המנגנון המולקולרי (Molecular) שאחראי על התפתחות הסרטן (Driver mutation) ושימוש בטיפול ביולוגי מכוון כנגד מנגנון משפעל
- טיפולים אימונותרפיים על ידי מעכבי נקודות בקרה חיסונית (Immune check-point inhibitors) - השיטה שמורידה את השפעתם של הגורמים המעכבים ממערכת החיסון של הגוף ועל ידי כך מאפשרת לה תקוף את הגידול הסרטני
טיפולים ביולוגים מכווני מטרה
מדובר בטיפול ביולוגי מותאם אישית, שהתאפשר בזכות זיהוי של מוטציות (Mutations) משפעלות בתאי הגידול (כגון מוטציות בגנים (Genes) EGFR, ROS-1, ALK (Anaplastic Lymphoma Kinase), NTRK (Neurotrophin Tyrosine Kinases), BRAF, c-MET, RET (REarranged during Transfection) ו-HER-2 (Human Epidermal Growth factor Receptor 2) ופיתוח תרופות הפועלות נגד המוטציות הללו. כך, כ-30–40 אחוזים מגידולי ריאה גרורתיים מסוג Adenocarcinoma עשויים להיות גידולים נושאי מוטציה הפעלתית, שכנגדה קיימים טיפולים ממוקדי מטרה הניתנים בצורת פומית. לאורך השנים, פותחו דורות חדשים של תכשירים ביולוגיים עבור המוטציות הללו, לרבות תכשירים שמסוגלים להתמודד עם מנגנוני העמידות הנרכשת (עמידות שמפתחים תאי סרטניים במהלך הטיפול) ומאפשרים מתן מספר טיפולים ביולוגיים ברצף אחד לאחר השני. כך לדוגמה, פותחו כבר מספר דורות מעכבי EGFR (כגון Gefitinib, Erlotinib, Afatinib, Osimertinib), מעכבי ALK (Crizotinib, Alectinib, Ceritinib, Brigatinib, Lorlatinib) מעכבי ROS-1 (Crizotinib, Entrectinib, Repotrectinib, Lorlatinib) ומעכבי c-MET (Crizotinib, Capmatinib, Tepotinib, Savolitinib). טיפולים אלה שינו לטובה את מהלך המחלה בחולים שגידולם נושא מוטציה משפעלת, איפשרו לחלק מהחולים לשרוד 5 שנים ואף יותר[4], וכן שיפרו משמעותית את איכות חייהם.
בחירת החולים
בחירת חולים שמתאימים לטיפולים מכווני מטרה היא קריטית, וכדי למצוא את המוטציה ההפעלתית בגידול מסוים מומלץ לבצע אבחון מולקולרי מעמיק עם תיעדוף לשיטות שמבוססות על ריצוף גנומי (Genomic sequencing) מהדור החדש - Next Generation Sequencing) NGS) . בדיקות אלה, המכונות בדיקות גנומיות מקיפות, מאבחנות את הפרופיל המולקולרי (Molecular profile) של הגידול, ובאמצעות ריצוף של מאות גנים במקביל הן מתאימות בצורה מדויקת יותר אפשרויות טיפול ממוקד המכוונות כנגד המוטציות ההפעלתיות.
טיפולים אימונותרפיים
אחד מהמאפיינים של סוגי סרטן רבים הוא שהתאים הסרטניים מוצאים דרך להתחמק מתגובת מערכת החיסון.
אימונותרפיה חדישה ״מורידה את הבלמים״ ממערכת החיסון וכך מגבירה את יכולת מערכת החיסון להילחם בסרטן. אימונתרפיה היוותה פריצת דרך משמעותית בטיפול בסרטן ריאה מתקדם. כך לדוגמה, בסרטן ריאה מתקדם מסוג NSCLC, מחקרים רבים הוכיחו כי מתן אימונותרפיה בהשוואה למתן כימותרפיה מביא להישרדות ארוכה יותר[5], רעילות קלה יותר ואיכות חיים טובה יותר [6][7], היתרון הבולט של אימונותרפיה הוא בעובדה כי המטופלים שמגיבים לטיפול עשויים לשרוד שנים ארוכות. כך לדוגמה, 25-14 אחוזים, בהתאם לדרגת הביטוי של PD-L1 (Programmed Death Ligand-1) בתאי הגידול מהחולים עם NSCLC בשלב מתקדם עשויים לשרוד 4 שנים ויותר ממועד תחילת אימונותרפיה[8][9],
ביבליוגרפיה
- ↑ שגיאת ציטוט: תג
<ref>לא תקין; לא נכתב טקסט עבור הערות השוליים בשםהערה1 - ↑ 2.0 2.1 NCCN guidelines version I 2011 Tarceva.
- ↑ 3.0 3.1 Postmus PE, Kerr KM, Oudkerk M, et al. Early and locally advanced non-small-cell lung cancer (NSCLC): ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol. 2017;28 Suppl 4:iv1-iv21. doi:10.1093/annonc/mdx222
- ↑ 4.0 4.1 Mok T, Camidge DR, Gadgeel SM, et al. Updated overall survival and final progression-free survival data for patients with treatment-naive advanced ALK-positive non-small-cell lung cancer in the ALEX study. Ann Oncol. 2020;31(8):1056-1064. doi:10.1016/j.annonc.2020.04.478
- ↑ 5.0 5.1 Reck M, Rodríguez-Abreu D, Robinson AG, et al. Pembrolizumab versus Chemotherapy for PD-L1-Positive Non-Small-Cell Lung Cancer. N Engl J Med. 2016;375(19):1823-1833. doi:10.1056/NEJMoa1606774
- ↑ 6.0 6.1 6.2 Brahmer JR, Rodríguez-Abreu D, Robinson AG, et al. Health-related quality-of-life results for pembrolizumab versus chemotherapy in advanced, PD-L1-positive NSCLC (KEYNOTE-024): a multicentre, international, randomised, open-label phase 3 trial. Lancet Oncol. 2017;18(12):1600-1609. doi:10.1016/S1470-2045(17)30690-3
- ↑ Reck M, Schenker M, Lee KH, et al. Nivolumab plus ipilimumab versus chemotherapy as first-line treatment in advanced non-small-cell lung cancer with high tumour mutational burden: patient-reported outcomes results from the randomised, open-label, phase III CheckMate 227 trial. Eur J Cancer. 2019;116:137-147. doi:10.1016/j.ejca.2019.05.008
- ↑ Antonia SJ, Borghaei H, Ramalingam SS, et al. Four-year survival with nivolumab in patients with previously treated advanced non-small-cell lung cancer: a pooled analysis. Lancet Oncol. 2019;20(10):1395-1408. doi:10.1016/S1470-2045(19)30407-3
- ↑ Garon EB, Hellmann MD, Rizvi NA, et al. Five-Year Overall Survival for Patients With Advanced Non‒Small-Cell Lung Cancer Treated With Pembrolizumab: Results From the Phase I KEYNOTE-001 Study. J Clin Oncol. 2019;37(28):2518-2527. doi:10.1200/JCO.19.00934


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק