קראטין - Creatine
| מדריך בדיקות מעבדה | |
| קראטין | |
|---|---|
| Creatine | |
| מעבדה | כימיה בשתן |
| תחום | מפגעים של סינתזת קראטין |
| טווח ערכים תקין | 2-12 מיליגרם/ליטר |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
הערכה של מטופלים עם חשד קליני לחסר arginine:glycine amidinotransferase , חסר guanidinoacetate methyltransferase או פגם ב-(creatine transporter (SLC6A8.
נתונים פיזיולוגיים על קראטין
קראטין, היא חומצה אורגנית ניטרוגנית שהיא נגזרת של הקטיון guanidinium, המופיעה באופן טבעי בבעלי חוליות. בתמיסה, נמצא קראטין בשיווי משקל עם קראטינין (Cannan ו-Shore ב-Biochem J משנת 1928). תפקידו העיקרי הוא לסייע למִחזור של ATP, המולקולה עתירת האנרגיה של התא, בעיקר ברקמת השריר ובמוח. הדבר מושג על ידי מחזור של ADP והפיכתו ל-ATP על ידי תרומה של שיירי פוספאט. קראטין פועל גם כבּופר הקובע רמת pH ברקמות (Barcelos וחב' ב- Mini Rev Med Chem משנת 2016).
הסינתזה של קראטין מתבצעת בעיקר בכבד ובכליות, ובממוצע הוא מיוצר אנדוגנית בקצב מוערך של 8.3 מילימול (או 1 גרם) מדי יום במבוגרים צעירים כדי לפצות על איבוד יומי של 14.6 מילימול (או 2 גרם) של קראטינין בגברים בני 20-39 שנה במשקל 70 ק"ג (Brosnan וחב' ב-Amino Acids משנת 2011). סינתזת קראטין נעשית בעיקר בכבד ובכליות, ובמידה פחותה יותר בבלוטת הלבלב (Cooper ב- J Int Soc Sports Nutr), כאשר שאר כמות הקראטין הזמינה לגוף מושגת דרך הדיאטה בכמות של 1 גרם ליום. 95% ממאגרי קראטין בגוף נמצאות ברקמת שריר השלד, ויתר 5% נאגרים במוח, בכבד, בכליות ובאשכים (Brosnan & Brosnan משנת 2016 ב-Amino Acids).
רוב המאגר של קראטין וקראטין פוספאט בגוף ממוקם בשריר ומגיע כדי 120 גרם (או 915 מילימול') בגבר במשקל 70 ק"ג. קראטין כמו גם קראטין פוספאט, יכולים לעבור ציקליזציה לא-אנזימאטית מסדר ראשון, ליצירת קראטינין בשיעורים של 0.011 ו-0.026 מכמות הקראטינין הכללית מדי יום, בהתאמה. לכן, כדי לשמור על מאגר קראטין וקראטין-פוספאט, יש צורך להקפיד על כמות קראטין הזהה לכמות קראטינין הנוצרת מדי יום (כ-2 גרם במבוגר), או ממקורות מזון או מסינתזה אנדוגנית. נראה שגם באלה שאינם מקבלים קראטין ממזון, הסינתזה האנדוגנית יכולה לספק דרישה כמותית זו (Walker ב-Adv Enzymol משנת 1979). קביעה אחרונה זו נתמכת על ידי הנתון שסינתזת קראטין היא מבחינה כמותית הצרכן העיקרי של שיירי מתיל הנתרמים בגוף על ידי S-adenosylmethionine (על פי Mudd וחב' ב-Metabolism משנת 1980).
ביו סינתזה של קראטין
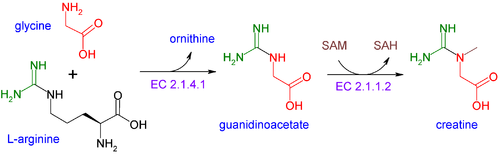
קראטין אינו תוצר תזונה חיוני (כיוון שהוא מיוצר אנדוגנית בגוף האדם מחומצות האמינו גליצין וארגינין בשני שלבים: בשלב הראשון שתי חומצות אמינו אלו מתחברות על ידי האנזים arginine:glycine amidinotransferase (או AGAT) על ידי טרנספר של שייר amidino מארגינין לגליצין ליצירה של guanidinoacetate ושל אורניטין; בשלב השני עובר guanidinoacetatae מתילציה על ידי האנזים guanidinoacetate N-methyltransferase (או GAMT), על ידי שימוש ב-S-adenosyl methionine כתורם של שייר מתיל ליצירת קראטין.
תהליכי סינתזה אלה מתרחשים בעיקר בכליה ובכבד, כאשר קראטין מועבר דרך הדם לשרירים. מספר מחקרים קטנים מציעים שרמת קראטין בשריר של אנשים צמחוניים נמוכה יותר מאשר באוכלי-כל (omnivore), כפי שהיה צפוי שהרי צמחוניים אינם מקבלים קראטין ממאכל ירקות. לעומת זאת, נמצא שצריכת תוספי קראטין על ידי צמחוניים הביאה לרמה זהה של קראטין ברקמת השריר בדומה לזו של אוכלי-כל (Burke וחב' ב- Med & Sci Sports & Exerciseמשנת 2003).
מערכת הפוספוקראטין
קראטין, המסונטז בכבד ובכליות, מועבר דרך הדם ונקלט על ידי רקמות כמו המוח ושריר השלד בהן קיימת דרישה גבוהה לקראטין, על ידי מערכת טרנספורט פעילה. הריכוז של ATP בשריר השלד הוא בדרך כלל 2-5 מילימול, הגורם לכיווץ השריר רק למשך שניות אחדות (Wallimann וחב' ב-Biochem J משנת 1992). למרבה המזל, במהלך פרקי זמן של דרישה אנרגטית גבוהה, מערכת ה-phosphagen או ATP/phosphocreatine, מסנתזת מחדש ATP מ-ADP, תוך שימוש בפוספו-קראטין דרך ריאקציה הפיכה בעזרת האנזים CK (קראטין קינאז). בשריר השלד ריכוזי פוספו-קראטין יכולים להגיע ל-20-35 מילימול או יותר. בנוסף לכך, ברוב השרירים יכולת הרה-גנרציה של ATP על ידי האנזים קראטין קינאז גבוהה מאוד, ואינה מהווה גורם מקביל. לקראטין ישנה היכולת להגדיל את מאגרי פוספו-קראטין בשריר, ובכך להגדיל באופן פוטנציאלי את יכולת השריר לסנטז מחדש ATP מ-ADP על מנת לספק את הדרישות האנרגטיות של השריר (Spillane וחב' ב- J International Soc Sports Nutrition משנת 2009, ו-Wallimann וחב' ב-Amino Acids משנת 2011).
פרמאקו-קינטיקה של קראטין
רמת הריכוזים האנדוגנית של קראטין בנסיוב של מבוגרים בריאים היא בדרך כלל בתחום של 2-12 מיליגרם/ליטר. נטילה פומית בודדת של 5 גרם קראטין באנשים בריאים, מביאה לשיא ברמת קראטין בדם של בערך 120 מיליגרם/ליטר כ-1-2 שעות לאחר בליעת התכשיר. לקראטין יש תקופת מחצית חיים קצרה יחסית של פחות מ-3 שעות, באופן שיש צורך ליטול את התכשיר אחת ל-3-6 שעות במהלך היממה. לאחר תקופת ההעמסה של 1-2 שבועות עם נטילת קראטין יומית של 12-24 שעות, אין צורך להתמיד בנטילת קראטין במינונים גבוהים. בדומה לתוספי תכשירים אחרים, לכל אדם יש את רמת הקראטין האופטימאלית שגופו יכול לאצור, כאשר כמות התוסף העודפת מופרשת כפסולת. מינון אופייני של קראטין הנלקח באופן ממושך יותר אחר תקופת ההעמסה היא בממוצע 2-5 גרם ליום (Wallimann וחב' ב-Amino Acids משנת 2011). חלב פרה מפוסטר מכיל רמות קראטין גבוהות יותר מאשר חלב אדם (Kley, ב-Cochrane Library משנת 2011).
תוספי קראטין
תוספי קראטין נלקחים על ידי ספורטאים, בוני-גוף, מתאבקים ואצנים כמו גם על ידי אחרים, המבקשים להגדיל את מסת השרירים. חוקרי Mayo Clinic קובעים שקראטין נכרך עם תסמיני אסתמה, ומזהירים נגד שימוש בתוספי קראטין על ידי אלה עם אלרגיה ידועה לחומר זה. סקירה סיסטמתית משנת 2009 שללה אפשרות לפיה צריכת תוספי קראטין עלולה להשפיע על סטאטוס ההידרציה של הגוף ועל הסבילות לחום, ולגרום לשלשולים או להתכווצות שרירים (Lopez וחב' ב- J Athletic Training משנת 2009, ו-Dalbo וחב' ב- British Journal of Sports Medicine משנת 2008). ישנם דיווחים על נזק לכליות מצריכת תוספי קראטין, כגון נפריטיס אינטרסטיציאלית, ומומלץ שאלה עם מחלת כליות יימנעו מצריכת קראטין. באופן דומה, גם תפקודי הכבד יכולים להשתנות ולכן מוזהרים אלה עם מחלת כבד מצריכת קראטין, אם כי מחקרים לא הראו השפעה ישירה על תפקוד הכליות או הכבד מצריכה פומית של תוספי קראטין (Poortmans וחב' ב-Sports Med משנת 2000).
בשנת 2004 הרשות האירופית לבטיחות מזון (EFSA) פרסמה דו"ח לפיו נטילה פומית ארוכת טווח של קראטין במינון של עד 3 גרם ליום, היא נטולת סיכונים. מחקר משנת 2003 שנערך בקרב אתלטים שנטלו קראטין למשך 21 חודש, לא מצא כל שינויים משמעותיים בסמנים של תפקודי כליות (Kreider וחב' ב-Mol Cellular Biochem); מחקר משנת 2008 על אתלטים שנטלו תוסף קראטין משך 3 חודשים לא מצא כל עדות לנזק כלייתי במהלך תקופה זו (Gualano וחב' ב- Eur J Applied Physiology). בה במידה, סקירה של Kim וחב' ב-Amino Acids משנת 2011, מצאה שצריכת קראטין לא השפיעה על תפקוד הכבד והכליות באוכלוסייה צעירה ומבוגרת. יחד עם זאת בעלי הסקירה מזהירים מפני צריכת קראטין במינונים גבוהים שמעל 3-4 גרם באלה עם תפקוד כלייתי נמוך, ורמזה לכך שיש צורך במחקרים נוספים כדי לשלול טענות על השפעה מוטגנית או סרטנית של צריכה זו.
מטה-אנליזות רבות מצאו שטיפול בקראטין לא פגע בתפקודי הכליות, הכבד, הלב או השריר (Persky ו-Rawson ב- Sub-cellular biochemistry משנת 2007, ו-Pastula וחב' ב- Cochrane database of systematic reviews משנת 2010). יחד עם זאת, מתן קראטין לא היה יעיל בטיפול ב-amyotrophic lateral sclerosis (Moreta וחב' ב-Food Chemistry משנת 2011). הרשות האירופית לבטיחות מזון סקרה 33 מותגי קראטין, ומצאה ב-15% מתוכם כמויות ניתנות לגילוי של תוסף זה בנסיוב. כמו כן מטה-אנליזות רבות מצאו שהטיפול בקראטין לא פגע בתפקודי הכליות, הכבד, הלב או השריר (Persky ו-Rawson ב- Sub-cellular biochemistry משנת 2007).
פתו-פיזיולוגיה של קראטין
חסכים גנטיים בביוסינתזה של קראטין מובילים למפגעים נוירולוגיים חמורים אחדים. מבחינה קלינית, ישנם שלושה מפגעים מוגדרים הקשורים למטבוליזם של קראטין. חסר של 2 האנזימים הסינתטיים מוגדר כ-L-arginine:glycine amidinotransferase deficiency ו-guanidinoacetate methyltransferase deficiency. שני הפגמים הביוסינתטיים הללו מועברים בתורשה אוטוזומאלית רצסיבית. פגם שלישי הנובע מפגיעה בטרנספורטר של קראטין, נגרם על ידי מוטציה בגן SLC6A8, ומועבר בתורשה הקשורה לכרומוזום X. פגם שלישי זה קשור לטרנספורט של קראטין לתוך המוח ( Braissant וחב' ב-Amino Acids משנת 2011).
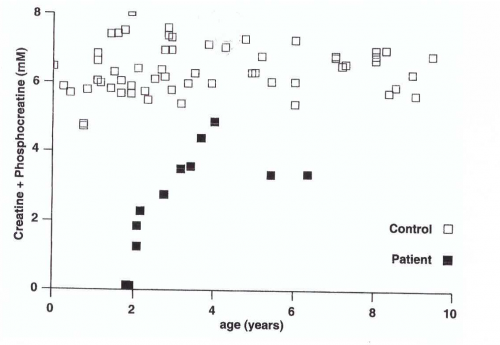
שלושת המפגעים גורמים לחסר בקראטין מוחי ומתבטאים קלינית על ידי עיכוב התפתחותי, מגרעות אינטלקטואליות, ועיכוב חמור בדיבור. החסר של GAMT מתבטא כבר בחודשי החיים הראשונים, ומופיע בהתחלה כהיפוטוניה, חולשה שליטה דלה בייצוב הראש, הפרעות בבליעה (dysphagia), תנועות בלתי-רצוניות אקסטרה-פירמידאליות ואפילפסיה. כללית, מטופלים עם תסמונת חסר קראטין, מפתחים פרכוסים, כאשר אלה מתוכם עם חסר ב-GAMT ובטרנספורטר של קראטין, סובלים מבעיות התנהגותיות, ומסממנים של אוטיזם, ונטייה לפגיעה עצמית. סיגנלים בלתי-נורמאליים ב-globus pallidus כפי שהם מתגלים בסריקת MRI, עשויים לספק מידע אבחוני חשוב. חסר או פגיעה קשה ביכולת הדיבור מופיעים בכל המאובחנים במחלה. לעומת זאת, אין פגיעה בעצבים היקפיים, בראייה או בשמיעה, והרפלקסים הגידיים תקינים. כמו כן לא מופיעים מפגעים דיסמורפיים או אורגנו-מגליה. תפקודי הכליות, הלב והכבד והמערכת ההמאטופויטית תקינים, והצמיחה הסומאטית כולל היקף הראש תקינים. בסך הכול מדובר על מפגע נדיר עד מאוד שנתגלה לראשונה באדם בשנת 1994, כאשר עד שנת 1998 היו רק 4 מקרים מדווחים בספרות הרפואית, ב-4 משפחות ממוצא כורדי, וולשי, הולנדי וגרמני, כאשר בכול המקרים הייתה הומוזיגוטיות של המוטציה G>A327 (על פי Stöckler וחב' ב-Pediatr Res משנת 1994).
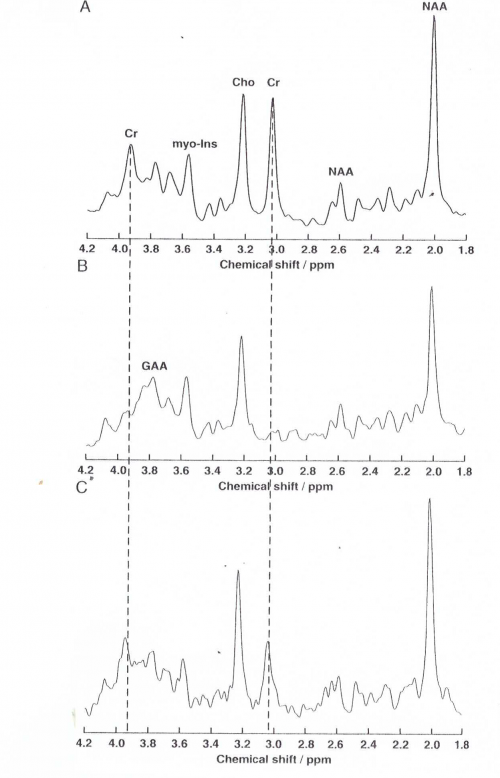
נתון אבחוני חשוב נוסף מבוסס על ההדגמה של כמויות עודפות של guanidinoacetate (להלן GAA) בנוזלי גוף ובמוח, על ידי חסר של קראטין/פוספוקראטין במוח, וחסר של פעילות האנזים GAMT בפיברובלסטים, בלימפוציטים או בתאי הנוזל האמניוטי בבדיקות קדם-לידה. Jeas וחב' מדדו במחקרם ב-Clin Chim Acta משנת 2000, את רמת הפעילות של GAMT בתרבית בתאים שנלקחו מחולים עם חסר מאובחן בסינתזת קראטין, והשוו אותה לאנשים בריאים. הממצאים היו כדלקמן: בלימפובלסטים מותמרים על ידי נגיף EBV נמדדה בחולים פעילות GAMT נמוכה מ-0.1 ננומול/מיליגרם חלבון בשעה, בעוד שפעילות האנזים הממוצעת באנשים בריאים נקבעה כ-0.61-0.84 ננומול/מיליגרם חלבון לשעה. באח של אחד החולים שנקבע כהטרוזיגוטי לחסר האנזים נמדדה פעילות GAMT של 0.23 ננומול/מיליגרם חלבון לשעה. מדידת פעילות אנזים זה בפיברובלסטים שמקורם בחולים הראתה גם כן פעילות הנמוכה מ-0.1 ננומול/מיליגרם חלבון לשעה, בעוד שהפעילות של GAMT בפיברובלסטים של ביקורת בריאה נתנה תוצאה של 0.38-0.56 ננומול/מיליגרם חלבון לשעה.
רמות קראטינין בפלזמה הנמוכות מהסף התחתון של הנורמה, כמו גם הפרשה מועטה של קראטינין בדגימות איסוף 24 שעות של שתן, מאפשרים שיטת סקר קלה הדורשת בנוסף רק סקירה זהירה של תוצאות מעבדה נוספות. הריכוזים של קראטינין ושל תרכובות guanidino אחרות בפלזמה ובנוזל שדרה מדויקות יותר בהערכת המחלה. אם מדידות אלה מתבצעות בשתן, יש להעדיף איסוף 24 שעות על פני דגימת שתן אקראית, שכן לדוגמה דגימת שתן ראשונה של הבוקר שהיא מרוכזת יותר עלולה לתת תוצאות מוגברות-כזובות (false positive) של קראטינין. הגילוי של רמות מוגברות של GAA בדגימות אקראיות של שתן, אופייני לחסר של GAMT, והוא נובע מהצטברות אופיינית ניכרת של GAA בנוזלי הגוף (Stöckler וחב' ב-Metabolism משנת 1997).
נשים נשאיות של חסר בטרנספורטר, עלולות גם לסבול מיכולת אינטלקטואלית נמוכה, ומבעיות התנהגותיות, וחלקן מפתחות פרכוסים. אבחון אפשרי על ידי מדידת GAA, קראטין, וקראטינין בפלזמה ובשתן. מטופלים עם חסר של GAMT, באופן טיפוסי ואופייני מראים רמת קראטין נורמלית עד נמוכה, רמת GAA מאוד מוגברת, ורמת קראטינין נמוכה. מטופלים עם חסר של AGAT, מראים באופן אופייני רמות נמוכות עד נורמאליות של קראטין, רמת GAA נמוכה, ורמת קראטינין נורמאלית עד נמוכה. לשם השוואה, במטופלים עם חסר הטרנספורטר, מוצאים רמות מוגברות של קראטין, רמה נורמאלית של GAA, רמה נורמלית עד נמוכה של קראטינין, ויחס מוגבר של קראטין לקראטינין.
שיטות למדידת קראטין וגואנידינו-אצטט
מגוון של שיטות לקביעה של תרכובות guanidino ב-CSF, בפלזמה ובשתן פותחו, כולל שיטות כרומטוגרפיות-יוניזציה כימית-מס ספקטרומטריה (Yasuda וחב' ב-Anal Biochem משנת 1997), שיטות אלקטרופורטיות (Haung ו-Haung ב-J Chromatogr משנת 1988), שיטת GC-MS (על פי Wallimannו-Hanefeld ב-J Inherit Metab Did משנת 1997), שיטות קולורימטריות {Schulz וחב' ב-J Inherited Metab Dis משנת 1996) ושיטת in vitro למדידת [1H]-MRS בנוזל השדרה (Wevers וחב' ב-Clin Chem משנת 1995). שיטת ה-H-MRS או proton magnetic resonance spectroscopy היא השיטה הרגישה ביותר והבלתי-חודרנית לקביעת חסר קראטין והצטברות GAA המקובלת, במרכזים רפואיים המצוידים לכך. עם זאת ברוב המוסדות חסר ב-GAMT מתגלה על ידי מידת GAA בשתן בשל נוחיותה, רגישותה והספציפיות שלה (Marescau ב-Metabolism משנת 1992).
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון תסמנות גנטיות
- בדיקות מעבדה - מפגעי מערכת העצבים והמוח
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק