הבדלים בין גרסאות בדף "רעלת היריון חמורה - אבחנה מבדלת - Severe preeclampsia - differential diagnosis"
| שורה 13: | שורה 13: | ||
}} | }} | ||
{{הרחבה|ערכים=[[זאבת אדמנתית מערכתית]], [[טרומבוציטופניה]]}} | {{הרחבה|ערכים=[[זאבת אדמנתית מערכתית]], [[טרומבוציטופניה]]}} | ||
| − | |||
| − | |||
| − | |||
| − | |||
| − | ==Acute failure of liver== | + | באבחנה המבדלת של '''[[רעלת היריון חמורה]]''' נמצאים ארבעה מצבים עיקריים: |
| + | *[[כבד שומני של היריון]] (Acute fatty liver of pregnancy) | ||
| + | *[[ארגמנת של קרישה וחסר טסיות]] (TTP, {{כ}}Thrombotic Thrombocytopenic Purpura) | ||
| + | *[[תסמונת המולטית-אורמית]] (HUS, {{כ}}Hemolytic Uremic Syndrome) | ||
| + | *התלקחות חריפה של [[זאבת אדמנתית מערכתית]] (Acute exacerbation of systemic lupus erythematosus) | ||
| + | |||
| + | ==אי ספיקת כבד חריפה (Acute failure of liver)== | ||
| + | |||
| + | === אפידמיולוגיה === | ||
שכיחות AFL :{כ}} 1/10,000 עד 1/15,000 לידות. מחלה המאפיינת את הטרימסטר השלישי. שכיחה יותר בנוליפרות ובהריונות מרובי עוברים. הקליניקה מתחילה בממוצע בשבוע 36 (27-40), ולעתים רק לאחר הלידה. | שכיחות AFL :{כ}} 1/10,000 עד 1/15,000 לידות. מחלה המאפיינת את הטרימסטר השלישי. שכיחה יותר בנוליפרות ובהריונות מרובי עוברים. הקליניקה מתחילה בממוצע בשבוע 36 (27-40), ולעתים רק לאחר הלידה. | ||
| + | |||
| + | === אטיולוגיה === | ||
| + | |||
| + | תורשה רצסיבית של פגם מיטוכונדריאלי באוקסידציה של חומצות שומן. המוטציה השכיחה פוגעת בגן שמקודד ל- 3 long chain hydroxyacyl-CoA-dehydregenase המכונה בפי העם -LCHAD. | ||
| + | |||
| + | חסר הומוזיגוטי ב-LCHAD בעובר גורם לתסמונת דמוית Reye, בעוד בחלק מהאמהות ההטרוזיגוטיות שלהם נמצא כבד שומני. יש הטוענים שאמא הטרוזיגוטית נמצאת בסיכון רק אם העובר הומוזיגוט. השליה של עובר חסר LCHAD יכולה לייצר מטבוליטים טוקסיים לכבד האם. | ||
| + | |||
| + | המצב קשור בתחלואה ותמותה אימהית גבוהה, בעבר דווח על תמותה אימהית של 70%, אם כי כיום מדובר על פחות מ- 10%. | ||
| + | הסיבוכים לאחר הלידה: ספסיס (10%), בצקת ריאות ו-ARDS {{כ}}(44%) , היפוגליקמיה, DIC, פנקראטיטיס (15%). | ||
| + | |||
| + | גם התחלואה והתמותה העוברית גבוהים, בממוצע 15%. לאור השיעור הגבוה של לידות מוקדמות (74%) גם התחלואה העוברית גבוהה. גיל הלידה הממוצע - שבוע 34 (25-42). | ||
| + | |||
| + | === קליניקה === | ||
סמפטומים מתפתחים תוך ימים עד שבועיים: בחילות, אנורקסיה, הקאות, כאב אפיגסטרי, כאב ראש או צהבת פרוגרסיבית. לעתים התלונה הראשונית תהיה צירים מוקדמים והפחתה בתנועות העובר. 15-20% יכולות להיות אסימפטומטיות. | סמפטומים מתפתחים תוך ימים עד שבועיים: בחילות, אנורקסיה, הקאות, כאב אפיגסטרי, כאב ראש או צהבת פרוגרסיבית. לעתים התלונה הראשונית תהיה צירים מוקדמים והפחתה בתנועות העובר. 15-20% יכולות להיות אסימפטומטיות. | ||
| − | |||
'''בבדיקה פיסיקלית''' נתרשם מאישה חולה עם צהבת, לעתים גם חום מעט גבוה. | '''בבדיקה פיסיקלית''' נתרשם מאישה חולה עם צהבת, לעתים גם חום מעט גבוה. | ||
| שורה 29: | שורה 45: | ||
בדיקה נוירולוגית יכולה להיות תקינה, דרך בלבול ועד קומה. | בדיקה נוירולוגית יכולה להיות תקינה, דרך בלבול ועד קומה. | ||
| + | |||
| + | === אבחנה === | ||
'''מעבדה''': hemoconcentration עקב capillary leakage, עליה בספירה לבנה, טסיות תקינות או נמוכות. | '''מעבדה''': hemoconcentration עקב capillary leakage, עליה בספירה לבנה, טסיות תקינות או נמוכות. | ||
| שורה 44: | שורה 62: | ||
*drug-induced hepatic toxicity (אקמול, טטרהציקלין, מטיל-דופה). | *drug-induced hepatic toxicity (אקמול, טטרהציקלין, מטיל-דופה). | ||
| − | + | === טיפול === | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | + | המחלה יכולה להידרדר במהירות ולכן יש לאשפז את היולדת. | |
NRFH בניטור יכול להיות תוצאה של אצידוזיס אימהי או הפחתה בפרפוזיית הדם לשליה. במקרה של דימום וקואגולופתיה, נטפל במוצרי דם. הטיפול האולטימטיבי יהיה ייצוב היולדת ויילוד. אין בהכרח אינדיקציה לניתוח קיסרי לאור החשש מדימום. | NRFH בניטור יכול להיות תוצאה של אצידוזיס אימהי או הפחתה בפרפוזיית הדם לשליה. במקרה של דימום וקואגולופתיה, נטפל במוצרי דם. הטיפול האולטימטיבי יהיה ייצוב היולדת ויילוד. אין בהכרח אינדיקציה לניתוח קיסרי לאור החשש מדימום. | ||
| שורה 67: | שורה 78: | ||
==Thrombotic Microangiopathies== | ==Thrombotic Microangiopathies== | ||
| + | |||
| + | == אפידמיולוגיה == | ||
HUS- TTP נדירים בהיריון. פחות מ- 1/100,000 הריונות. | HUS- TTP נדירים בהיריון. פחות מ- 1/100,000 הריונות. | ||
| + | |||
| + | === TTP === | ||
| + | |||
| + | ==== אטיולוגיה ==== | ||
שניהם (ובעיקר TTP) שכיחים יותר בנשים, מה שמרמז אולי על אתיולוגיה אוטואימונית. חולות עם TTP בהיריון יתכן ויש להן TTP משפחתי/ קונגניטלי או TTP אידיופתי. ההפרעה מתבטאת באגרגציה סיסטמית או כליתית של טסיות בתוך הארטריולות והקפילרות יחד עם פגיעה באנדותל. נמצא רמות גבוהות של החלבון האנדותליאלי טרומבומודולין, ומולטימרים גדולים של WVF. המולקולות הגדולות הללו גורמות לאגרגצית הטסיות בכלי הדם המתבטאת בטרומבוציטופניה ובפגיעה ב-RBC{{כ}} --->{{כ}}microangiopathic hemolytic anemia . רוב WVFs מגיע מהאנדותל, אך חלקו גם מופרש ע"י הטסיות. | שניהם (ובעיקר TTP) שכיחים יותר בנשים, מה שמרמז אולי על אתיולוגיה אוטואימונית. חולות עם TTP בהיריון יתכן ויש להן TTP משפחתי/ קונגניטלי או TTP אידיופתי. ההפרעה מתבטאת באגרגציה סיסטמית או כליתית של טסיות בתוך הארטריולות והקפילרות יחד עם פגיעה באנדותל. נמצא רמות גבוהות של החלבון האנדותליאלי טרומבומודולין, ומולטימרים גדולים של WVF. המולקולות הגדולות הללו גורמות לאגרגצית הטסיות בכלי הדם המתבטאת בטרומבוציטופניה ובפגיעה ב-RBC{{כ}} --->{{כ}}microangiopathic hemolytic anemia . רוב WVFs מגיע מהאנדותל, אך חלקו גם מופרש ע"י הטסיות. | ||
חלבון בשם ADAMTS13 המופרש לרוב מהפטוציטים, מונע בד״כ מהמולקולות הגדולות לחדור לכלי הדם (שייך למשפחת המטלופרוטאינזות). ברוב החולים עם TTP נרכש, פעילות ADAMTS13S נמוכה מ-5% מה שמונע פרוק של WVF עם הפרשתו מהאנדותל. | חלבון בשם ADAMTS13 המופרש לרוב מהפטוציטים, מונע בד״כ מהמולקולות הגדולות לחדור לכלי הדם (שייך למשפחת המטלופרוטאינזות). ברוב החולים עם TTP נרכש, פעילות ADAMTS13S נמוכה מ-5% מה שמונע פרוק של WVF עם הפרשתו מהאנדותל. | ||
| + | |||
| + | ==== קליניקה ==== | ||
| + | |||
הקליניקה הקלאסית TTPs כוללת פנטדה: טרומבוציטופניה, microangiopathic hemolytic anemia, הפרעות נוירולוגיות, חום, והפרעה בתפקודי כליות. נראה את הפנטדה המלאה ב-40% מהחולות. בעוד ב-50-75% נראה טריאדה של טרומבופניה אנמיה המוליטית, והפרעות נוירולוגיות. האנמיה והטרומבופניה יהיו קשים. | הקליניקה הקלאסית TTPs כוללת פנטדה: טרומבוציטופניה, microangiopathic hemolytic anemia, הפרעות נוירולוגיות, חום, והפרעה בתפקודי כליות. נראה את הפנטדה המלאה ב-40% מהחולות. בעוד ב-50-75% נראה טריאדה של טרומבופניה אנמיה המוליטית, והפרעות נוירולוגיות. האנמיה והטרומבופניה יהיו קשים. | ||
| שורה 82: | שורה 102: | ||
המעורבות הכליתית: המטוריה, פרוטאינוריה, אי ספיקת כליות. השתן יהיה בצבע של תה, כמו ב-HELLP (בניגוד לשתן AFLs שיהיה צהוב בהיר). יתכן ויהיה גם יתר ל.ד. | המעורבות הכליתית: המטוריה, פרוטאינוריה, אי ספיקת כליות. השתן יהיה בצבע של תה, כמו ב-HELLP (בניגוד לשתן AFLs שיהיה צהוב בהיר). יתכן ויהיה גם יתר ל.ד. | ||
| + | |||
| + | ==== אבחנה ==== | ||
במעבדה: טסיות מתחת 100,000 טסיות ל-ממ<sup>3</sup>, ואף פחות מ- 20,000. המטוקריט נמוך מ-25%, LDH גבוה, במשטח דם נראה שברי תאים (schistocytes ותאי helmet). | במעבדה: טסיות מתחת 100,000 טסיות ל-ממ<sup>3</sup>, ואף פחות מ- 20,000. המטוקריט נמוך מ-25%, LDH גבוה, במשטח דם נראה שברי תאים (schistocytes ותאי helmet). | ||
| שורה 89: | שורה 111: | ||
תפקודי הכבד לרוב תקינים, כך גם תפקודי הקרישה. | תפקודי הכבד לרוב תקינים, כך גם תפקודי הקרישה. | ||
| − | + | ==== טיפול ==== | |
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
| − | |||
;טיפול: | ;טיפול: | ||
| שורה 112: | שורה 126: | ||
טיפול אימונוסופרסיבי כולל: סטרואידים, ציקלופוספמיד, וינקריסטין ו- rituximab (=מבטרה, שהוא אנטי CD20 הנמצא על גבי B לימפוציטים. המבטרה גורמת להרס הלימפוציטים). | טיפול אימונוסופרסיבי כולל: סטרואידים, ציקלופוספמיד, וינקריסטין ו- rituximab (=מבטרה, שהוא אנטי CD20 הנמצא על גבי B לימפוציטים. המבטרה גורמת להרס הלימפוציטים). | ||
| + | ==== פרוגנוזה ==== | ||
| + | |||
| + | התחלואה והתמותה האימהיים גבוהים בהריונות עם TTP או HUS. אם כי בעשורים האחרונים, עם האפשרות לביצוע plasma exchange התמותה מדווחת על 0-10% (לעומת 60% בשנות ה-60). | ||
| + | |||
| + | הסדרות האחרונות מדווחות על 20% perinatal mortality לעומת 80% בעבר. רוב מקרי TTPs המופיעים במהלך ההיריון יופיעו בשבוע ממוצע: 26. נראה הפחתה בזרימת הדם לרחם/ שליה הנובעת מהיפוקסיה אימהית או מנגעים וסקולריים בשליה. | ||
| + | |||
| + | === HUS === | ||
| + | |||
| + | ==== אטיולוגיה ==== | ||
| + | |||
| + | HUS- נדיר מאוד בהיריון. כמעט כל המקרים תוארו בין יומיים ל-10 שבועות לאחר הלידה. הפגיעה המיקרו וסקולרית פוגעת בעיקר בכליה ונובעת ממשקעי פיברין בגלומרולים ובארטריולות. | ||
| + | |||
| + | ==== קליניקה ==== | ||
| + | |||
| + | החולות יגיעו עם בצקת, יתר ל.ד, דימום או אי ספיקת כליות קשה. | ||
| + | |||
| + | תמיד נמצא המטוריה ופרוטאינוריה מיקרוסקופית. רוב החולות HUSs במהלך או לאחר הלידה יוותרו עם נזק כליתי כלשהו. | ||
| + | |||
| + | ==== אבחנה ==== | ||
| + | |||
| + | המעבדה דומה ^TTP אך בדרגה קלה יותר, למעט התפקוד הכלייתי שיהיה תמיד פגוע משמעותית. | ||
| + | |||
| + | ==== טיפול ==== | ||
| + | |||
הטיפול ב-HUS דומה ל-TTP, אם כי רוב החולים לא יגיבו לפלסמהפרזיס ויזדקקו גם לדיאליזה. בניגוד ל-HELLP ו-AFL שם ילוד הוא הטיפול העיקרי, ניתן להמשיך הריונות עם TTP או HUS הרחוקים מהמועד, תוך טיפול מתאים, ומעקב קפדני לזיהוי relapse אם יתרחש. | הטיפול ב-HUS דומה ל-TTP, אם כי רוב החולים לא יגיבו לפלסמהפרזיס ויזדקקו גם לדיאליזה. בניגוד ל-HELLP ו-AFL שם ילוד הוא הטיפול העיקרי, ניתן להמשיך הריונות עם TTP או HUS הרחוקים מהמועד, תוך טיפול מתאים, ומעקב קפדני לזיהוי relapse אם יתרחש. | ||
| שורה 118: | שורה 156: | ||
==Exacerbation of SLE== | ==Exacerbation of SLE== | ||
| − | מחלה אוטואימונית המאופיינת במשקעי קומפלקסים של אנטיגן-נוגדן בקפילרות ובאיברים שונים. | + | === אפידמיולוגיה === |
| + | |||
| + | רוב החולים יהיו נשים בגיל הפריון (26-40). | ||
| + | |||
| + | === אטיולוגיה === | ||
| + | |||
| + | מחלה אוטואימונית המאופיינת במשקעי קומפלקסים של אנטיגן-נוגדן בקפילרות ובאיברים שונים. | ||
| + | |||
| + | === קליניקה === | ||
| + | |||
| + | הסימנים הקלינים תלויים באיבר הפגוע - כליה, ריאות, מח, כבד. | ||
| + | |||
| + | === אבחנה === | ||
בחולות עם lupus nephritis הקליניקה והמעבדה דומים ^severe PET: יתר ל.ד, פרוטאינוריה והמטוריה מיקרוסקופית. בחלק מהנשים, בעיקר בזמן החמרה, נראה טרומבופניה עד 50,000. | בחולות עם lupus nephritis הקליניקה והמעבדה דומים ^severe PET: יתר ל.ד, פרוטאינוריה והמטוריה מיקרוסקופית. בחלק מהנשים, בעיקר בזמן החמרה, נראה טרומבופניה עד 50,000. | ||
| שורה 129: | שורה 179: | ||
APLA קטסטרופלי מופיע בפחות מ-1% מהחולות עם נוגדנים מסוג אנטיפוספוליפיד. מאופיין בארועים טרומבוטיים מיקרואנגיופתיים המשפיעים על כלי דם קטנים, לפחות ב-3 איברים. הפגיעות הנפוצות: כליה, לב-ריאות ומוח. מעורבות של הכבד יכולה לגרום לאינפרקט ונמק | APLA קטסטרופלי מופיע בפחות מ-1% מהחולות עם נוגדנים מסוג אנטיפוספוליפיד. מאופיין בארועים טרומבוטיים מיקרואנגיופתיים המשפיעים על כלי דם קטנים, לפחות ב-3 איברים. הפגיעות הנפוצות: כליה, לב-ריאות ומוח. מעורבות של הכבד יכולה לגרום לאינפרקט ונמק | ||
| − | + | === טיפול === | |
| + | |||
הטיפול ב-flare של SLE במהלך היריון תלוי באיברים המעורבים, במעבדה ובהימצאות נפריטיס. הטיפול כולל לרוב קורטיקוסטרואידים, low-dose aspirin, הידרוקסיכלורוקווין והפרין. סטרואידים לרוב במינון של 40-80 מ״ג ביום של פרדניזון, ואספירין - 80 מ״ג ביום. פרדניזון ניתן בלופוס נפריטיס, בעוד פרדניזון+אספירין ניתן לחולות עם APLA. | הטיפול ב-flare של SLE במהלך היריון תלוי באיברים המעורבים, במעבדה ובהימצאות נפריטיס. הטיפול כולל לרוב קורטיקוסטרואידים, low-dose aspirin, הידרוקסיכלורוקווין והפרין. סטרואידים לרוב במינון של 40-80 מ״ג ביום של פרדניזון, ואספירין - 80 מ״ג ביום. פרדניזון ניתן בלופוס נפריטיס, בעוד פרדניזון+אספירין ניתן לחולות עם APLA. | ||
| שורה 135: | שורה 186: | ||
ב-APLA קטסטרופית, ניתן אנטיקואגולציה מלאה עם הפרין, בשילוב פלסמפרזיס. | ב-APLA קטסטרופית, ניתן אנטיקואגולציה מלאה עם הפרין, בשילוב פלסמפרזיס. | ||
| + | |||
| + | === פרוגנוזה === | ||
הפרוגנוזה לרוב תהיה טובה בחולות עם SLE ברמיסיה לפניי כניסה להיריון וללא flare במהלך ההיריון. גם בקרב חולות ללא לופוס נפריטיס וחולות ללא APLA. התחלואה האמהית והתחלואה והתמותה הפרינטאלית עולים אם יש נפריטיס, מעורבות CNS או APLA. במצבים כאלה שיעור IUFDs עומד על 4-19%, שיעור PTL-™ IUGRs עומד על 38-54%, הנגרמים מטרומבוזיס וסקולרי בדצידואה ונמק ודימום בשליה. הסיבוכים האימהיים כוללים early onset preeclampsia, וסיבוכים הקשורים לטרומבואמבוליזם מיקרואנגיופתי. | הפרוגנוזה לרוב תהיה טובה בחולות עם SLE ברמיסיה לפניי כניסה להיריון וללא flare במהלך ההיריון. גם בקרב חולות ללא לופוס נפריטיס וחולות ללא APLA. התחלואה האמהית והתחלואה והתמותה הפרינטאלית עולים אם יש נפריטיס, מעורבות CNS או APLA. במצבים כאלה שיעור IUFDs עומד על 4-19%, שיעור PTL-™ IUGRs עומד על 38-54%, הנגרמים מטרומבוזיס וסקולרי בדצידואה ונמק ודימום בשליה. הסיבוכים האימהיים כוללים early onset preeclampsia, וסיבוכים הקשורים לטרומבואמבוליזם מיקרואנגיופתי. | ||
גרסה מ־16:20, 28 ביולי 2013
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| רעלת היריון חמורה - אבחנה מבדלת | ||
|---|---|---|
| Severe preeclampsia - differential diagnosis | ||
| יוצר הערך | דר' מאור ממן | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – זאבת אדמנתית מערכתית, טרומבוציטופניה
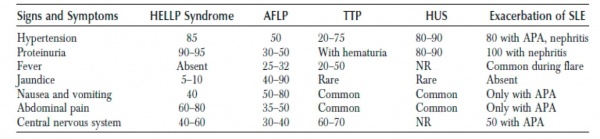
באבחנה המבדלת של רעלת היריון חמורה נמצאים ארבעה מצבים עיקריים:
- כבד שומני של היריון (Acute fatty liver of pregnancy)
- ארגמנת של קרישה וחסר טסיות (TTP, Thrombotic Thrombocytopenic Purpura)
- תסמונת המולטית-אורמית (HUS, Hemolytic Uremic Syndrome)
- התלקחות חריפה של זאבת אדמנתית מערכתית (Acute exacerbation of systemic lupus erythematosus)
אי ספיקת כבד חריפה (Acute failure of liver)
אפידמיולוגיה
שכיחות AFL :{כ}} 1/10,000 עד 1/15,000 לידות. מחלה המאפיינת את הטרימסטר השלישי. שכיחה יותר בנוליפרות ובהריונות מרובי עוברים. הקליניקה מתחילה בממוצע בשבוע 36 (27-40), ולעתים רק לאחר הלידה.
אטיולוגיה
תורשה רצסיבית של פגם מיטוכונדריאלי באוקסידציה של חומצות שומן. המוטציה השכיחה פוגעת בגן שמקודד ל- 3 long chain hydroxyacyl-CoA-dehydregenase המכונה בפי העם -LCHAD.
חסר הומוזיגוטי ב-LCHAD בעובר גורם לתסמונת דמוית Reye, בעוד בחלק מהאמהות ההטרוזיגוטיות שלהם נמצא כבד שומני. יש הטוענים שאמא הטרוזיגוטית נמצאת בסיכון רק אם העובר הומוזיגוט. השליה של עובר חסר LCHAD יכולה לייצר מטבוליטים טוקסיים לכבד האם.
המצב קשור בתחלואה ותמותה אימהית גבוהה, בעבר דווח על תמותה אימהית של 70%, אם כי כיום מדובר על פחות מ- 10%. הסיבוכים לאחר הלידה: ספסיס (10%), בצקת ריאות ו-ARDS (44%) , היפוגליקמיה, DIC, פנקראטיטיס (15%).
גם התחלואה והתמותה העוברית גבוהים, בממוצע 15%. לאור השיעור הגבוה של לידות מוקדמות (74%) גם התחלואה העוברית גבוהה. גיל הלידה הממוצע - שבוע 34 (25-42).
קליניקה
סמפטומים מתפתחים תוך ימים עד שבועיים: בחילות, אנורקסיה, הקאות, כאב אפיגסטרי, כאב ראש או צהבת פרוגרסיבית. לעתים התלונה הראשונית תהיה צירים מוקדמים והפחתה בתנועות העובר. 15-20% יכולות להיות אסימפטומטיות. בבדיקה פיסיקלית נתרשם מאישה חולה עם צהבת, לעתים גם חום מעט גבוה.
לחלק מהנשים יש יתר ל.ד, פרוטאינוריה ובצקת כמו בפרה-אקלמפסיה, וגם מיימת או דימום מקואגולופתיה קשה.
בדיקה נוירולוגית יכולה להיות תקינה, דרך בלבול ועד קומה.
אבחנה
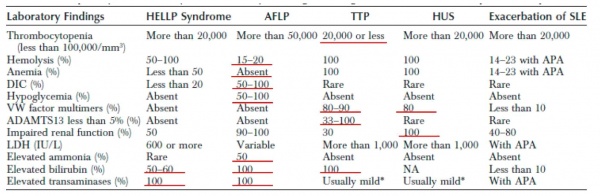
מעבדה: hemoconcentration עקב capillary leakage, עליה בספירה לבנה, טסיות תקינות או נמוכות.
לרוב נמצא פיברינוגנן נמוך, PT מוארך, ורמה נמוכה של אנטיטרומבין. הסיבה: יצור מופחת בכבד. התמונה דומה ^DIC, רק שכאן הבעיה ביצור מופחת ולא בצריכת יתר של גורמי הקרישה. נמצא גם אצידוזיס מטבולית, ועליה בקריאטינין ובחומצה האורית.
רמות הגלוקוז יכולות להיות גבוהות עקב פנקריאטיטיס משני. במקרה כזה גם עמילאז וליפאז יעלו. הטרנסאמינזות מוגברות, כמו גם הבילירובין, בעיקר המצומד, המגיע לרמה של מעל 5 mg/dL. בשלבים מתקדמים של המחלה גם האמוניה תעלה. בדיקות ההדמיה: MRI- CT ,US אינן רגישות לאבחנת AFL .
האבחנה תתקבל בביופסיה של הכבד, אם כי נדיר שנבצע ביופסית כבד במהלך היריון. הכבד שומני ומאופיין בהצטברות של מיקרווסיקולות של שומן שדוחקות את התפקוד התקין של ההפטוציטים. הכבד נראה קטן, רך, שומני וצהוב. ההפטוציטים נפוחים, עם גרעין מרכזי, וציטופלזמה מלאה בוסיקולות של שומן. אין נקרוזיס הפטוצלולרי, המרווח הפרי-פורטלי אינו מעורב (בניגוד לפרהאקלמפסיה).
באבחנה מבדלת:
- cholestasis of pregnancy
- Budd-Chiari syndrome
- (Reye's syndrome (adult-onset
- drug-induced hepatic toxicity (אקמול, טטרהציקלין, מטיל-דופה).
טיפול
המחלה יכולה להידרדר במהירות ולכן יש לאשפז את היולדת.
NRFH בניטור יכול להיות תוצאה של אצידוזיס אימהי או הפחתה בפרפוזיית הדם לשליה. במקרה של דימום וקואגולופתיה, נטפל במוצרי דם. הטיפול האולטימטיבי יהיה ייצוב היולדת ויילוד. אין בהכרח אינדיקציה לניתוח קיסרי לאור החשש מדימום.
מקובל להתחיל בהשראת לידה. בגלל הקואגולופתיה, המרדימים ימנעו מלתת אפידורל. לאחר הלידה יש להמשיך בניטור צמוד, כולל מאזן נוזלים, מעקב אחר הגלוקוז (עקב הנטיה לפתח היפוגליקמיה לאחר הלידה), ולשמור על גלוקוז מעל 60 mg/dL
יש לעקוב גם אחר ליפאז ועמילאז מאחר ופנקראטיטיס משני יכול לסכן חיים.
רוב הנשים מתחילות להשתפר תוך 2-3 ימים. בחלק מהמקרים ההידרדרות יכולה להימשך עד שבוע לאחר הלידה. במקרים נדירים יתפתח fulminant hepatic failure ויהיה צורך בהשתלת כבד. בימים הראשונים לאחר הלידה יתכן ונראה diabetes insipidus זמנית.
נשאיות של המוטציה LCHADs נמצאות בסיכון לחזרה של המחלה בהיריון הבא, במיוחד אם העובר בהיריון הבא חולה אף הוא. בנשים ללא המוטציה, המחלה לא חוזרת בהיריון הבא.
Thrombotic Microangiopathies
אפידמיולוגיה
HUS- TTP נדירים בהיריון. פחות מ- 1/100,000 הריונות.
TTP
אטיולוגיה
שניהם (ובעיקר TTP) שכיחים יותר בנשים, מה שמרמז אולי על אתיולוגיה אוטואימונית. חולות עם TTP בהיריון יתכן ויש להן TTP משפחתי/ קונגניטלי או TTP אידיופתי. ההפרעה מתבטאת באגרגציה סיסטמית או כליתית של טסיות בתוך הארטריולות והקפילרות יחד עם פגיעה באנדותל. נמצא רמות גבוהות של החלבון האנדותליאלי טרומבומודולין, ומולטימרים גדולים של WVF. המולקולות הגדולות הללו גורמות לאגרגצית הטסיות בכלי הדם המתבטאת בטרומבוציטופניה ובפגיעה ב-RBC --->microangiopathic hemolytic anemia . רוב WVFs מגיע מהאנדותל, אך חלקו גם מופרש ע"י הטסיות.
חלבון בשם ADAMTS13 המופרש לרוב מהפטוציטים, מונע בד״כ מהמולקולות הגדולות לחדור לכלי הדם (שייך למשפחת המטלופרוטאינזות). ברוב החולים עם TTP נרכש, פעילות ADAMTS13S נמוכה מ-5% מה שמונע פרוק של WVF עם הפרשתו מהאנדותל.
קליניקה
הקליניקה הקלאסית TTPs כוללת פנטדה: טרומבוציטופניה, microangiopathic hemolytic anemia, הפרעות נוירולוגיות, חום, והפרעה בתפקודי כליות. נראה את הפנטדה המלאה ב-40% מהחולות. בעוד ב-50-75% נראה טריאדה של טרומבופניה אנמיה המוליטית, והפרעות נוירולוגיות. האנמיה והטרומבופניה יהיו קשים.
ה-presenting symptoms יהיו כאב בטן, חום, בחילה, הקאה, דימום גסטרואינטסטינלי, אפיסטקסיס, פטכיות או פורפורות.
ההפרעות הנוירולוגיות יכולות להיות: כאב ראש, הפרעות ראיה, בלבול, אפזיה, שיתוק זמני, חולשה ופרכוסים.
חום יופיע ב 30-40% מהמקרים. לרוב לא יהיה גבוה מ-38.4°.
המעורבות הכליתית: המטוריה, פרוטאינוריה, אי ספיקת כליות. השתן יהיה בצבע של תה, כמו ב-HELLP (בניגוד לשתן AFLs שיהיה צהוב בהיר). יתכן ויהיה גם יתר ל.ד.
אבחנה
במעבדה: טסיות מתחת 100,000 טסיות ל-ממ3, ואף פחות מ- 20,000. המטוקריט נמוך מ-25%, LDH גבוה, במשטח דם נראה שברי תאים (schistocytes ותאי helmet).
מקור ה-LDH הוא בעיקר נזק איסכמי לרקמות ולא רק מהרס RBCs.
תפקודי הכבד לרוב תקינים, כך גם תפקודי הקרישה.
טיפול
- טיפול
יש להיוועץ עם נפרולוג ונוירולוג. הטיפול מבוסס על עירוי פלסמה ו- plasma exchange .
ב-FFP וקריופרציפיטט יש את המטלופרוטאינאז החסר.
פלסמפרזיס מסייעת לסלק את המולטימרים הגדולים של WVF ואת ^autoantibodies נגד ה-ADAMTS13. הטיפול יעיל ב-90% מהמקרים. לעירוי פלסמה לבדו יש שיעור תגובה של 64%. יש להתחיל טיפול מיד עם האבחנה. תוך מספר ימים נראה שיפור שיתבטא בעליה בספירת הטסיות ובירידה ב-LDH .
חלק מהחולות, להן טיטר נוגדנים גבוה כנגד ADAMTS13 לא יגיבו לפלסמהפרזיס בלבד. חולות אלה יזדקקו לטיפול אימונוסופרסיבי ו/או ספלנקטומי. יש להימנע מלתת עירוי טסיות מחשש לטרומבוזיס מיקרווסקולרי.
עירוי RBC- ניתן לפי הצורך הקליני.
טיפול אימונוסופרסיבי כולל: סטרואידים, ציקלופוספמיד, וינקריסטין ו- rituximab (=מבטרה, שהוא אנטי CD20 הנמצא על גבי B לימפוציטים. המבטרה גורמת להרס הלימפוציטים).
פרוגנוזה
התחלואה והתמותה האימהיים גבוהים בהריונות עם TTP או HUS. אם כי בעשורים האחרונים, עם האפשרות לביצוע plasma exchange התמותה מדווחת על 0-10% (לעומת 60% בשנות ה-60).
הסדרות האחרונות מדווחות על 20% perinatal mortality לעומת 80% בעבר. רוב מקרי TTPs המופיעים במהלך ההיריון יופיעו בשבוע ממוצע: 26. נראה הפחתה בזרימת הדם לרחם/ שליה הנובעת מהיפוקסיה אימהית או מנגעים וסקולריים בשליה.
HUS
אטיולוגיה
HUS- נדיר מאוד בהיריון. כמעט כל המקרים תוארו בין יומיים ל-10 שבועות לאחר הלידה. הפגיעה המיקרו וסקולרית פוגעת בעיקר בכליה ונובעת ממשקעי פיברין בגלומרולים ובארטריולות.
קליניקה
החולות יגיעו עם בצקת, יתר ל.ד, דימום או אי ספיקת כליות קשה.
תמיד נמצא המטוריה ופרוטאינוריה מיקרוסקופית. רוב החולות HUSs במהלך או לאחר הלידה יוותרו עם נזק כליתי כלשהו.
אבחנה
המעבדה דומה ^TTP אך בדרגה קלה יותר, למעט התפקוד הכלייתי שיהיה תמיד פגוע משמעותית.
טיפול
הטיפול ב-HUS דומה ל-TTP, אם כי רוב החולים לא יגיבו לפלסמהפרזיס ויזדקקו גם לדיאליזה. בניגוד ל-HELLP ו-AFL שם ילוד הוא הטיפול העיקרי, ניתן להמשיך הריונות עם TTP או HUS הרחוקים מהמועד, תוך טיפול מתאים, ומעקב קפדני לזיהוי relapse אם יתרחש.
יש להזהיר נשים מ- relapse שעלול להתרחש בהריונות הבאים. אם כי לא ברור מה הסיכון המדויק ל-HUS\TTP חוזר בהיריון הבא.
Exacerbation of SLE
אפידמיולוגיה
רוב החולים יהיו נשים בגיל הפריון (26-40).
אטיולוגיה
מחלה אוטואימונית המאופיינת במשקעי קומפלקסים של אנטיגן-נוגדן בקפילרות ובאיברים שונים.
קליניקה
הסימנים הקלינים תלויים באיבר הפגוע - כליה, ריאות, מח, כבד.
אבחנה
בחולות עם lupus nephritis הקליניקה והמעבדה דומים ^severe PET: יתר ל.ד, פרוטאינוריה והמטוריה מיקרוסקופית. בחלק מהנשים, בעיקר בזמן החמרה, נראה טרומבופניה עד 50,000.
בזמן הפאזה האקטיבית של אקססרבציה נראה פנציטופניה, טרומבופניה, אנמיה המוליטית, ועליה ב- . anti-DNA antibodies
רמות המשלים תקינות או נמוכות. Severe flare מופיע ב- 25-30% מהחולות, ויכול להופיע לראשונה בזמן היריון. נוגדנים מסוג אנטיפוספוליפיד (LAC או ACL) נמצאים ב- 30-40% מהחולות עם SLE. חולות אלה נמצאות בסיכון לאירועים טרומבוטיים, שיתבטאו התמונה הדומה ^HUS ,TTP ,HELLP ואקלמפסיה. טרומבוציטופניה תופיע ב-40-50% מחולות אלה. אנמיה המוליטית ב- 14-23%. סימנים נוירולוגים נגרמים מוסקוליטיס או מחסימת כלי דם צרברליים.
APLA קטסטרופלי מופיע בפחות מ-1% מהחולות עם נוגדנים מסוג אנטיפוספוליפיד. מאופיין בארועים טרומבוטיים מיקרואנגיופתיים המשפיעים על כלי דם קטנים, לפחות ב-3 איברים. הפגיעות הנפוצות: כליה, לב-ריאות ומוח. מעורבות של הכבד יכולה לגרום לאינפרקט ונמק
טיפול
הטיפול ב-flare של SLE במהלך היריון תלוי באיברים המעורבים, במעבדה ובהימצאות נפריטיס. הטיפול כולל לרוב קורטיקוסטרואידים, low-dose aspirin, הידרוקסיכלורוקווין והפרין. סטרואידים לרוב במינון של 40-80 מ״ג ביום של פרדניזון, ואספירין - 80 מ״ג ביום. פרדניזון ניתן בלופוס נפריטיס, בעוד פרדניזון+אספירין ניתן לחולות עם APLA.
חולות עם טרומבופניה שלא מגיבה לטיפול יזדקקו לטיפול ב-IVIG.
ב-APLA קטסטרופית, ניתן אנטיקואגולציה מלאה עם הפרין, בשילוב פלסמפרזיס.
פרוגנוזה
הפרוגנוזה לרוב תהיה טובה בחולות עם SLE ברמיסיה לפניי כניסה להיריון וללא flare במהלך ההיריון. גם בקרב חולות ללא לופוס נפריטיס וחולות ללא APLA. התחלואה האמהית והתחלואה והתמותה הפרינטאלית עולים אם יש נפריטיס, מעורבות CNS או APLA. במצבים כאלה שיעור IUFDs עומד על 4-19%, שיעור PTL-™ IUGRs עומד על 38-54%, הנגרמים מטרומבוזיס וסקולרי בדצידואה ונמק ודימום בשליה. הסיבוכים האימהיים כוללים early onset preeclampsia, וסיבוכים הקשורים לטרומבואמבוליזם מיקרואנגיופתי.
התמותה האימהית מגיעה ל-50% ב- Catastrophic APLA .
ביבליוגרפיה
- Sibai April 2007 - Clinical Expert Series + תוספות מ-williams
ראו גם
- לנושא הקודם: זיהום בנגיף וריצלה-זוסטר בהיריון - Varicella Zoster infection during pregnancy
- לנושא הבא: בדיקת דופלר במהלך ההיריון - Doppler test during pregnancy
המידע שבדף זה נכתב על ידי ד"ר מאור ממן, מרכז רפואי רבין, בילינסון-השרון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק