הבדלים בין גרסאות בדף "רעלת היריון חמורה - אבחנה מבדלת - Severe preeclampsia - differential diagnosis"
(←אבחנה) |
(←אבחנה) |
||
| שורה 57: | שורה 57: | ||
*[[תסמונת באד-קיארי]] (Budd Chiari syndrome) | *[[תסמונת באד-קיארי]] (Budd Chiari syndrome) | ||
*תסמונת ריי במבוגרים (Adult-onset Reye's syndrome) | *תסמונת ריי במבוגרים (Adult-onset Reye's syndrome) | ||
| − | *רעילות כבדית מושרית תרופות (drug-induced hepatic toxicity), לדוגמא כתוצאה מ[[Paracetamol]]{{כ}}, [[Recycline]]{{כ}} (Tetracycline){{כ}}, [[Methyldopa]] | + | *רעילות כבדית מושרית תרופות (drug-induced hepatic toxicity), לדוגמא כתוצאה מ[[Paracetamol]]{{כ}}, [[Recycline]]{{כ}} (Tetracycline){{כ}}, [[Methyldopa]] |
=== טיפול === | === טיפול === | ||
גרסה מ־17:46, 28 ביולי 2013
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| רעלת היריון חמורה - אבחנה מבדלת | ||
|---|---|---|
| Severe preeclampsia - differential diagnosis | ||
| יוצר הערך | דר' מאור ממן | |
לערכים נוספים הקשורים לנושא זה, ראו את דפי הפירושים: – זאבת אדמנתית מערכתית, טרומבוציטופניה
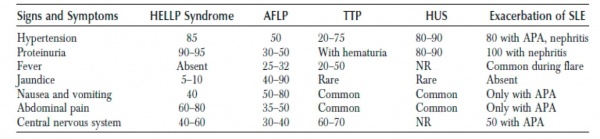
באבחנה המבדלת של רעלת היריון חמורה נמצאים ארבעה מצבים עיקריים:
- כבד שומני של היריון (AFLP, Acute Fatty Liver of Pregnancy)
- ארגמנת של קרישה וחסר טסיות (TTP, Thrombotic Thrombocytopenic Purpura)
- תסמונת המולטית-אורמית (HUS, Hemolytic Uremic Syndrome)
- התלקחות חריפה של זאבת אדמנתית מערכתית (Acute exacerbation of systemic lupus erythematosus)
אי ספיקת כבד חריפה (Acute failure of liver)
אפידמיולוגיה
שכיחותה של אי ספיקת כבד חריפה עומדת על 1/10,000 עד 1/15,000 לידות. זוהי מחלה המאפיינת את השליש השלישי להיריון. שכיחה יותר בנשים שלא ילדו מעולם (Nullipara) ובהריונות מרובי עוברים. הקליניקה מתחילה בממוצע בשבוע 36 (27-40), ולעתים רק לאחר הלידה.
אטיולוגיה
תורשה נַסְגָנִית (Recessive) של פגם מיטוכונדריאלי (Mitochondrial) בחמצון של חומצות שומן. התשנית (Mutation) השכיחה פוגעת בגן שמקודד ל- 3 LCHAD (Long Chain Hydroxyacyl-CoA-Dehydregenase).
חסר הומוזיגוטי (Homozygous) ב-LCHAD בעובר גורם לתסמונת דמוית תסמונת ריי (Reye syndrome), בעוד בחלק מהאמהות ההטרוזיגוטיות (Heterozygous) שלהם נמצא כבד שומני. יש הטוענים שאימא הטרוזיגוטית נמצאת בסיכון רק אם העובר הומוזיגוט. השליה של עובר חסר LCHAD יכולה לייצר חֲלִיפים (Metabolites) רעילים לכבד האם.
קליניקה
תסמינים מתפתחים תוך ימים עד שבועיים: בחילות, חוסר תיאבון, הקאות, כאב אפיגסטרי, כאב ראש או צהבת מתקדמת. לעתים התלונה הראשונית תהיה צירים מוקדמים והפחתה בתנועות העובר. 15-20% יכולות להיות א-תסמיניות.
בבדיקה גופנית האישה תיראה חולה עם צהבת, לעתים גם חום מעט גבוה. לחלק מהנשים יש יתר לחץ דם, פרוטאינוריה ובצקת כמו ברעלת היריון, וגם מיימת או דימום כתוצאה מהפרעות קרישה קשות. בדיקה נוירולוגית יכולה להיות תקינה, דרך בלבול ועד תרדמת.
אבחנה
בבדיקת דם:
- ריכוז דם (Hemoconcentration) עקב דליפה מהנימים (Capillary leakage)
- עליה בספירת תאי הדם הלבנים
- כמות טסיות תקינה או נמוכה
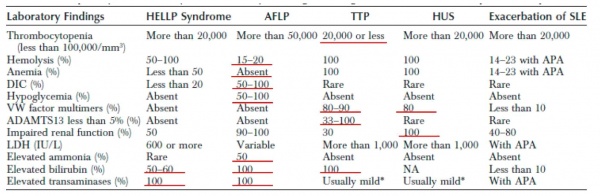
לרוב נמצא פיברינוגן נמוך, זמן פרותרומבין (PT, Prothrombin Time) מוארך, ורמה נמוכה של אנטיתרומבין, כאשר הסיבה הנה יצור מופחת שלהם בכבד. התמונה דומה לקרישה תוך כלית מפושטת (DIC, Disseminated Intravascular Coagulation), רק שכאן הבעיה ביצור מופחת ולא בצריכת יתר של גורמי הקרישה. נמצא גם חמצת מטבולית, ועליה בקראטינין ובחומצת שתן.
רמות הגלוקוז יכולות להיות גבוהות עקב דלקת לבלב משנית. במקרה כזה גם עמילאזה וליפאזה יעלו. הטרנסאמינזות מוגברות, כמו גם הבילירובין, בעיקר המצומד, המגיע לרמה של מעל 5 mg/dL (מיליגרם/דציליטר). בשלבים מתקדמים של המחלה גם האמוניה תעלה.
בדיקות ההדמיה בדיקת על-שמע (US, Ultrasound), טומוגרפיה ממוחשבת (CT, Computed Tomography), והדמיה בתהודה מגנטית (MRI, Magnetic Resonance Imaging), אינן רגישות לאבחנת אי ספיקת כבד.
האבחנה תתקבל בביופסיה של הכבד, אם כי נדיר שנבצע ביופסיית כבד במהלך היריון. הכבד שומני ומאופיין בהצטברות של שלפוחיות זעירות (Microvesicles) של שומן שדוחקות את התפקוד התקין של תא הכבד. הכבד נראה קטן, רך, שומני וצהוב. תאי הכבד נפוחים, עם גרעין מרכזי, וציטופלזמה מלאה בשלפוחיות של שומן. אין נמק תאי, והמרווח הסביב שערי (Peri-portal) אינו מעורב (בניגוד לרעת היריון).
באבחנה המבדלת נמצאים:
- עימדון מרה בהיריון (Cholestasis of pregnancy)
- תסמונת באד-קיארי (Budd Chiari syndrome)
- תסמונת ריי במבוגרים (Adult-onset Reye's syndrome)
- רעילות כבדית מושרית תרופות (drug-induced hepatic toxicity), לדוגמא כתוצאה מParacetamol, Recycline (Tetracycline), Methyldopa
טיפול
המחלה יכולה להידרדר במהירות ולכן יש לאשפז את היולדת.
NRFH בניטור יכול להיות תוצאה של חמצת אימהית או הפחתה בזילוח הדם לשליה. במקרה של דימום והפרעת קרישה, יש לטפל במוצרי דם. הטיפול המועדף יהיה ייצוב היולדת והיילוד. אין בהכרח התוויה לניתוח קיסרי לאור החשש מדימום.
מקובל להתחיל בהשראת לידה. בגלל הפרעת הקרישה, המרדימים ימנעו מלתת הרדמה אפידורלית. לאחר הלידה יש להמשיך בניטור צמוד, כולל מאזן נוזלים, מעקב אחר הגלוקוז (עקב הנטיה לפתח תת סוכר בדם לאחר הלידה), ולשמור על גלוקוז מעל 60 mg/dL. יש לעקוב גם אחר ליפאזה ועמילאזה מאחר ודלקת לבלב משנית יכולה לסכן חיים.
רוב הנשים מתחילות להשתפר תוך 2-3 ימים. בחלק מהמקרים ההידרדרות יכולה להימשך עד שבוע לאחר הלידה. במקרים נדירים יתפתח אי ספיקת כבד דוהרת (Fulminant) ויהיה צורך בהשתלת כבד. בימים הראשונים לאחר הלידה יתכן ונראה סוכרת תפלה (Diabetes Insipidus) זמנית.
פרוגנוזה
המצב קשור בתחלואה ותמותה אימהית גבוהה, כאשר בעבר דווח על תמותה אימהית של 70%, וכיום מדובר על פחות מ- 10%. הסיבוכים לאחר הלידה כוללים אלח דם (10%), בצקת ריאות ותסמונת מצוקה נשימתית חריפה (ARDS, Acute Respiratory Distress Syndrome) (44%) ,תת סוכר בדם, קרישה תוך כלית מפושטת, דלקת לבלב (15%).
התחלואה והתמותה העוברית גבוהים גם הם, בממוצע 15%, בעיקר לאור השיעור הגבוה של לידות מוקדמות (74%). גיל הלידה הממוצע הנו סביב שבוע 34 (25-42).
נשאיות של התשנית LCHAD נמצאות בסיכון לחזרה של המחלה בהיריון הבא, במיוחד אם העובר בהיריון הבא חולה אף הוא. בנשים ללא התשנית, המחלה איננה חוזרת בהיריון הבא.
Thrombotic Microangiopathies
TTP
אפידמיולוגיה
TTP נדירים בהיריון. פחות מ- 1/100,000 הריונות.
אטיולוגיה
שניהם (ובעיקר TTP) שכיחים יותר בנשים, מה שמרמז אולי על אתיולוגיה אוטואימונית. חולות עם TTP בהיריון יתכן ויש להן TTP משפחתי/ קונגניטלי או TTP אידיופתי. ההפרעה מתבטאת באגרגציה סיסטמית או כליתית של טסיות בתוך הארטריולות והקפילרות יחד עם פגיעה באנדותל. נמצא רמות גבוהות של החלבון האנדותליאלי טרומבומודולין, ומולטימרים גדולים של WVF. המולקולות הגדולות הללו גורמות לאגרגצית הטסיות בכלי הדם המתבטאת בטרומבוציטופניה ובפגיעה ב-RBC --->microangiopathic hemolytic anemia . רוב WVFs מגיע מהאנדותל, אך חלקו גם מופרש ע"י הטסיות.
חלבון בשם ADAMTS13 המופרש לרוב מהפטוציטים, מונע בד״כ מהמולקולות הגדולות לחדור לכלי הדם (שייך למשפחת המטלופרוטאינזות). ברוב החולים עם TTP נרכש, פעילות ADAMTS13S נמוכה מ-5% מה שמונע פרוק של WVF עם הפרשתו מהאנדותל.
קליניקה
הקליניקה הקלאסית TTPs כוללת פנטדה: טרומבוציטופניה, microangiopathic hemolytic anemia, הפרעות נוירולוגיות, חום, והפרעה בתפקודי כליות. נראה את הפנטדה המלאה ב-40% מהחולות. בעוד ב-50-75% נראה טריאדה של טרומבופניה אנמיה המוליטית, והפרעות נוירולוגיות. האנמיה והטרומבופניה יהיו קשים.
ה-presenting symptoms יהיו כאב בטן, חום, בחילה, הקאה, דימום גסטרואינטסטינלי, אפיסטקסיס, פטכיות או פורפורות.
ההפרעות הנוירולוגיות יכולות להיות: כאב ראש, הפרעות ראיה, בלבול, אפזיה, שיתוק זמני, חולשה ופרכוסים.
חום יופיע ב 30-40% מהמקרים. לרוב לא יהיה גבוה מ-38.4°.
המעורבות הכליתית: המטוריה, פרוטאינוריה, אי ספיקת כליות. השתן יהיה בצבע של תה, כמו ב-HELLP (בניגוד לשתן AFLs שיהיה צהוב בהיר). יתכן ויהיה גם יתר ל.ד.
אבחנה
במעבדה: טסיות מתחת 100,000 טסיות ל-ממ3, ואף פחות מ- 20,000. המטוקריט נמוך מ-25%, LDH גבוה, במשטח דם נראה שברי תאים (schistocytes ותאי helmet).
מקור ה-LDH הוא בעיקר נזק איסכמי לרקמות ולא רק מהרס RBCs.
תפקודי הכבד לרוב תקינים, כך גם תפקודי הקרישה.
טיפול
- טיפול
יש להיוועץ עם נפרולוג ונוירולוג. הטיפול מבוסס על עירוי פלסמה ו- plasma exchange .
ב-FFP וקריופרציפיטט יש את המטלופרוטאינאז החסר.
פלסמפרזיס מסייעת לסלק את המולטימרים הגדולים של WVF ואת ^autoantibodies נגד ה-ADAMTS13. הטיפול יעיל ב-90% מהמקרים. לעירוי פלסמה לבדו יש שיעור תגובה של 64%. יש להתחיל טיפול מיד עם האבחנה. תוך מספר ימים נראה שיפור שיתבטא בעליה בספירת הטסיות ובירידה ב-LDH .
חלק מהחולות, להן טיטר נוגדנים גבוה כנגד ADAMTS13 לא יגיבו לפלסמהפרזיס בלבד. חולות אלה יזדקקו לטיפול אימונוסופרסיבי ו/או ספלנקטומי. יש להימנע מלתת עירוי טסיות מחשש לטרומבוזיס מיקרווסקולרי.
עירוי RBC- ניתן לפי הצורך הקליני.
טיפול אימונוסופרסיבי כולל: סטרואידים, ציקלופוספמיד, וינקריסטין ו- rituximab (=מבטרה, שהוא אנטי CD20 הנמצא על גבי B לימפוציטים. המבטרה גורמת להרס הלימפוציטים).
פרוגנוזה
התחלואה והתמותה האימהיים גבוהים בהריונות עם TTP או HUS. אם כי בעשורים האחרונים, עם האפשרות לביצוע plasma exchange התמותה מדווחת על 0-10% (לעומת 60% בשנות ה-60).
הסדרות האחרונות מדווחות על 20% perinatal mortality לעומת 80% בעבר. רוב מקרי TTPs המופיעים במהלך ההיריון יופיעו בשבוע ממוצע: 26. נראה הפחתה בזרימת הדם לרחם/ שליה הנובעת מהיפוקסיה אימהית או מנגעים וסקולריים בשליה.
HUS
אפידמיולוגיה
HUS נדירים בהיריון. פחות מ- 1/100,000 הריונות.
אטיולוגיה
HUS- נדיר מאוד בהיריון. כמעט כל המקרים תוארו בין יומיים ל-10 שבועות לאחר הלידה. הפגיעה המיקרו וסקולרית פוגעת בעיקר בכליה ונובעת ממשקעי פיברין בגלומרולים ובארטריולות.
קליניקה
החולות יגיעו עם בצקת, יתר ל.ד, דימום או אי ספיקת כליות קשה.
תמיד נמצא המטוריה ופרוטאינוריה מיקרוסקופית. רוב החולות HUSs במהלך או לאחר הלידה יוותרו עם נזק כליתי כלשהו.
אבחנה
המעבדה דומה ^TTP אך בדרגה קלה יותר, למעט התפקוד הכלייתי שיהיה תמיד פגוע משמעותית.
טיפול
הטיפול ב-HUS דומה ל-TTP, אם כי רוב החולים לא יגיבו לפלסמהפרזיס ויזדקקו גם לדיאליזה. בניגוד ל-HELLP ו-AFL שם ילוד הוא הטיפול העיקרי, ניתן להמשיך הריונות עם TTP או HUS הרחוקים מהמועד, תוך טיפול מתאים, ומעקב קפדני לזיהוי relapse אם יתרחש.
יש להזהיר נשים מ- relapse שעלול להתרחש בהריונות הבאים. אם כי לא ברור מה הסיכון המדויק ל-HUS\TTP חוזר בהיריון הבא.
Exacerbation of SLE
אפידמיולוגיה
רוב החולים יהיו נשים בגיל הפריון (26-40).
אטיולוגיה
מחלה אוטואימונית המאופיינת במשקעי קומפלקסים של אנטיגן-נוגדן בקפילרות ובאיברים שונים.
קליניקה
הסימנים הקלינים תלויים באיבר הפגוע - כליה, ריאות, מח, כבד.
אבחנה
בחולות עם lupus nephritis הקליניקה והמעבדה דומים ^severe PET: יתר ל.ד, פרוטאינוריה והמטוריה מיקרוסקופית. בחלק מהנשים, בעיקר בזמן החמרה, נראה טרומבופניה עד 50,000.
בזמן הפאזה האקטיבית של אקססרבציה נראה פנציטופניה, טרומבופניה, אנמיה המוליטית, ועליה ב- . anti-DNA antibodies
רמות המשלים תקינות או נמוכות. Severe flare מופיע ב- 25-30% מהחולות, ויכול להופיע לראשונה בזמן היריון. נוגדנים מסוג אנטיפוספוליפיד (LAC או ACL) נמצאים ב- 30-40% מהחולות עם SLE. חולות אלה נמצאות בסיכון לאירועים טרומבוטיים, שיתבטאו התמונה הדומה ^HUS ,TTP ,HELLP ואקלמפסיה. טרומבוציטופניה תופיע ב-40-50% מחולות אלה. אנמיה המוליטית ב- 14-23%. סימנים נוירולוגים נגרמים מוסקוליטיס או מחסימת כלי דם צרברליים.
APLA קטסטרופלי מופיע בפחות מ-1% מהחולות עם נוגדנים מסוג אנטיפוספוליפיד. מאופיין בארועים טרומבוטיים מיקרואנגיופתיים המשפיעים על כלי דם קטנים, לפחות ב-3 איברים. הפגיעות הנפוצות: כליה, לב-ריאות ומוח. מעורבות של הכבד יכולה לגרום לאינפרקט ונמק
טיפול
הטיפול ב-flare של SLE במהלך היריון תלוי באיברים המעורבים, במעבדה ובהימצאות נפריטיס. הטיפול כולל לרוב קורטיקוסטרואידים, low-dose aspirin, הידרוקסיכלורוקווין והפרין. סטרואידים לרוב במינון של 40-80 מ״ג ביום של פרדניזון, ואספירין - 80 מ״ג ביום. פרדניזון ניתן בלופוס נפריטיס, בעוד פרדניזון+אספירין ניתן לחולות עם APLA.
חולות עם טרומבופניה שלא מגיבה לטיפול יזדקקו לטיפול ב-IVIG.
ב-APLA קטסטרופית, ניתן אנטיקואגולציה מלאה עם הפרין, בשילוב פלסמפרזיס.
פרוגנוזה
הפרוגנוזה לרוב תהיה טובה בחולות עם SLE ברמיסיה לפניי כניסה להיריון וללא flare במהלך ההיריון. גם בקרב חולות ללא לופוס נפריטיס וחולות ללא APLA. התחלואה האמהית והתחלואה והתמותה הפרינטאלית עולים אם יש נפריטיס, מעורבות CNS או APLA. במצבים כאלה שיעור IUFDs עומד על 4-19%, שיעור PTL-™ IUGRs עומד על 38-54%, הנגרמים מטרומבוזיס וסקולרי בדצידואה ונמק ודימום בשליה. הסיבוכים האימהיים כוללים early onset preeclampsia, וסיבוכים הקשורים לטרומבואמבוליזם מיקרואנגיופתי.
התמותה האימהית מגיעה ל-50% ב- Catastrophic APLA .
ביבליוגרפיה
- Sibai April 2007 - Clinical Expert Series + תוספות מ-williams
ראו גם
- לנושא הקודם: זיהום בנגיף וריצלה-זוסטר בהיריון - Varicella Zoster infection during pregnancy
- לנושא הבא: בדיקת דופלר במהלך ההיריון - Doppler test during pregnancy
המידע שבדף זה נכתב על ידי ד"ר מאור ממן, מרכז רפואי רבין, בילינסון-השרון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק