קדחת ים תיכונית משפחתית - Familial mediterranean fever
הופניתם מהדף Tumor Necrosis Factor Receptor Associated Periodic Fever Syndrome לדף הנוכחי.
| קדחת ים תיכונית משפחתית | ||
|---|---|---|
| Familial Mediterranean Fever | ||
| שמות נוספים | FMF | |
| ICD-10 | Chapter E 85.0 | |
| ICD-9 | 277.31 | |
| MeSH | D010505 | |
| יוצר הערך | ד"ר מרינה מיכלסון, ד"ר דורית לב
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – קדחת ים תיכונית משפחתית
קדחת ים תיכונית (Familial Mediterranean Fever, FMF) היא מחלה דלקתית תורשתית המאופיינת בהתקפים חוזרים של חום ודלקת קרום נסיובי (Serositis). זוהי אחת המחלות השכיחות ביותר מקבוצת תסמונות החום המחזוריות (Periodic fever disorders). המחלה מועברת בתורשה אוטוזומלית רצסיבית, והיא שכיחה ביוצאי עדות אגן הים התיכון, כולל יהודים, בעיקר יוצאי צפון אפריקה, טורקים, ערבים וארמנים[1]. המחלה נגרמת בעקבות מוטציות בגן MEFV[2][3]. טיפול קבוע בColchicine גורם להפסקת ההתקפים או לירידה ניכרת בחומרת המחלה ביותר מ-95% מהמקרים. הטיפול יעיל במניעת סיבוכים כלייתיים.
אפידמיולוגיה
המחלה שכיחה בעדות שונות מהאזור המזרחי של אגן הים התיכון, אצל יהודים בעיקר ממוצא לא אשכנזי, ארמנים, טורקים וערבים. המחלה נדירה בקבוצות אחרות אך תוארה גם אצל יוונים, איטלקים, קובנים ובלגים [4][5][6][7] ואף אצל יפנים[8].
שכיחות המחלה בקרב יהודים בישראל היא 1:250 עד 1:500. שכיחות הנשאות - 1:3-1:7 בקרב יהודים יוצאי צפון אפריקה, עירק ותורכיה, 1:7 בקרב הארמנים ו-1:11 בקרב יהודים אשכנזים [5]. המחלה שכיחה בשני המינים. יש דיווחים בספרות על שכיחות מוגברת אצל זכרים [1].
אטיולוגיה ופתוגנזה
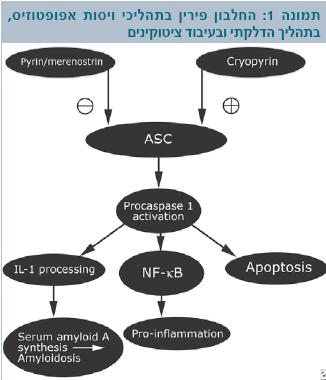
המחלה נגרמת ממוטציות סלף (Missense mutations) בגן MEFV הממוקם על הזרוע הקצרה של כרומוזום 16 (16p13.3). גן זה מקודד חלבון הנקרא פירין (Pyrin) או מרנוסטרין (Marenostrin כלומר Mare nostrum - הים שלנו) [9]. החלבון מורכב מ-781 חומצות אמינו. הוא נמצא עם צינורונים (Microtubules) ואקטין (Actin) בציטופלזמה (Cytoplasm) של התא, ומכיל 4 תחומים (Domains) (24,23). זיהוי הגן והחלבון שאליו הוא מקודד בשנת 1997 הובילו להתקדמות משמעותית בחקר המחלה. החלבון משתתף בתהליכי ויסות מוות תאי מתוכנת (Apoptosis), בתהליך דלקתי ובעיבוד ציטוקינים (Cytokines). הוא מתפקד כמדכא של דלקת בתאים פולימורפונוקלריים (PMN,Polymorphonuclear cells)[10]. תפקידו המרכזי הוא במערכת דלקתית בסיסית הנקראת אינפלמזום (Inflammasome). במערכת זאת מרכיבים שונים שבאינטראקציה גורמים לתהליך דלקתי ע"י הפעלת ציטוקינים דלקתיים Caspase 1 interleukin 1b) Il1b) ומפל NF Kappa B [11]. החלבון פירין מונע את האינטראקציה בין שני מרכיבים ASC (Apoptosis-associated speck-like protein) ו-Caspase 1 וכך מדכא עיבוד של Il1b (Interleukin 1b) ומדכא פעילות של NF Kappa B [9][11][12]. מוטציה בגן MEFV מובילה ליצירת חלבון לא תקין שגורם להתחלת התהליך הדלקתי שאין חזרה ממנו, דרך הפעלה של Il1b (תמונה 1). המחקרים האחרונים עוסקים במסלולים הפתוגניים המוכיחים את תפקידו של החלבון פירין במערכת החיסון המולדת ובמנגנון התהליך הדלקתי.
עד היום דווח בספרות על 152 מוטציות ושינוים פולימורפיים בגן MEFV[9].
רוב המוטציות נמצאות באקסון 2 או 10, אך יש דיווחים בספרות גם על מוטציות באקסונים 3, 5 ו-9 [10][13]. לפחות 35 מוטציות מסוג סלף נתגלו כגורמות למחלה. השכיחות ביניהן כוללות: E148Q ,M694V, M680I, V726A, K695R, R761H,E148V[10][13].
מאפיינים קליניים
קדחת ים תיכונית (FMF) מאופיינת באירועים חוזרים של חום, דלקת צפק (Peritonitis) עקרה, דלקת צדר (Pleuritis) עקרה ודלקות מפרקים חוזרות. מערכות אחרות המעורבות במחלה כוללות עור, קרום הלב (Pericardium) והטוניקה ווגינליס (Tunica vaginalis).
אצל מרבית החולים (כ-90%) ההתקף הראשון מופיע לפני גיל 20 שנה[1]. ההתקפים מופיעים באופן פתאומי, נמשכים זמן קצר, מ-6 שעות עד 96 שעות, וחולפים באופן עצמוני. ההתקפים מתבטאים בחום גבוה, כאבים בלתי נסבלים, משביתים תפקוד יום-יומי וגורמים לסבל עד כדי ריתוק למיטה. בין ההתקפים החריפים והמשמעותיים אין תסמינים כלל.
- התקפי כאבי בטן הם השכיחים ביותר ומתרחשים בכ-95% מהחולים [1][14][4]. מבחינה קלינית, הממצאים מתאימים לאבחנה של דלקת צפק חריפה. עצירות במהלך ההתקפים היא טיפוסית, אולם שלשולים מופיעים ב-20%-120% מהחולים. צילום רנטגן עשוי להדגים רמות נוזל-גז חשודות לכרכת (Ileus). התסמינים הקליניים נמשכים 3-1 ימים וחולפים באופן ספונטני. תמונה קלינית דומה לבטן חריפה עלולה להוביל לפיום בטן (Laparotomy) וכריתת תוספתן. לאחר הניתוחים אין הטבה במצב וההתקפים חוזרים.
- דלקת מפרקים היא תופעה נפוצה ב-FMF, ומוצאים אותה בכ-75% מהחולים, במיוחד ביהודים יוצאי צפון אפריקה וספרד. ב-16% מהחולים דלקת מפרקים מופיעה כתסמין המייצג[15]. שכיחות של דלקת מפרקים בטורקים, בערבים ובארמנים נמוכה משמעותית מזו שדווח אצל יהודים [16][17][18]. התמונה הקלינית בדרך כלל מתבטאת בדלקת של מפרק גדול, בד"כ בודד (Mono-arthritis) בגפה תחתונה. ההתקפים מתאפיינים בחום גבוה מלווה באודם, נפיחות, כאב וחום מקומי של המפרק עם הגבלה בתנועה. דלקת מפרק בודד חריפה מופיעה בדרך כלל באופן פתאומי, אך יכולה לפרוץ בעקבות טראומה מינימלית. הסימנים נמשכים עד שבוע ימים וחולפים. ב-5% מהחולים דלקת המפרקים ממושכת, עד יותר מחודש ימים. בדרך כלל מדובר במעורבות של ברך, קרסול וירך ולעתים נדירות יש מעורבות של מפרק הלסת (Temporomandibular joint). ברוב המקרים דלקת המפרקים חולפת באופן פתאומי ללא סיבוכים. במקרים נדירים דלקת חריפה גורמת לפגיעה קשה ולנכות ואף להחלפת מפרק במיוחד כשמדובר במעורבות ירך[19]. דלקת מפרקים מופיעה בדרך כלל אצל חולים צעירים שסובלים גם מכאבי שרירים ומפריחות מסוג שושנה (Erysipelas), אדמנת (Erythema) ודלקת דפנות כלי דם (Vasculitis)[4]. חלק מהחולים הסובלים מדלקת עצה וכסל (Sacroiliitis) מאובחנים בהמשך כלוקים בספונדילוארתריטיס (Spondyloarthritis) עם HLA-B27 שלילי[20].
- התקפים חריפים של כאבי חזה וקשיי נשימה מלווים בחום גבוה בשל דלקת צדר חד-צדדי יכולים להופיע כסימן מבודד או עם כאבי בטן או כאבי מפרקים.
- דלקת קרום הלב (Pericarditis) מופיעה אצל 2.4% מהחולים. במקרים נדירים דלקת קרום לב חוזרת, כתופעה יחידה, יכולה לאפיין את מחלת FMF.
- אחד הממצאים האופייניים ב-FMF היא "שושנה" (Erysipelas–like erythema) הממוקמת בגפה תחתונה, במיוחד באזור הקרסול או כף הרגל. הנגע לעתים קרובות מלווה חום ולפעמים עם דלקת מפרקים. התסמינים נמשכים עד 48 שעות.
- כאבי שרירים המערבים את שרירי השוק והירך, הם סימנים שכיחים במחלה ובדרך כלל מופיעים ללא חום. כאב שרירים המלווה בחום או כאב שרירים ממושך עם חום (Protracted febrile myalgia) מתבטאת בדרך כלל בכאבי שרירים חזקים בשתי הגפיים התחתונות. Prednisone במינון גבוה למשך 6 שבועות יכול לשפר את המצב[21].
- טחול מוגדל מופיע אצל 30% מהחולים, בדרך כלל אינו קשור לעמילואידוזיס.
- דלקת אשכים (Acute orchitis) תוארה במקרים נדירים.
- סוגים מסוימים של דלקות דפנות כלי דם שכיחים יותר אצל חולי FMF כולל ארגמנת על שונליין-הנוך (HSP, Henoch–Schönlein Purpura) ודלקת רב-עורקית קשריתית (PAN ,Polyarteritis Nodosa) [22][23]. הסימנים הקליניים של מחלות אלה עשויים לחקות את אלה של FMF. HSP היא אחת התופעות השכיחות המופיעה אצל ילדים עם FMF. האבחנה מתבססת על תסמינים קליניים שכוללים ארגמנת עם התפלגות טיפוסית, דימום במערכת העיכול ודלקת פקעיות הכליה (Glomerulonephritis) עם דלקת דפנות כלי דם של רגישות יתר (Leukocytoclastic vasculitis) ועם משקעי נוגדני IgA (IgA immune deposits) בביופסיית עור. PAN מתאפיינת במחלה מתמשכת עם מעורבות של מערכת העצבים המרכזית והההיקפית, ומפרצות בכלי דם כלייתים, כבד ומערכת העיכול. אצל חולי FMF ה-PAN מתאפיין במהלך קשה למרות טיפול מדכא חיסון.
סיבוכים
הסיבוך הקשה וההרסני ביותר של FMF הוא עמילואידוזיס (Amyloidosis), הפוגע בדרך כלל בכליות ועלול לגרום לאי ספיקת כליות כרונית. העמילואיד הוא מסוג AA הטיפוסי לעמילואידוזיס משנית. שכיחות העמילואידוזיס שונה בקבוצות האתניות השונות ובסוג המוטציה בגן MEFV [24]. מצב הומוזיגוטי והטרוזיגוטי מורכב למוטציה M694V במיוחד אצל יהודים, ערבים וארמנים קשור למחלה קשה יותר ולנטייה לפתח עמילואידוזיס. בין כל הקבוצות מאגן הים התיכון, שכיחות העמילואידוזיס הגבוהה ביותר נמצאת אצל טורקים (12.9%) [4].
מחלת עמילואידוזיס מסוג AA אצל חולה עם היסטוריה משפחתית חיובית של FMF ללא סימנים קליניים של FMF, מאפיינת פנוטיפ FMF Type II. שכיחות הפנוטיפ השני יחסית נמוכה[25][26].
דלקת פקעיות הכליה מופיעה לעתים רחוקות אצל חולי FMF[15]. חלק מהחולים עם חלבון בשתן (Proteinuria) ודלקת פקעיות כליה יכולים להיות מאובחנים בטעות כעמילואידוזיס.
ההתאמה בין סוג המוטציות לקליניקה (Genotype-phenotype correlations)
זוהו מוטציות רבות בגן MEFV ופותחו מבחנים פשוטים וזולים לזיהוי המוטציות כדי לבסס את האבחנה הגנטית. מחקרים רבים מנסים למצוא קשר בין מוטציות מסוימות לתופעות קליניות (Genotype-phenotype correlations) וכן גורמי סיכון אחרים להתפתחות עמילואידוזיס משנית.
המוטציה השכיחה ביותר, M694V, אחראית ל-67%-20% מכל המקרים. בין החולים היהודים יוצאי צפון אפריקה מוטציה זאת אחראית על יותר מ-90% מהמקרים [27]. שינוי זה גורם להחלפת חומצה אמינית מתיונין (Methionine) לואלין (Valine) בקודון 694. המוטציה M694V קשורה למהלך מחלה קשה יותר עם סיכון גבוה לעמילואידוזיס, בעיקר במצב הומוזיגוטי[28]. עמילואידוזיס מופיעה בשכיחות נמוכה יותר אם מדובר במוטציות אחרות [28][29]. אצל חולים הומוזיגוטים למוטציה M694V גיל הופעת הסימנים הראשונים מוקדם יותר, תדירות ההתקפים גבוהה ומעורבות מפרקים שכיחה יותר לעומת קבוצות אחרות[4].
מוטציה V726A אחראית ל-35%-7% מהמקרים בכל האוכלוסיות.
ככלל, חומרת המחלה, הביטויים הקליניים, עמילואידוזיס ותסמינים אחרים מושפעים על ידי אופי המוטציות בגן MEFV. עם זאת, בהתבסס על הבדלים בין המשפחות ובתוך המשפחה, יש גורמים גנטיים נוספים (מחוץ לאתר הגן MEFV) ו/או גורמים סביבתיים המשפיעים על הביטוי הקליני. מחקרים מראים כי עמילואיד A בסרום, גנים הקשורים לנטייה לדלקת מפרקים ופקטורים נוספים יכולים לתפקד כגורמים שמשנים פנוטיפ (Modifiers) [30][31].
אבחון
האבחנה של FMF מתבססת על מאפיינים קליניים, היסטוריה משפחתית, היעדר מחלות תסמונות תורשתיות מחזוריות אחרות ותגובה לטיפול בColchicine. כמו כן, בדיקות מעבדה בזמן התקפים שמצביעות על תהליך דלקתי: רמת תאי דם לבנים מוגברת, שקיעת דם מוחשת, חלבון מגיב עם סי ( C-reactive protein) וממצאי דלקת חריפה אחרים [32]. ההחלמה העצמונית זמן קצר לאחר ההתקפים היא נקודה אבחנתית חשובה. בדיקת מוטציות בגן MEFV חשובה במקרים חשודים קלינית כדי להגדיר אבחנה. יש פרטים שהם הומוזיגוטים או הטרזיגוטים מורכבים (Compound heterozygotes) ללא סימנים של המחלה. מצד שני, יש חולים עם תמונה קלינית של המחלה המגיבים היטב לColchicine , עם מוטציה באלל אחד של הגן ויש גם חולים ללא אף אחת מהמוטציות הנבדקות.
בשנים האחרונות חלה התקדמות בשיטות המעבדה המהירות לגילוי מוטציות בגן MEFV[33][34].
אבחנה מבדלת
תסמונות תורשתיות אחרות המתאפיינות בהתקפי חום מחזוריים (Hereditary periodic fevers) למעט FMF כוללות:
- TRAPS (Tumor Necrosis Factor Receptor Associated Periodic Fever Syndrome)
- HIDS (Hyperimmunoglobulinemia D Syndrome)
- MWS (Muckle–Wells Syndrome)
- FCU (Familial Cold Urticaria)
- CINCA (Chronic Infantile Neurological Cutaneous and Articular Syndrome)
- PFAPA (Periodic Fever Adenopathy Pharyngitis Aphtosis) [35][36][37].
- TRAPS (Tumor Necrosis Factor Receptor Associated Periodic Fever Syndrome)
תסמונת שמועברת בתורשה אוטוזומלית דומיננטית, ונגרמת בעקבות מוטציות בגן TNFRS1A [38]. בעקבות המוטציה רמת הקולטן ל TNF (Tumor necrosis factor) יורדת, ועקב כך נגרמים מאורעות חוזרים של דלקות בשל פעילות יתר של TNF-α. המחלה מתבטאת באיררעים חוזרים של חום ממושך, כאבי שרירים, כאבי פרקים, דלקת צפק סטרילית, פריחות בעור, דלקות עיניים חוזרות וסימנים נוספים. חלק מהחולים מפתחים עמילואידוזיס. המחלה יכולה להופיע בכל האוכלוסיות כולל עדות יוצאי אגן הים התיכון - יהודים בעיקר ספרדים, ארמנים, ערבים[39]. המחלה מזכירה FMF, אולם ההתקפים הם ארוכים יותר ויכולים להימשך משבוע עד 3 שבועות. כאבי שרירים, בצקת סביב ארובת העין (Periorbital edema) ופריחות בגוף אופייניים ל-TRAPS. טיפול בסטרואידים בתחילת הסימנים יכול לעצור את ההתקף. טיפול ממושך בחוסמי TNF כמו Enbrel (Etanercept) מונע עמילואידוזיס ומשפר את מהלך המחלה.
- HIDS (Hyperimmunoglobulinemia D Syndrome)
תסמונת אוטוזומלית-רצסיבית המתאפיינת בהתקפים של כאבי בטן, חום, דלקת פרקים ופריחות בגוף. המחלה נגרמת בשל מוטציות בגן MVK ושכיחה יותר באוכלוסיות יוצאי מערב אירופה[40]. לרוב החולים רמת IgD גבוהה והפרשה מוגברת של MVA (Mevalonic acid) בשתן. היעדר של דלקת צפק, הגדלת בלוטות לימפה ופריחה בכל הגוף אופייניים לתסמונת HIDS ואינם אופייניים ל-FMF.
- קבוצת התסמונות MWS (Muckle–Wells Syndrome), Familial Cold Urticaria) FCU) ו-CINCA (Chronic Infantile Neurological Cutaneous and Articular Syndrome)
כולן נגרמות בשל מוטציות שונות בגן CIAS1 (Cold-induced autoinflammatory syndrome) [41]. כל המחלות מתאפיינות בהופעת חרלת (סרפדת, Urticaria) תקופתית. בתוך הקבוצה:
- מחלת CINCA היא חמורה ביותר, מופיעה בתקופה הנאונטלית ומתבטאת בחרלת ממושכת, מעורבות מפרקים קשה, חירשות, עיוורון ופיגור שכלי בהמשך. לרוב החולים סימנים דיסמורפיים ייחודיים.
- מחלת MWS מאופיינת גם כן בדלקת מפרקים וחום מלווים בחרלת. היא מופיע בדרך כלל בילדות. אצל חלק מהחולים יכולים להופיע עמילואדוזיס וחירשות כסיבוכים.
- תסמונת FCU מתאפיינת באירועים חוזרים של חרלת בחשיפה לקור.
- תסמונת PFAPA (Periodic Fever Adenopathy Pharyngitis Aphtosis)
מאופיינת בעליות חום חוזרות שנמשכות 2-1 ימים. הסימנים הייחודיים מתאפיינים בדלקת שקדים (Tonsillitis) ו/או דלקת לוע (Pharyngitis) סטריליים חוזרים, פצעים בפה, הגדלת בלוטות לימפה צוואריות ולעתים גם כאבי בטן [42]. טיפול בסטרואידים בתחילת התסמינים בדרך כלל מפסיק את ההתקף.
לעתים קשה להבדיל בין התקפים של PFAPA לבין התקפים של FMF במיוחד באוכלוסיות מתאימות. במקרים אלה גילוי מוטציות בגן MEFV ו/אן מעקב עם ניסיון טיפולי בסטרואידים יכולים לסייע לאבחנה.
טיפול
בשנות ה-70 התגלה ש Colchicine במתן יום-יומי הוא טיפול יעיל במחלת FMF[43].
הטיפול מוביל להפסקת ההתקפים או להפחתה ניכרת בתדירותם וגם לירידה בחומרת המחלה[15]. Colchicine מניעתי במינון 2-1 מ"ג ליום מספק הפוגה מלאה או שיפור אצל כ-85% מהחולים, ועוצר או מבטל את הופעת העמילואידוזיס [44]. חלק מהחולים מגיבים היטב למינון יומי, ואצל חלק מהחולים יש צורך בהעלאת המינון עד ארבע מנות ליום.
כ-10%-5% מהחולים אינם מגיבים לטיפול בColchicine. חוסר התגובה יכול להיות קשור לירידה בריכוז התרופה בתאים מונונוקליאריים עקב הפגם הגנטי אצל חולי FMF[45].
אצל חולים שלא מגיבים לטיפול פומי, תוספת טיפול דרך הווריד פעם בשבוע יכולה להפחית את התדירות ואת חומרת ההתקפים למעט בעיות במפרקים [15]. חשוב להמשיך טיפול בColchicine בכל מקרה כדי למנוע סיבוכים כלייתיים.
Colchicine דרך הפה לטווח ארוך הוא טיפול בטוח יחסית. תופעות הלוואי השכיחות הן שלשולים וכאבי בטן במיוחד במינון גבוה. תופעות לוואי אחרות הן נדירות והפיכות בהורדת המינון. התופעות הנדירות כוללות ירידה בספירת תאי דם לבנים, ירידה בספירת טסיות, פגיעה בעצבים היקפיים, פריחות, נשירת שיער והפרעה בתפקודי כבד.
תרופות אחרות נחקרו אצל חולים עמידים לטיפול בColchicine . בספרות יש דיווחים על יעילות הטיפול בThalidomide [46] ותרופות מקבוצת האנטיציטוקינים: נוגד רקומביננטי לרצפטור לIL1 (Recombinant interleukin 1 receptor antagonist)- Kineret (Anakinra) [47][48] וחוסם פעילות TNF (Tumor necrosis factor blockade)-Enbrel (Etanercept) [49].
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
- ↑ 1.0 1.1 1.2 1.3 Sohar E, Gafni J, Pras M, et al. Familial Mediterranean fever. A survey of 470 cases and review of the literature. Am J Med 1967;43:227–253
- ↑ Ancient missense mutations in a new member of the RoRet gene family are likely to cause familia Mediterranean fever.; The international FMF consortium. Cell 1997;90:797–807
- ↑ A candidate gene for familial Mediterranean fever. 1997 The French FMF consortium. Nat Genet 17:25–31
- ↑ 4.0 4.1 4.2 4.3 4.4 Tunca M, Akar S, Onen F, et al. Familial Mediterranean fever (FMF) in Turkey: results of a nationwide multicenter study. Medicine (Baltimore) 2005;84:1–11
- ↑ 5.0 5.1 Daniels M, Shohat T, Brenner-Ullman A, et al. Familial Mediterranean fever: high gene frequency among the non-Ashkenazic and Ashkenazic Jewish populations in Israel. Am J Med Genet 1995;55:311–314
- ↑ Onen F, Sumer H, Turkay S, et al. Increased frequency of familial Mediterranean fever in Central Anatolia, Turkey. Clin Exp Rheumatol 2004;22:31–33
- ↑ Rogers DB, Shohat M, Petersen GM, et al. Familial Mediterranean fever in Armenians: autosomal recessive inheritance with high gene frequency. Am J Med Genet 1989;34:168–172
- ↑ Kawabata H, Murakami M, Nishikomori R, et al. Japanese case of familial Mediterranean fever with a MEFV gene mutation. Hokkaido Igaku Zasshi. 2009;84:419-422
- ↑ 9.0 9.1 9.2 Guz G, Kanbay M, Ozturk MA. Current perspectives on familial Mediterranean fever. Curr Opin Infect Dis 2009;22:309-315
- ↑ 10.0 10.1 10.2 Bhat A, Naguwa SM, Gershwin ME. Genetics and new treatment modalities for familial Mediterranean fever. Ann N Y Acad Sci. 2007;1110:201-208
- ↑ 11.0 11.1 Martinon F, Burns K, Tschopp J. The inflammasome: A molecular platform triggering activation of inflammatory caspases and processing of proIL-beta. Mol Cell 10:417–426
- ↑ Srinivasula SM, Poyet JL, Razmara M, et al. The PYRIN-CARD protein ASC is an activating adaptor for caspase-1. J Biol Chem 2002;277:21119–21122
- ↑ 13.0 13.1 Touitou I, Lesage S, McDermott M, et al. Infevers: An evolving mutation database for auto-inflammatory syndromes. Hum Mutat 2004;24:194–198
- ↑ Livneh A, Langevitz P, Zemer D, et al. The changing face of familial Mediterranean fever. Semin Arthritis Rheum 1996;26:612–627
- ↑ 15.0 15.1 15.2 15.3 Onen F. Familial Mediterranean Fever. Rheumatol Int 2006;26:489–496
- ↑ Rogers DB, Shohat M, Petersen GM, et al. Familial Mediterranean fever in Armenians: autosomal recessive inheritance with high gene frequency. Am J Med Genet 1989;34:168–172
- ↑ Ozen S, Karaaslan Y, Ozdemir O, et al. 1998; Prevalence of juvenile chronic arthritis and familial Mediterranean fever in Turkey: a field study. J Rheumatol 25:2445–2449
- ↑ Majeed HA, Rawashdeh M. The clinical patterns of arthritis in children with familial Mediterranean fever. QJM 1997;90:37–43
- ↑ Sneh E, Pras M, Michaeli D, et al. Protracted arthritis in familial Mediterranean fever. Rheumatol Rehabil X 1997;16:102–106
- ↑ Besbas N, Ozdemir S, Saatci I, et al. Sacroiliitis in familial Mediterranean fever: an unusual presentation in childhood. Turk J Pediatr 1999;41:387–390
- ↑ Langevitz P, Zemer D, Livneh A, et al. Protracted febrile myalgia in patients with familial Mediterranean fever. J Rheumatol 1994;21:1708–1709
- ↑ Gershoni-Baruch R, Broza Y, Brik R. Prevalence and significance of mutations in the familial Mediterranean fever gene in Henoch-Schonlein purpura. J Pediatr 2003;143:658–661
- ↑ Ozen S, Ben-Chetrit E, Bakkaloglu A, et al. Polyarteritis nodosa in patients with familial Mediterranean fever (FMF): A concomitant disease or a feature of FMF? Semin Arthritis Rheum 2001;30:281–287
- ↑ Mimouni A, Magal N, Stoffman N, et al. Familial Mediterranean fever: effects of genotype and ethnicity on inflammatory attacks and amyloidosis. Pediatrics 2000;105(5):70
- ↑ Kutlay S, Yilmaz E, Koytak ES, et al. A case of familial Mediterranean fever with amyloidosis as the first manifestation. Am J Kidney Dis 2001;38:34
- ↑ Melikoglu M, Ozdogan H, Korkmaz C, et al. A survey of phenotype II in familial Mediterranean fever. Ann Rheum Dis 2000;59:910–913
- ↑ Shinar Y, Livneh A, Langevitz P, et al. Genotype-phenotype assessment of common genotypes among patients with familial Mediterranean fever. J Rheumatol 2000;27:1703–1707
- ↑ 28.0 28.1 Ben-Chetrit E, Backenroth R. Amyloidosis induced, end stage renal disease in patients with familial Mediterranean fever is highly associated with point mutations in the MEFV gene. Ann Rheum Dis 2001;60:146–149
- ↑ Ben-Chetrit E. Familial Mediterranean fever (FMF) and renal AA amyloidosis--phenotype-genotype correlation, treatment and prognosis. J Nephrol 2003;16:431–434
- ↑ Akar N, Hasipek M, Akar E, et al. Serum amyloid A1 and tumor necrosis factor-alpha alleles in Turkish familial Mediterranean fever patients with and without amyloidosis. Amyloid 2003;10:12–16
- ↑ Yilmaz E, Balci B, Kutlay S, et al. Analysis of the modifying effects of SAA1, SAA2 and TNF-alpha gene polymorphisms on development of amyloidosis in FMF patients. Turk J Pediatr 2003;45:198–202
- ↑ Gang N, Drenth JP, Langevitz P, et al. Activation of the cytokine network in familial Mediterranean fever. J Rheumatol 1999;26:890–897
- ↑ Moutereau S, Narwa R, Matheron C, et al. An improved electronic microarray-based diagnostic assay for identification of MEFV mutations. Hum Mutat 2004;23:621–628
- ↑ Delague V, Kriegshauser G, Oberkanins C, et al. Reverse hybridization vs. DNA sequencing in the molecular diagnosis of Familial Mediterranean fever. Genet Test 2004;8:65–68
- ↑ Drenth JP, van der Meer JW. Hereditary periodic fever. NEJM 2001;345:1748–1757
- ↑ Fietta P. Autoinflammatory diseases: the hereditary periodic fever syndromes. Acta Biomed 2004;75:92-99
- ↑ Padeh S. Periodic fever syndromes. Pediatr Clin North Am 2005;52:577–609
- ↑ Aksentijevich I, Galon J, Soares M, et al. The tumor-necrosis-factor receptor-associated periodic syndrome: new mutations in TNFRSF1A, ancestral origins, genotype–phenotype studies, and evidence for further genetic heterogeneity of periodic fevers. Am J Hum Genet 2001;69:301–314
- ↑ Dodé C, André M, Bienvenu T, et al. The enlarging clinical, genetic, and population spectrum of tumor necrosis factor receptor-associated periodic syndrome. Arthritis Rheum 2002;46: 2181-2188
- ↑ Drenth JP, Cuisset L, Grateau G, et al. Mutations in the gene encoding mevalonate kinase cause hyper-IgD and periodic fever syndrome. International Hyper-IgD Study Group. Nat Genet 1999;22:178–181
- ↑ Goldfinger S. The inherited autoinflammatory syndrome: a decade of discovery. Trans Am Clin Climatol Assoc 2009;120:413-418
- ↑ Feder HM, Salazar JC. A clinical review of 105 patients with PFAPA (a periodic fever syndrome). Acta Paediatr 2010;99:178-184
- ↑ Goldfinger SE. Colchicine for familial Mediterranean fever. NEJM 1972;287:1302
- ↑ Livneh A, Zemer D, Langevitz P, et al. Colchicine treatment of AA amyloidosis of familial Mediterranean fever. An analysis of factors affecting outcome. Arthritis Rheum 1994;37:1804–1811
- ↑ Lidar M, Scherrmann JM, Shinar Y, et al. Colchicine nonresponsiveness in familial Mediterranean fever: clinical, genetic, pharmacokinetic, and socioeconomic characterization. Semin Arthritis Rheum 2004;33:273–282
- ↑ Seyahi E, Ozdogan H, Masatlioglu S, et al. Successful treatment of familial Mediterranean fever attacks with Thalidomide in a Colchicine resistant patient. Clin Exp Rheumatol 2002;20:43–44
- ↑ Roldan R, Ruiz AM, Miranda MD, et al. Anakinra: new therapeutic approach in children with Familial Mediterranean Fever resistant to colchicine. Joint Bone Spine 2008;504-505
- ↑ Ozen S, Bilginer Y, Ayaz NA, et al. Anti-Interleukin 1 Treatment for Patients with Familial Mediterranean Fever Resistant to Colchicine 2010. J Rheumatol 15. (Epub ahead of print)
- ↑ Mor A, Pillinger MH, Kishimoto M, et al. Familial Mediterranean fever successfully treated with etanercept. J Clin Rheumatol 2007;13:38-40
קישורים חיצוניים
- קדחת ים תיכונית (Familial Mediterranean Fever): מאבחון לטיפול, מדיקל מדיה
- למידע המיועד לציבור הרחב: אנציקלופדיה גנטית לייעוץ גנטי, מחלות גנטיות ובדיקות גנטיות בשפה העברית ובצורה המתאימה גם למידע עבור המשפחות: [1]
- מידע נוסף ומפורט לפי מוטציות, פרופ' מוטי שוחט
המידע שבדף זה נכתב על ידי ד"ר מרינה מיכלסון, המכון לגנטיקה קלינית, מרפאה מטבולית-גנטית-נוירולוגית, המרכז הרפואי ע"ש אדית וולפסון, חולון; ד"ר דורית לב, מנהלת המכון לגנטיקה רפואית ומנהלת שותפה, מרפאה מטבולית-גנטית-נירולוגית, המרכז הרפואי ע"ש אדית וולפסון, חולון


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק