חומצה דלתא-אמינולבולינית - Delta aminolevulinic acid
| מדריך בדיקות מעבדה | |
| חומצה דלתא-אמינולבולינית | |
|---|---|
| Delta aminolevulinic acid | |
| שמות אחרים | 5-minolevulinic acid, delta-ALA |

| |
משקל מולקולארי 131.13 גרם/מול
| |
| מעבדה | כימיה בשתן |
| תחום | בירור פורפיריות |
| טווח ערכים תקין | בגיל פחות משנה-פחות מ- nmol/ml10 ; בגיל 1–17 שנה-פחות מ-20 nmole/ml ; בגיל של 18 שנה ומעלה-פחות מ-15 nmol/ml. בערכים לא-מולריים הרמה הנורמלית של delta-ALA בשתן של מבוגרים היא 1–7 מיליגרם/24 שעות או 7.6-53.3 ננומול/מ"ל. על פי מעבדת Quest ערכי delta-ALA תקינים בשתן הם כדלקמן: בילדים מגיל 1–8 שנים: 2.3-6.2 מיליגרם/גר' קראטינין; במתבגרים מגיל 9–17 שנים: 1.5-5.3 מיליגרם/גר' קראטינין; בגברים מעל גיל 18 שנה: מתחת ל-1.8 מיליגרם/גר' קראטינין; בנשים מעל גיל 18 שנה: מתחת ל-5.4 מיליגרם/גר' קראטינין. |
| יוצר הערך | פרופ' בן-עמי סלע |
מטרת הבדיקה
סיוע באבחון המבדיל בין הסוגים השונים של פורפיריות חריפות של הכבד.
הביולוגיה של delta-ALA
חומצה delta-ALA היא חומצת אמינו אנדוגנית לא-חלבונית המסונתזת בכבד, המהווה את התרכובת הראשונה במסלול הסינתזה של פורפירין, המובילה ליצירת heme (עלפי Gardener ו-Cox ב-J Biol Chem משנת 1988). חומצה זו מופיעה ביונקים כמו גם בצמחים והיא חלק מתהליך יצירת כלורופיל (Wettstein ב-Plant Cell משנת 1995). חומצת delta-ALA משמשת גם בבדיקות לגילוי פוטו-דינמי של סרטן שלפוחית השתן (Wagnières וחב' ב-Handbook of Photomedicine משנת 2014) תוך ניצול התכונות הפלואורסצנטיות של החומר, כמו גם בניתוחים פוטו-דינמיים של גידולים סרטניים כגון glioma (על פי Eyüpoglu וחב' ב-Nat Rev Neurol משנת 2013 ו-Tetard וחב' ב-Photodiagnosis and photodynamic therapy משנת 2014) וכן של שלפוחית השתן ( Inoue ב-Int J Urol משנת 2017). כן משמש delta-ALA לטיפול פוטודינאמי בחטטת (acne) על פי Yew וחב' ב-J Drugs Dermatol משנת 2016). טיפול פוטודינאמי זה נלמד גם במספר גידולים גינקולוגיים (Shishkova וחב' ב- Cancer Biol Med משנת 2012). ה-FDA אישר בשנת 2017 את השימוש ב- aminolevulinic acid hydrochloride או ALA-HCL) בניתוחים של גליומות.
ביוסינתזה של delta-ALA
בבעלי חיים או ב-eukaryotes שאינם פוטו-סינתטיים, בפטריות ובחד-תאיים, ביוסינתזה של delta-ALA, מתבצעת על ידי האנזים ALA synthase מחומרי המוצא גליצין ו-succinyl CoA. ראקציה זו הידועה כמסלול Shemin, מתרחשת במיטוכונדריה ( Ajioka וחב' ב-Mol Cell Biol משנת 2007). בצמחים ובחיידקים, delta-ALA מיוצר מחומצה גלוטמית דרך glutamyl-tRNA ו- glutamate-1-semialdehyde. האנזימים המשתתפים במסלול זה הם: glutamyl-tRNA synthetase, glutamyl-tRNA reductase ו- glutamate-1-semialdehyde 2,1-aminomutase. מסלול זה ידוע כמסלול C5 או Beale (על פי Beale ב-Plant Physiol משנת 1990).
מידע קליני
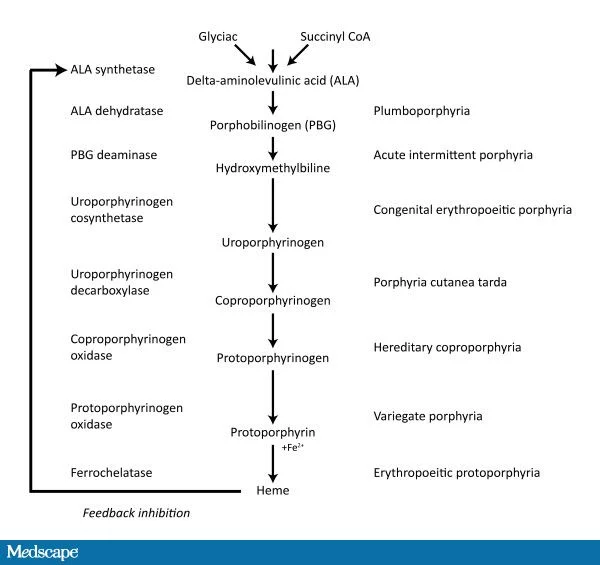
הפורפיריות הן קבוצה של מפגעים המועברים בהורשה, ונובעות מפגמים אנזימטיים במסלול הביוסינתזה של heme. בתלות באנזים הספציפי הפגום, פורפירינים שונים והקודמנים שלהם מצטברים ברקמות שונות. המתווים של הצטברות פורפירינים באריתרוציטים ובפלזמה וההפרשה של קודמנים של heme בשתן ובצואה, מאפשרים את הגילוי וההבדלה בין סוגי הפורפיריה השונים. הפורפיריות מוגדרות באופן אופייני כאריתרופויאטיות או הפאטיות תוך התבססות על האזור הראשוני של הפגם האנזימטי. בנוסף, פורפיריות הפאטיות יכולות להיות ממוינות בנוסף ככרוניות או חריפות, בהתאם לתמונה הקלינית.
סוגי הפורפיריות הכבדיות החריפות הם:
- ADP או aminolevulinic acid dehydratase deficiency porphyria
- AIP או acute intermittent porphyria
- HCP או hereditary coproporphyria
- VP או variegate porphyria
פורפיריות אלו כרוכות בתסמינים נוירו-ויסצראליים שמתחילים באופן אופייני בגיל ההתבגרות או מאוחר יותר. תסמינים שכיחים כוללים כאבי בטן חמורים, נוירופתיה היקפית ותסמינים פסיכיאטריים. רגישות לאור אינה מופיעה ב-AIP, אך יכולה להופיע ב-HCP וב-VP. מגוון רחב של תרופות (כגון ברביטורטים ותרופות סולפה), וכן אלכוהול, זיהומים, מתכות כבדות, ושינויים הורמונאליים עלולים להחמיר מצבי משבר.
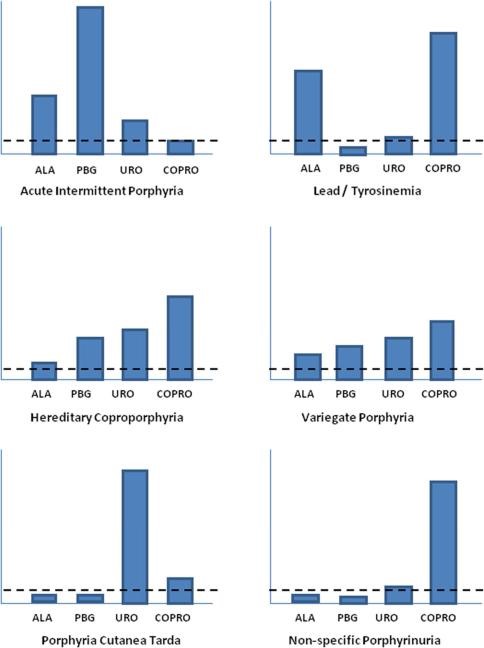
הפרשה של delta-ALA יכולה להיות מוגברת או באחת מסוגי הפורפיריות החריפות העוברות בהורשה, או כתוצאה מעיכוב שניוני של ALA dehydratase. בין הסיבות השניוניות הרעלת עופרת חריפה וכן הרעלת ארסן או מנגן, גורמות לעליות הגבוהות ביותר של אצידוריה אמינו-לבולינית. עליות פחות משמעותיות של delta-ALA מוצאים בהרעלת עופרת כרונית, בטירוזינמיה type 1, באלכוהוליזם ובהיריון. הבדיקה המועדפת להרעלת עופרת בילדים היא בקביעת רמת העופרת בדם. רמות נמוכות של delta-ALA בשתן יכולות להופיע במצבי מחלת כבד כרונית.
פורפיריה חריפה, טירוזינמיה והרעלת עופרת, הם בעלי תסמינים דומים הנשלטים על ידי כאבי בטן, בחילה ונוירופתיה. בכל שלושת המפגעים הללו נמצא עליה ברמת חומצה delta-aminolevulinic בשתן ובדם. הכאבים מתפוגגים בעקבות טיפול המונע יצירת-יתר של delta-ALA במסלול יצירת heme, מה שמאשר את התפקיד הפתוגני של delta-ALA.לכן תרפיה עתידית במקרים של פורפיריה חריפה אמורה להתמקד ביצירת-יתר של חומצה delta-aminolevulinic (על פי Anderson וחב' ב-Ann Intern Med משנת 2005).
התפקיד של delta-ALA בתסמינים של פורפיריה חריפה
התקפים של כאב נוירופתי, בעיקר בבטן, בחילה וטכיקרדיה אופייניים לפורפיריה חריפה והם מלווים על ידי יצירת-יתר של קודמני heme, ובאופן ספציפי על ידי הצטברות של delta-ALA ו-porphobilinogen (von und zu Fraunberg וחב' ב-Medicine משנת 2005). בכל אחת מהפורפיריות החריפות, יש בשתן הצטברות של delta-ALA, ובכולן טיפול ב-hemin מפחית את ריכוזי delta-ALA ומקל על התסמינים. בניגוד לכך, שימוש באנזים הרקומביננטי porphobiinogen deaminase למזער את רמת porphobilinogen בפורפיריה חריפה לא היה יעיל. פעילות hemin היא בעיכוב של של הפעילות בכבד של delta-ALA synthase-1, האנזים המקטלז את יצירת delta-ALA עיכוב יצירת heme בא לביטוי חשוב בהפאטוציטים, שם רמה תוך-תאית נמוכה באופן קריטי של heme, מעודדת יצירת-יתר של קודמניו, delta-ALA ו-porphobilinogen.
Hemin הוא protoporphyrin IX המכיל יון ברזל תלת-ערכי ( Fe+3 ) עם כלוריד כליגנד קואורדינציה. הטיפול ניתן בעירוי לווריד כאשר לתכשיר שמות מותג כ-Panhematin ו-Normosang (Bissell ב-J Hepatol משנת 1988). הטיפול ב-hemin עשוי להיות מציל-חיים, אם כי הוא אינו אידיאלי. השפעת התכשיר קצרת-מועד, ומטופלים עם התקפים תכופים עלולים להידרש לעירוי התרופה אחת ל-1–4 שבועות. העירוי צורב מעט, ועלול לגרום לדלקת מכאיבה בוורידים היקפיים קטנים. לפיכך, העירוי ניתן דרך צנתר מרכזי (central line) שעלול להיות מורכב כשלעצמו. בסוף התהליך, כאשר hemin נשבר והופך לצבען מרה, משתחרר ברזל שעלול להצטבר עם הזמן לרמות המצריכות תרפיה לכלציה של הברזל.
טירוזינמיה תורשתית והרעלת עופרת משפיעים אף הם על מסלול סינתזת heme. בטירוזינמיה, הפגם הגנטי במטבוליזם של טירוזין, מביא בהפאטוציטים להצטברות של succinylacetone, המעכב בחוזקה את האנזים ALA-dehydratase (Kappas ו-Sassa ב-J Clin Invest משנת 1983). בהרעלת עופרת, המתכת מעכבת ישירות את אותו האנזים על ידי התקשרות לשיירי sulfhydryl. בכל אחד משני המקרים, יש רק הצטברות מוגברת של delta-ALA אך porphobilinogen נותר ברמה תקינה, שכן האנזים המעוכב הוא המסב delta-ALA ל- porphobilinogen. במקרה של טירוזינמיה המשבר הנוירולוגי מטופל ביעילות בעירוי של hemin (על פי Rank וחב' ב-Pediatr משנת 1991).
שפעול המיטוכונדריה
ה-delta-ALA המסונתז עובר סדרה של התמרות בציטוזול שבסופם הוא מוסב ל-Protoporphyrin IX בתוך המיטוכונדריה (Malik ו-Djaldetti ב-Cell Differentiation משנת 1979 ו-Olivo וחב' ב-Pharmaceutics משנת 2011). מולקולת protpporphyrin זו, עוברת כלציה עם ברזל בנוכחות האנזים ferrochelatase ליצירת heme. מולקולת heme מגבירה את הפעילות המיטוכונדריאלית בכך שהיא מסייעת בשפעול מעגל הנשימה של Krebs ובשפעול שרשרת טרנספורט האלקטרונים המובילים ליצירת adenosine (על פי triphosphate Ogura וחב' ב- BMC Research Notes משנת 2011). על כן, delta-ALA מגביר את ה-BMR (או basal metabolic rate), מגביר את צריכת גלוקוזה להגדלת הרמות האנרגטיות של הגוף (Trifunovic ב-Biochim Biophys Acta-Bioenergetics משנת 2010).
הצטברות של Protoporphyrin IX
תאים סרטניים חסרים או שיש להם פעילות מופחתת של האנזים ferrochelatase מה שגורם להצטברות של Protoporphyrin IX, שהוא מצע המייצר פלואורסצנציה, שמאפשר גילוי תאים אלה בגישה אופטית.
פעילות האנזים Heme Oxygenase-1
עודף heme מוסב במקרופאגים ל-biliverdin וליוני ברזל דו-ערכי (ferrous) על ידי האנזים heme oxygenase-1. ה-biliverdin הנוצר מוסב בהמשך ל-bilirubin ול-CO (על פי Loboda וחב' ב-Cell Mol Life Sci משנת 2016). בילירובין ו-biliverdin הם נוגדי-חמצון עוצמתיים, ומווסתים תהליכים ביולוגיים חשובים כמו דלקת, אפופטוזיס, שגשוג תאים, פיברוזיס ואנגיוגנזה. השפעה פתוגנית ישירה שלporphobilinogen נבחנה בשנת 2005 כאשר תכשיר porphobilinogen deaminase ניתן לסובלים מהתקפים תכופים ורמות גבוהות במיוחד של delta-ALA ו-porphobilinogen. נמצאה ירידה מהירה וסלקטיבית של רמת porphobilinogen בפלזמה, אם כי התסמינים לא השתנו (Sardt וחב' ב-Clin Pharmcokinet משנת 2007). ממצאי התוצאות של טיפול ב-Porphozyme®, מצביעות בבירור על כך ש-delta-ALA היא הסיבה העיקרית לתסמינים.
המקורות של הרעלת עופרת
הרעלת עופרת במבוגרים בארצות הברית הייתה מקובלת היסטורית מחשיפה תעסוקתית למתכת כבדה זו, אם כי בשנים האחרונות היא נכרכת בתכשירים רפואיים הודיים (Ayurvedic), בעיקר בנשים הרות (דו"ח של המועצה לבחינת הרעלת עופרת ב-. Morbid Mortal Weekly Repמשנת 2012). דו"ח משנת 2008 קבע ש-20% מתכשירים מרפא הודיים אלה מכילים באופן פוטנציאלי כמויות טוקסיות של עופרת בשילוב עם כספית וארסניט (Saper וחב' ב-JAMA משנת 2008). המתכת היחידה שהתגלתה בדמו של הנבדק הייתה עופרת. נתונים אלה תואמים במקרים אחד של כאבי בטן היסטוריה של הרעלת עופרת תעסוקתית או שימוש ממושך בתכשירי רפואה מסורתיים הודיים.
אבחון מבדיל של מפגעים של סינתזת heme
הפרופיל של קודמני heme בדם, בשתן ובצואה אופייני לכל סוג של פורפיריה ומשמש מפתח לאבחון. כאשר תסמיני המחלה מצביעים על פורפיריה חריפה אך הבדיקות בשתן מצביעות רק עלdelta-ALA ו-coproporphyrin מוגברים, כאשר רמת coprobilinogen תקינה, יש לבצע בדיקת רמת עופרת בדם. נקודה קלינית חשובה נוספת שרמה מוגברת של coprobilinogen בשתן, כאשר רמות delta-ALA ו- porphobilinogen תקינות, היא ממצא של פורפירינוריה בלתי-ספציפי.
שיטת הבדיקה
Stable Isotop Liquid Chromatography-Tandem Mass Spectrometry (LC-MS/MS) Dilution Analysis. לשתן מוסיפים internal standard של delta-ALA מסומן ב-13C5 וב-15N, ועובר סינון על ידי מסנן ניילון. היחס ביו שטחי ה-peaks, של delta-ALA ושל ה-internal standard של dALA, מאפשר את חישוב הריכוז של dALA בדגימת השתן (Lacey וחב' ב-J Am Soc Mass Spectrum משנת 2012).
הוראות לביצוע הבדיקה
דגימת שתן (2 מ"ל) נלקחת מתוך מיכל פלסטיק בו נעשה איסוף שתן של 24 שעות, כאשר הנבדק אמור להימנע מצריכת אלכוהול במהלך 24 שעות לפני הבדיקה ועד לאחר נטילת הדם. למיכל איסוף השתן יש להוסיף מראש 1 מ"ל של חומצה אצטית גלציאלית מרוכזת, או 1 מ"ל של HCl בריכוז 6N. את השתן יש לשמור בקירור (הצורה המועדפת) ובתנאים אלה הדגימה יציבה למשך 14 יום, או לאחסן בהקפאה (הדגימה יציבה למשך 30 יום). את השתן יש להעביר למעבדה בקירור. יש לעטוף את מבחנת השתן בנייר כסף למנוע חשיפה לאור או לחום. לא תתקבל דגימת שתן בטמפרטורת החדר או דגימה שאינה מוגנת מאור.
לפני איסוף השתן לבדיקה יש להימנע לנטילת מספר תרופות שעלולות להעלות רמת delta-ALA בשתן. בין תרופות אלה: פניצילין, ברביטורטים, גלולות למניעת היריון או griseofulvin.
ראו גם
- חזרה לדף מדריך בדיקות מעבדה
- בדיקות מעבדה - אבחון מחלות ומפגעים מטבוליים-גנטיים
- בדיקות מעבדה - אבחון תסמנות גנטיות
- בדיקות מעבדה - בדיקות מתכות
המידע שבדף זה נכתב על ידי פרופ' בן-עמי סלע, המכון לכימיה פתולוגית, מרכז רפואי שיבא, תל-שומר;
החוג לגנטיקה מולקולארית וביוכימיה, פקולטה לרפואה, אוניברסיטת תל-אביב (יוצר הערך)


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק