סוכרת בגיל הינקות - Neonatal Diabetes
| סוכרת בגיל הינקות | ||
|---|---|---|
| Neonatal Diabetes | ||

| ||
| יוצר הערך | ד"ר רויטל נמרי
|
|
לערכים נוספים הקשורים לנושא זה, ראו את דף הפירושים – סוכרת
סוכרת בגיל הינקות (Neonatal diabetes) מוגדרת כסוכרת המופיעה בחצי השנה הראשונה לחיים ודורשת טיפול באינסולין, למשך שבועיים לפחות. לסוכרת גיל הינקות יש שני סוגים, על פי המופע הקליני: סוכרת גיל ינקות חולפת (Transient neonatal diabetes) וסוכרת גיל ינקות קבועה (Permanent neonatal diabetes). האטיולוגיה של סוכרת בגיל הינקות היא מגוונת מבחינה גנטית. המקרים הידועים נגרמים עקב פגם בגנים בעלי תפקיד בהתפתחות הלבלב ואיי הלבלב, מוות תאי מתוכנן (Apoptosis) של תאי בטא של הלבלב, ייצור אינסולין או בקרה של שחרור אינסולין. גילוי המוטציות (Mutations) הגורמות לסוכרת גיל הינקות, הוא אחד המהפכים של העשור האחרון בתחום הסוכרת ואיפשר, בחלק מהמקרים, מעבר מטיפול ארוך שנים באינסולין לטיפול פומי.
אפידמולוגיה
סוכרת בגיל הינקות היא נדירה, בעלת שכיחות של 1:400,000 יילודים. סוכרת גיל ינקות חולפת, שיעורה 50–60 אחוזים מסך המקרים. שיעור ההופעה של סוכרת גיל ינקות קבועה הוא 40–50 אחוזים מסך המקרים.
אטיולוגיה
בעבר כמעט ולא הייתה אבחנה מבדלת לסוכרת בגיל הילדות וההתבגרות ורוב רובם של המקרים אובחנו כסוכרת מסוג 1 אוטואימונית (Autoimmune) וטופלו באינסולין. בעשור האחרון חלה התקדמות רבה בהבנה של התהליכים הפיזיולוגיים המובילים להתפתחות סוכרת ואותרו גנים המעורבים ביצירת הלבלב, חילוף החומרים של גלוקוז והפרשת אינסולין.
כל אלו, נוסף על עבודת מחקר ענפה בחקר התורשה של סוכרת, שאינה אוטואימונית, הרחיבו את האבחנה המבדלת של מחלת הסוכרת והובילו להבנה, שסוכרת היא סל של מחלות על רקע אטיולוגיות שונות, שחלקן נגרם מפגם בגן יחיד (סוכרת חד-גנית) בניגוד לסוכרת מסוג 1 שהיא רב-גנית, כלומר: מספר רב של גנים תורמים להתפתחות הסוכרת. סוכרת גיל ינקות, היא אחת הדוגמאות לסוכרת חד גנית.
תהליך הפרשת אינסולין בלבלב
ערך מורחב – אינסולין - Insulin
- תהליך הפרשת האינסולין מהלבלב
בעליית רמות הגלוקוז בדם, כמו לאחר ארוחה, גלוקוז נכנס לתא הלבלב במפל ריכוזים דרך תעלה הנקראת GLUT2 (Glucose Transporter 2). הגלוקוז עובר זירחון על ידי האנזים גלוקוקינז (Glucokinase) המהווה, על כן, את חיישן רמות הסוכר בדם. בשלב זה מתרחשים מספר תהליכי חילוף חומרים בתא, חלקם במיטוכונדריה (Mitochondria), הגורמים לעלייה ברמות ה-ATP (Adenosine Triphosphate) בתא וירידה של ADP (Adenosine Diphosphate), שינוי זה גורם לסגירת תעלות אשלגן, נטילת קיטוב (Depolarization) של קרום התא, כניסת סידן לתא והפרשת אינסולין. פגם בכל אחד משלבים אלו יפגום ביכולת הפרשת האינסולין ועלול לגרום, על כן, לסוכרת.
תעלת האשלגן בנויה משתי יחידות: המעטפת הפנימית הנקראת Kir6.2 והמעטפת החיצונית SUR, שאחראית לבקרה לסגירת התעלה. כל אחת מתת-היחידות מקודדת על ידי גן אחר.
ב-2004 היו גילון וחבריו הראשונים שתיארו מוטציות (Mutations) שונות אללים בגן ל-KCNJ11 המקודד לתת-יחידה Kir6.2 של תעלת האשלגן KATP (ATP-Sensitive Potassium)[1]. מוטציות בגן זה מהוות שליש ממקרי הסוכרת בגיל הינקות, הן הקבועה והן החולפת. הסוכרת נגרמת עקב הפרשה לקויה של אינסולין הנובע מכישלון של תעלת KATP מוטנטית בתא הבטא להיסגר כתגובה לעלייה ב-ATP תוך-תאי.
זמן קצר לאחר מכן, ב-2006, מתארים בבנקו וחבריו מוטציות שונות אללים משפעלות של הגן ל-ABCC8 המקודד לתת-יחידה SUR1 של תעלת האשלגן KATP[2].
מוטציית שפעול בכל אחד ממרכיבי התעלה גורמת לירידה ברגישות ל-ATP, משנה את הקינטיקה (Kinetics) של התעלה וגורמת לתעלה להיוותר במצב פתוח גם בנוכחות רמה גבוהה של ATP בתא (שמתרחש עקב רמות גבוהות של סוכר בדם). בנוכחות תעלה פתוחה אין נטילת קיטוב של קרום התא ואינסולין לא יכול להשתחרר. על כן, יש הפרשת אינסולין לקויה הגורמת לסוכרת. בכל המקרים הללו, לא נמצאה עדות למחלה אוטואימונית כגורם לסוכרת: נוגדנים לאינסולין, נוגדנים לאיי הלבלב ו-GAD (Glutamic Acid Decarboxylase) היו שליליים. נציין כי מוטציות של ביטול פעילות בגנים אלו גורמות למצב הפוך, של עודף ייצור אינסולין ולכן למצב של היפוגליקמיה (Hypoglycemia) והיפוגליקמיה יתר-אינסולינית תמידית מולדת (Persistent hyperinsulinemic hypoglycemia of infancy).
הסיבות לסוכרת גיל ינקות חולפת
- חריגה (Anomaly) בכרומוזום 6
ברוב המקרים (68 אחוזים) הגורם לסוכרת זו הוא חריגה בכרומוזום 6. חריגה זו היא איבוד ההטבעה (Imprinting) של מקטע 6q24. מצב זה מתרחש כאשר כרומוזום 6 או חלק ממנו (מקטע 6q24) מתקבל בתרומה רק מהאב ללא תרומה מהאם, או לחלופין כאשר האלל האימהי מושתק. לפיכך, יש הפעלה של האלל האבהי. המקטע הכרומוזומלי מכיל 3 גנים הקשורים למעגל התא, מוות תאי מתוכנן והפרשת אינסולין. חריגה זו עלולה להיגרם בשלושה מצבים: דיסומיה (Disomy) אבהית של כרומוזום 6, שכפול חלקי של הזרוע הארוכה הכולל מקטע 6q24 או פגם במטילציה (Methylation) של האלל האימהי.
- מוטציות בגנים המקודדים לתעלת האשלגן
כרבע מהמקרים של סוכרת גיל ינקות חולפת נגרם על ידי מוטציות שונות אללים (Heterozygous) (פגם באלל אחד) משפעלות באחד משני הגנים המקדדים לתעלת האשלגן KATP: KCNJ11 המקודד לתת יחידה Kir6.2 (10 אחוזים מהמקרים) ו-ABCC8 המקודד לתת יחידה SUR1 של תעלת האשלגן (13 אחוזים מהמקרים).
ב-10 אחוזים מהמקרים הסיבה לסוכרת גיל ינקות חולפת אינה ידועה.
הסיבות לסוכרת גיל ינקות קבועה
הסיבות לסוכרת גיל ינקות קבועה רבות ומגוונות יותר בהשוואה לסוכרת גיל ינקות חולפת. ידועים 10 גנים המעורבים בהתפתחות של סוכרת זו.
- מוטציות בגנים המקודדים לתעלת האשלגן
כשליש מהמקרים של סוכרת גיל ינקות קבועה נגרם, כאמור, עקב מוטציה שונת אללים בגן ל-KCNJ11 המקודד לתת-יחידה Kir6.2 של תעלת האשלגן KATP ובכעשירית מהמקרים, עקב מוטצית שפעול שונת אללים בגן ל-ABCC8 המקודד לתת-יחידה SUR1 של תעלת האשלגן KATP. יש קשר מערך גנטי-חזותי (Genotype-phenotype) במוטציות לתעלות האשלגן: מוטציות מסוימות יגרמו לסוכרת גיל ינקות חולפת, אחרות לקבועה ומוטציות מסוימות אחרות יכללו הפרעה עצביות נוסף על הסוכרת. תעלות אשלגן נמצאות גם ברקמות אחרות, כגון מוח, עור ושריר. ייתכן שזו הסיבה להפרעה העצבית במטופלים אלו.
מוטציות שזוהו בגנים הגורמים לסוכרת גיל הינקות זוהו גם במספר מועט של מקרים בסוכרת בגיל המבוגר. מוטציה בתת-יחידה Kir6.2 של תעלת האשלגן זוהתה בשלושה חולי סוכרת בני משפחה אחת שאובחנו בגילאים שונים. אותה מוטציה הייתה הגורם לסוכרת גיל ינקות חולפת, לסוכרת שאובחנה בגיל הילדות ולסוכרת שאובחנה בגיל המבוגר והתבטאה קלינית באופן דומה לסוכרת מסוג 2[3].
- מוטציה שונת אללים בגן לאינסולין
מוטציה זו היא הגורם השני בשכיחותו לסוכרת גיל ינקות קבועה (23 אחוזים מהמקרים). ב-2007 תיאר סטוי לראשונה ארבעה בני משפחה אחת שאובחנו בין הגילאים 5 חודשים עד 22 שנים כחולי סוכרת. בניתוח תאחיזה ובבדיקת גנים מועמדים נמצאה מוטציה בגן לאינסולין כגורם לסוכרת[4]. מאז תוארו מקרים נוספים, כולל שני מקרים ממרכז שניידר[5].
המוטציה בגן לאינסולין גורמת ליצירת חלבון מוטנטי הפוגם ביכולת הקיפול של מולקולת הקדם-אינסולין (Proinsulin) וגורמת ללכידתה ברשתית תוך-פלזמתית (Endoplasmic reticulum). הצטברות של הקדם-אינסולין המוטנטי בתאי הבטא גורמת להרס התאים ולירידה עד היעלמות של הפרשת האינסולין.
רוב המקרים הם אקראיים, אך 20 אחוזים מהמקרים הם משפחתיים ומועברים בתורשה אוטוזומלית נסגת (Recessive). 85 אחוזים מהחולים מאובחנים לפני גיל חצי שנה, ו-96 אחוזים לפני גיל שנה.
מוטציות שונות אללים בשלושת הגנים הבאים, תוארו בעבר כגורמות לסוכרת מסוג MODY (Maturity Onset Diabetes of the Young): סוכרת זו היא אוטוזומלית שלטת (Dominant), מתגלה לרוב מתחת גיל 25 שנים ונגרמת עקב פגם ראשוני בתפקוד של תאי בטא של הלבלב.
ערך מורחב – גנטיקה של סוכרת וסיבוכיה - Genetics of diabetes and its complications#צורות חד-גניות של סוכרת
פגם שווה אללים (Homozygous) (פגם בשני האללים) באותם גנים יגרום לסוכרת בגיל ינקות. שלושת הגנים הם:
- גן לגלוקוקינז - האנזים גלוקוקינז, גורם לזירחון של גלוקוז. תגובה זו היא השלב הראשון בתהליך הפרשת אינסולין בתגובה לרמות הסוכר בדם. פגם באלל אחד של הגלוקוקינז גורם לפגיעה קלה בתפקוד האנזים ולעליית רמות גלוקוז קלה מלידה הנקראת MODY2. אולם, פגם שווה אללים, בשני האללים בגן לגלוקוקינז, תואר כגורם לסוכרת גיל ינקות קבועה מלידה
- שני הגנים הנוספים, PDX-1/IPF ו-HNF-1, מקודדים לגורמי שעתוק, האחראים להתפתחות הלבלב והפרשת אינסולין. מוטציה שוות אללים בגנים אלו נדירה. הסוכרת נגרמת עקב תת-התפתחות (Hypoplasia)/חוסר התפתחות (Agenesis) של הלבלב
יש מספר תסמינים קליניים המורשים בצורה אוטוזומלית נסגת ומשלבים סוכרת גיל ינקות ואפיונים נוספים. תסמינים אלו מעידים על קיומם של גנים נוספים הקשורים להפרעה בחילוף החומרים של הגלוקוז.
- תסמונת ה-IPEX (Immune dysfunction, Polyendocrinopathy, Enteropathy, X-linked) - תסמונת נדירה הכולל הפרעה חיסונית קשה, הפרעות אנדוקריניות והפרעות מערכת עיכול. לרוב זוהי מחלה קשה המתבטאת מלידה וגורמת למוות בגיל צעיר
- תסמונת וולקוט-רליסון (The Wolcott-Rallison syndrome)- תסמונת הכוללת מחלת עצם, אוסטיאופורוזיס, סוכרת בגיל הינקות ומומי כליה
- יש עוד תסמונות, שבהן סוכרת בגיל הינקות מופיעה עם תת-התפתחות של המוחון או תת-תריסיות וגלאוקומה
בשליש ממקרי סוכרת גיל ינקות קבועה עדיין לא נמצא גורם אטיולוגי.
סיכום הסיבות לסוכרת גיל ינקות חולפת וקבועה
- סוכרת גיל ינקות חולפת
- 68 אחוזים - חריגה בכרומוזום 6
- דיסומיה אבהית
- הכפלה אבהית
- פגם במטילציה
- 23 אחוזים - מוטציות שפעול שונות אללים בתעלת האשלגן KATP
- תת-יחידה SUR1 (13 אחוזים)
- תת-יחידה Kir6.2 (10 אחוזים)
- 10 אחוזים - מקרים לא ידועים
- סוכרת גיל ינקות קבועה
- 41 אחוזים - מוטציות שפעול שונות אללים בתעלת האשלגן KATP
- תת-יחידה Kir6.2 (31 אחוזים)
- תת-יחידה SUR1 (10 אחוזים)
- 12 אחוזים - מוטציה בגן לאינסולין
- 4 אחוזים - מוטציה שוות אללים בגן לגלוקוקינז
- מוטציות שוות אללים בגנים הקשורים להתפתחות הלבלב
- HNF-1, PDX-1/IPF-1
- 4 אחוזים - תסמונות גנטיות בתורשה אוטוזומלית נסגנית
- תסמונת וולקוט-רליסון (3 אחוזים)
- תסמונת IPEX (1 אחוזים)
- אחרים נדירים
- 39 אחוזים - מקרים לא ידועים
קליניקה
- סוכרת גיל ינקות חולפת
היא בדרך כלל אקראית, מאופיינת בסוכרת המופיעה בשבועות הראשונים לחיים, רמות אינסולין נמוכות והיעדר קטונוריה (Ketonuria). סוכרת זו בהגדרתה חולפת, ועל כן נקראת גם סוכרת מולדת חולפת (Congenital temporary diabetes mellitus).
התקופה הרחמית מאופיינת בהאטה בגדילה התוך רחמית (IUGR, Intrauterine Growth Restriction) ואחוז ניכר נולדים קטנים לגיל ההיריון. ההאטה בגדילה התוך-רחמית נובעת בחלקה עקב חסר אינסולין, שהוא גורם גדילה תוך-רחמי.
המופע הקליני מתבטא בהפרעה בשגשוג (FTT, Failure To Thrive), התייבשות, איבוד משקל, החלפת חיתולים מרובה, אי שקט ולעיתים קטוזיס (Ketosis) קלה. בחלק מהמקרים נצפים סימנים גופניים, כגון: לשון גדולה ובקע טבורי. ברוב המקרים הגורם לסוכרת הוא ירידה זמנית בהפרשת אינסולין ועל כן רובם נזקקים בתחילה לטיפול באינסולין המאפשר ביצוע של הדבקת הגדילה (Catch up growth), שיפור בקצב הגדילה ובעלייה במשקל.
התינוקת נולדה במועד במשקל של 1,800 גרם (קטנה לגיל היריון). הטיפול באינסולין הופסק בגיל 10 חודשים. מעקומת הגדילה ניתן לראות את השיפור הניכר בקצב הגדילה וביצוע הדבקת הגדילה עם הטיפול באינסולין. הגורם לסוכרת אובחן כדיזומיה של כרומוזום 6.
סוכרת גיל ינקות חולפת לרוב בשנה וחצי הראשונות לחיים. אולם, ההפרעה בפעילות הלבלב נותרת בדרגות שונות במהלך החיים. הפרעה זו באה לידי ביטוי בעתות דחק של חילוף חומרים, כגון: מחלות מקבילות או התבגרות, אז עלול להופיע אירוע חולף של עליה בגלוקוז בדם. ב-40 אחוזים מהמקרים עלולה להופיע סוכרת או הפרעה בסבילות לגלוקוז מאוחר יותר בחיים, לרוב 4–14 שנים לאחר היעלמות הסוכרת בגיל הינקות.
- סוכרת גיל ינקות קבועה
היא בדרך כלל אקראית, אך קיימים גם מקרים משפחתיים ומספר תסמונות המשלבות סוכרת בגיל הינקות. עליה ברמות גלוקוז על רקע רמות אינסולין נמוכות מופיעה בחודשים הראשונים לחיים. בשליש מהמקרים נצפית חמצת מטבולית (Metabolic acidosis) בעת האבחנה. סוכרת זו בהגדרתה אינה חולפת.
במחקר שבדק אפיונים קליניים ב-29 חולים עם סוכרת גיל ינקות קבועה לעומת 21 חולים עם סוכרת גיל ינקות חולפת, נמצא כי בחולים עם סוכרת גיל ינקות קבועה שכיחות נמוכה יותר של הפרעה בגדילה התוך-רחמית, גיל אבחנה "מבוגר" יותר (גיל חציון 27 ימים לעומת 6 ימים) והפרעת חילוך חומרים קשה יותר (אחוז גבוה יותר באופן משמעותי הם בעלי תסמינים קליניים, התייבשות וחמצת מטבולית וזקוקים למינון גבוה יותר של אינסולין) בעת האבחנה מאשר חולים בסוכרת גיל ילדות חולפת. אולם, קיימת חפיפה בין האפיונים הקליניים ועל כן, לא ניתן להבדיל קלינית בעת האבחנה בין סוכרת חולפת לקבועה ויש צורך בבדיקה גנטית לזיהוי הפגם הגורם לסוכרת. הפגם הגנטי יקבע את הפרוגנוזה, טיפול וייעוץ גנטי[6].
המהלך הקליני של החולים בסוכרת גיל ינקות קבועה עקב מוטציה ב-Kir6.2, תואר לראשונה על ידי גילון וחבריו ב-10 מטופלים[1]. גיל אבחנה ממוצע היה חודש וחצי (טווח מלידה עד גיל 6 חודשים), לכל החולים בעת האבחנה היו רמות הסוכר גבוהות באופן משמעותי ובמחציתם - חמצת מטבולית. רובם (68 אחוזים) היו בעלי משקל לידה מתחת לאחוזון 3. ב-40 אחוזים מהמקרים היו גם הפרעות עצביות, שעיקרן הפרעה התפתחותית תנועתית וקוגניטיבית, חולשת שרירים, כפיון ואפיונים דיסמורפיים (Dysmorphic). הפרעה ברכישת שפה וקשרים חברתיים היו בולטים (סוכרת המופיעה עם הפרעה עצבית חמורה נקראת תסמונת DEND - Developmental delay, Epilepsy, and Neonatal Diabetes).
המהלך הקליני של החולים בסוכרת גיל ינקות קבועה עקב מוטציה ב-SUR1 תואר לראשונה על ידי בבנקו וחברי ב-9 מטופלים[2]. גיל אבחנה ממוצע היה חודש (טווח מלידה עד גיל 4 חודשים), לכל החולים בעת האבחנה היו רמות סוכר גבוהות ובחמישית מהמקרים לווה בחמצת מטבולית. 22 אחוזים היו בעלי משקל לידה מתחת אחוזון 3. ב-44 אחוזים מהמקרים היו גם הפרעות עצביות, שעיקרן הפרעה התפתחותית בדומה למוטציה ב-Kir6.2, אך ללא פרכוסים או חולשת שרירים.
האפיונים הקליניים של חולים עם מוטציה בגן לאינסולין דומים לחולי סוכרת עקב מוטציות בתעלת האשלגן (Kir6.2, SUR1), מלבד גיל אבחנה מאוחר יותר יחסית (גיל החציון בעת האבחנה - 11 שבועות לעומת 8 שבועות). לרובם משקל לידה נמוך ובעת האבחנה שני שלישים עם חמצת מטבולית ולמחצית היפרגליקמיה (Hyperglycemia) תסמינית. כולם תלויים בטיפול באינסולין. בניגוד לחולים עם מוטציות בתעלות האשלגן, לא תוארה הפרעה עצבית נלווית.
- תיאור מקרה
תינוק בן 4.5 חודשים הופנה למיון עקב דלקת שקדים, חום גבוה וסימני התייבשות. בבדיקות המעבדה הראשוניות נמצא סוכר 926 מיליגרם לדציליטר ללא חמצת מטבולית. המוגלובין מסוכרר (HbA1c) היה 13.2 אחוזים (גבול עליון של התקין - 5.8 אחוזים). סמנים אוטואימוניים (נוגדנים לאינסולין, איי הלבלב ו-GAD) היו שליליים.
באנמנזה התינוק נולד לאחר היריון מהפריה חוץ גופית במועד, במשקל 2.5 קילוגרם, ילד שלישי במשפחה, לאב סוכרת שהתגלתה במהלך השירות הצבאי. הוא מטופל בסולפונילאוראה (Sulfonylurea). מאז גיל חודשיים האם מתארת תמונה של כשל בשגשוג, חוסר עלייה במשקל, אי שקט, תקופות שינה קצרות, מחלות נגיפיות חוזרות והחלפת חיתולים תכופה.
אין עדות לנוגדנים המצביעים על תהליך אוטואימוני. גילו הצעיר, בעת האבחנה, אינו מספיק כדי לאפשר לתהליך אוטואימוני להרוס את מרבית הלבלב ולגרום לסוכרת. כמו כן, במקרה של סוכרת מסוג 1 היינו מצפים להפרעת חילוף חומרים קשה יותר ולהופעת חמצת מטבולית. כל אלו מעידים שמדובר ב"סוכרת אחרת".
אבחנה
אבחנה מוקדמת של סוכרת גיל הינקות כרוכה בערנות קלינית והכרה של התסמונת. משאובחנה המחלה, יש להתחיל בטיפול באינסולין ולבצע סקירה לגנים הידועים כגורמים לסוכרת גיל הינקות. גילוי הפגם הגנטי מאפשר טיפול תרופתי מתאים ומתן ייעוץ גנטי למשפחה. על כל חולה סוכרת שאובחן מתחת לגיל חצי שנה לעבור סקירה גנטית מאחר שלמציאת הפגם יש השלכות טיפוליות מרחיקות לכת.
במכון לסוכרת במרכז שניידר אובחנו 14 חולים עם סוכרת גיל ינקות בשנים 2006-1975: 5 מטופלים (36 אחוזים) עם סוכרת גיל ינקות חולפת ו-9 מטופלים (64 אחוזים) עם סוכרת גיל ינקות קבועה. בניתוח גנטי שבוצע בשיתוף פעולה עם פרופ' פולאק[5] נמצאו במקרים של הסוכרת החולפת שני מקרים של מוטציה בתת-יחידה SUR1 של תעלת האשלגן ומקרה אחד של דיסומיה 6. במקרים של סוכרת גיל ינקות קבועה נמצאו 3 מקרים של מוטציה בגן ל-KirI6.2, שני מקרים של מוטציה בגן לאינסולין ומקרה אחד של חוסר התפתחות של הלבלב.
טיפול
זיהוי של מוטציות בתעלת האשלגן כגורם לסוכרת גיל הינקות על ידי חוסר סגירה של תעלות האשלגן העלה את אפשרות של טיפול פומי ב"תרופות ישנות" לסוכרת, סולפונילאוראה. קבוצת התרופות סולפנילאוראה נקשרת לקולטן SUR בתעלת האשלגן וסוגרת את תעלת האשלגן בדרך, שאינה תלויה ב-ATP. כך ניתן לעקוף את ההפרעה הגורמת לתעלות להישאר פתוחות למרות רמות ATP גבוהות בתא. זיהוי מוטציות אלו הוביל לפריצת דרך. מטופלים ששנים טופלו בזריקות אינסולין עברו לטיפול פומי בסולפנילאוראה.
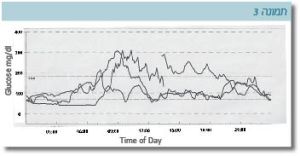
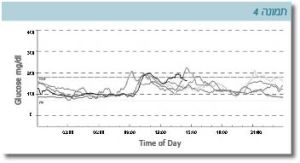
ההשפעה הניכרת של מעבר לטיפול פומי מומחשת על ידי המקרה הבא של מטופלת במכון שניידר: מדובר באישה בת 32 שנים, שאובחנה עם סוכרת מגיל 4 ימים לחיים וטופלה בזריקות אינסולין עם איזון מטבולי בינוני, כפי שמתבטא בהמוגלובין מסוכרר של 7.6 אחוזים. עם הפרסום של המוטציות בתעלות האשלגן נערכה בדיקה גנטית ונמצא כי הגורם לסוכרת היא מוטציה בגן המקודד לתת-יחידה Kir6.2 של תעלת האשלגן. המטופלת הועברה לטיפול פומי בסולפנילאוראה לאחר 32 שנים שטופלה באינסולין. ניתן לראות בתרשימים הבאים את רמות הסוכר כפי שנרשמו על ידי מדידה רציפה בחיישן לפני המעבר לטיפול בסולפנילאוראה (תמונה 3) ואחריו (תמונה 4). בטיפול בסולפנילאוראה נצפתה פחות תנודתיות ברמות הסוכר ושיפור ניכר באיזון הסוכרת. המוגלובין מסוכרר ירד ל-5.4 אחוזים (טווח תקין עד 5.8 אחוזים).
מספר מחקרים שדווחו בספרות, הראו כי הטיפול בתרופות פומיות של סולפנילאוראה הוא טיפול פזיולוגי יותר, משפר איכות חיים ומוביל לאיזון חילוף חומרים טוב יותר מאשר הטיפול באינסולין. בעשרה אחוז מהמקרים היה כישלון במעבר של המטופלים לסולפנילאוראה למרות קיום המוטציה בתעלת האשלגן[7].
המקרים של סוכרת גיל ינקות קבועה הנגרמים על ידי מוטציה חד אלליות בגן לגלוקוקינז, גם כן מגיבים לסולפנילאוראה, אך בשכיחות נמוכה יותר מאשר במוטציות בתעלות האשלגן, וההסבר הפזיולוגי לכך אינו ברור. שאר המקרים של סוכרת גיל ינקות קבועה הנגרמים על ידי מוטציות בגן לאינסולין או בגנים האחראים להתפתחות הלבלב יזדקקו באופן קבוע לאינסולין.
הטיפול בסוכרת גיל ינקות חולפת ברוב המקרים הוא באינסולין. הטיפול באינסולין מאפשר תזונה מועשרת בעלת ערך קלורי גבוה וגורם לשיפור בגדילה ובהתפתחות.
סוכרת המופיעה בגיל הרך, בתינוקות שעדיין יונקים כרוכה בקשיים מרובים. טיפול בזריקות אינסולין מצריך משטר של אכילה בזמנים קבועים שלא תמיד תואמים את רצון התינוק, מועדי הארוחות ותזמונן אינו צפוי ומצד שני, זמני הפעילות והערנות אינם חזויים מראש. יש קושי במתן כמויות קטנות של אינסולין (מבחינת הדיוק וההזרקה) וכן רגישות גבוהה יותר בגיל זה לתכשירי האינסולין. כל אלו וחוסר היכולת לבטא סימנים ולהרתיע בפני סימנים המקדימים הופעה של היפוגליקמיה מסווגים קבוצת מטופלים אלו בסיכוי לפתח אירועי היפוגליקמיה (והיפרגליקמיה), במיוחד בתקופה שבה רקמת המוח פגיעה ביותר. נוסף על כך, מחלות נגיפיות שכיחות יותר בתדירותן בגיל זה ולרוב מלוות בחוסר תיאבון ובשינוים בהרגלי האכילה, המקשים על מתן אינסולין בצורה רציפה. מתן אינסולין בטפטוף קבוע יכול להתאים בצורה טובה יותר, כמו במשאבת אינסולין. הטיפול במשאבת אינסולין מאפשר גמישות בזמני ארוחות, מינונים קטנים שונים של אינסולין ופחות שינויים הנובעים מאופן ההזרקה ושוני בספיגת האינסולין. יש מספר דיווחים בספרות לגבי יעילות ובטיחות השימוש במשאבת אינסולין בגיל הרך. פולאק הראה שיפור משמעותי באיזון הסוכרת וירידה בשכיחות של אירועי היפוגליקמיה תוך שמירה על גדילה והתפתחות תקינים[8]. במחקר שבוצע בשלושה מרכזי סוכרת: מכון שניידר, בית החולים רמב"ם וסלובניה, בפעוטות עם סוכרת המטופלים במשאבה נמצא שהטיפול בטוח, יעיל וגרם לשביעות רצון של ההורים ממנו[9].
פרוגנוזה
גילויים של הגנים המעורבים בסוכרת גיל הינקות הוא פתח לתגליות גנטיות נוספות, שישליכו על ההבנה ועל הטיפול בסוגי סוכרת נוספים.
ביבליוגרפיה
- ↑ 1.0 1.1 Gloyn AL, et al. Activating mutations in the Gene Encoding the ATP-Sensitive Potassium-Channel Subunit Kir6.2 and Permanent Neonatal Diabetes. NEJM 2004;350:1838-1849
- ↑ 2.0 2.1 Babenko AP, et al. Activating mutations in the ABCC8 Gene in Neonatal Diabetes Mellitus. NEJM 2006;355:456-466
- ↑ Sperling MA. Neonatal diabetes mellitus: from understudy to center stage. Curr Opin Pediatr 2005;17:512-518
- ↑ Stoy J, et al. Insulin gene mutations as a cause of permanent neonatal diabetes. Proc Natl Acad Sci USA 2007;18;104(38):15040-15044
- ↑ 5.0 5.1 Polak M, Aure´ D, Cave´ H, et al. Heterozyqous mussense mutations in the insulin gene are linked to permanent diabetes appearing in the neonatal period or in early infancy. Diabetes 2008;57(4):1115-1119
- ↑ Chantal M, et al. Neonatal diabetes mellitus: Chromosomal analysis in transient and permanent cases. J Pediatr 2002;141:483-489
- ↑ Pearson ER, et al. Switching from insulin to oral sulfonylureas in patients with diabetes due to Kir6.2 mutations. NEJM 2006;355:467-477
- ↑ Polak M, Shield J. Neonatal and very-early-onset diabetes mellitus. Semin Neonatol 2004;9(1):59-65
- ↑ Shehadeh N, Battelino T, Galatzer A, et al. Insulin Pump Therapy for 1±6 Year Old Children with Type 1 Diabetes. IMAJ 2004;6:284-286
קישורים חיצוניים
- סוכרת בגיל הינקות: תובנות חדשות, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר רויטל נימרי, המכון לאנדוקרינולוגיה וסוכרת, ע"ש ג'סי צ' ושרה לאה שפר, המרכז הארצי לסוכרת נעורים, מרכז שניידר לרפואת ילדים בישראל, פתח תקווה


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק