הבדלים בין גרסאות בדף "תסמונת גדילת יתר - Overgrowth syndrome"
ביאנקה סטרלצין (שיחה | תרומות) |
ביאנקה סטרלצין (שיחה | תרומות) |
||
| שורה 32: | שורה 32: | ||
* '''תסמונת ע"ש נבו/[[אהלרס-דנלוס]] סוג VIA''' {{כ}} (Nevo/Ehlers Danlos Type VIA){{כ}}(MIM 601451) היא תסמונת נדירה המועברת בתורשה נסגנית. התסמונת נגרמת בשל מוטציה בגן PLOD1 המקודד לאנזים Procollagen-Lysine 1,2-Oxoglutarate5-Dioxygenase 1. יש לציין כי מוטציה בגן PLOD1 יכולה לגרום לאהלרס-דנלוס VIA{{כ}} , בעלת מאפיינים דומים ללא קומה גבוהה. | * '''תסמונת ע"ש נבו/[[אהלרס-דנלוס]] סוג VIA''' {{כ}} (Nevo/Ehlers Danlos Type VIA){{כ}}(MIM 601451) היא תסמונת נדירה המועברת בתורשה נסגנית. התסמונת נגרמת בשל מוטציה בגן PLOD1 המקודד לאנזים Procollagen-Lysine 1,2-Oxoglutarate5-Dioxygenase 1. יש לציין כי מוטציה בגן PLOD1 יכולה לגרום לאהלרס-דנלוס VIA{{כ}} , בעלת מאפיינים דומים ללא קומה גבוהה. | ||
*'''תסמונת ע"ש בקווית-ווידמן'''- המנגנון הגנטי קשור בהחתמה גנומית, אך הבסיס המולקולרי לתופעות השונות, כולל גדילת יתר, אינו נהיר לחלוטין. ידוע על מעורבות של גנים הקשורים בגדילה והפעלתם הבלתי תקינה אשר הוכחה במהלך השנים האחרונות. מדובר בקבוצת גנים הממוקמת על כרומוזום 11p15 הכוללת גם את הגן IGF2 {{כ}}(Insulin Growth Factor 2). באופן תקין הגנים מתבטאים בשני האללים, זה הנתרם מהצד האבהי וזה מהצד האמהי. במצבים שבהם קיימת החתמה גנטית, המנגנון שונה. באזור הקשור לתסמונת זו על כרומוזום 11p15, קיימת החתמה גנטית ולכן הגנים באזור אינם מתבטאים משני האללים. במקום זה חלקם מתבטאים מהאלל האבהי (IGF2 ו-KCNQ10T1) וחלקם מהאלל האמהי (H19 ,CDKN1C ו-KCNQ1). שינויים בתבנית ההחתמה הגנומית יכולים לקרות מסיבות רבות, למשל: בשל חסר בדנ"א (DNA, {{כ}}Deoxyribonucleic Acid) באזור האמור להתבטא (כגון: H19 באלל האמהי) או בשל מוטציה במרכז ההחתמה האמור לשלוט בתבנית מתילציה (Methylation) נכונה. גדילת היתר וכן נטיית היתר לגידולים יוחסו לגנים השונים המעורבים במנגנון מורכב זה. גן שנחקר רבות ויוחס לו תפקיד בגדילת יתר בתסמונת זו הוא IGF2, אשר נמצא תחת אותה מערכת בקרה של החתמה גנומית, כמו H19 {{כ}}(12), אולם גם נושא זה אינו חד-משמעי. | *'''תסמונת ע"ש בקווית-ווידמן'''- המנגנון הגנטי קשור בהחתמה גנומית, אך הבסיס המולקולרי לתופעות השונות, כולל גדילת יתר, אינו נהיר לחלוטין. ידוע על מעורבות של גנים הקשורים בגדילה והפעלתם הבלתי תקינה אשר הוכחה במהלך השנים האחרונות. מדובר בקבוצת גנים הממוקמת על כרומוזום 11p15 הכוללת גם את הגן IGF2 {{כ}}(Insulin Growth Factor 2). באופן תקין הגנים מתבטאים בשני האללים, זה הנתרם מהצד האבהי וזה מהצד האמהי. במצבים שבהם קיימת החתמה גנטית, המנגנון שונה. באזור הקשור לתסמונת זו על כרומוזום 11p15, קיימת החתמה גנטית ולכן הגנים באזור אינם מתבטאים משני האללים. במקום זה חלקם מתבטאים מהאלל האבהי (IGF2 ו-KCNQ10T1) וחלקם מהאלל האמהי (H19 ,CDKN1C ו-KCNQ1). שינויים בתבנית ההחתמה הגנומית יכולים לקרות מסיבות רבות, למשל: בשל חסר בדנ"א (DNA, {{כ}}Deoxyribonucleic Acid) באזור האמור להתבטא (כגון: H19 באלל האמהי) או בשל מוטציה במרכז ההחתמה האמור לשלוט בתבנית מתילציה (Methylation) נכונה. גדילת היתר וכן נטיית היתר לגידולים יוחסו לגנים השונים המעורבים במנגנון מורכב זה. גן שנחקר רבות ויוחס לו תפקיד בגדילת יתר בתסמונת זו הוא IGF2, אשר נמצא תחת אותה מערכת בקרה של החתמה גנומית, כמו H19 {{כ}}(12), אולם גם נושא זה אינו חד-משמעי. | ||
| − | *[[תסמונת מרפן]]{{כ}} (MIM 154700) היא תסמונת גנטית המועברת בתורשה אוטוזומלית שלטת. רק ברבע מהמקרים (25%) לא קיים סיפור משפחתי ואז מדובר במוטציה חדשה, שמעתה תעבור הלאה בתורשה האופיינית. הגן לתסמונת מופה והוא נמצא על כרומוזום 15, סימונו FBN1 והוא מקודד לחלבון פיברילין 1 (Fibrillin). במצב תקין החלבון נמצא בחומר החוץ-תאי והוא מהווה מרכיב חשוב במבנה המכונה מיקרופיברילות (Microfibrils). מבנה זה נמצא ברקמות שונות בגוף ולו תפקידים חשובים ביצירה ובמאזן (Homeostasis) של החומר האלסטי, בחיבור בין התא לחומר החוץ-תאי ובבקרה של גורמי גדילה (Growth factors) שונים. מוטציות בגן גורמות ליצירת תוצר (=חלבון) לא תקין אשר מתערב עם התוצר (=חלבון) התקין שנוצר בהשראת הגן השני התקין ובמנגנון המכונה שליטה שלילית (Dominant negative) מפריע ליצירה תקינה של המיקרופיברילות. | + | *[[תסמונת מרפן]]{{כ}} (MIM 154700) היא תסמונת גנטית המועברת בתורשה אוטוזומלית שלטת. רק ברבע מהמקרים (25%) לא קיים סיפור משפחתי ואז מדובר במוטציה חדשה, שמעתה תעבור הלאה בתורשה האופיינית. הגן לתסמונת מופה והוא נמצא על כרומוזום 15, סימונו FBN1 והוא מקודד לחלבון פיברילין 1 (Fibrillin). במצב תקין החלבון נמצא בחומר החוץ-תאי והוא מהווה מרכיב חשוב במבנה המכונה מיקרופיברילות (Microfibrils). מבנה זה נמצא ברקמות שונות בגוף ולו תפקידים חשובים ביצירה ובמאזן (Homeostasis) של החומר האלסטי, בחיבור בין התא לחומר החוץ-תאי ובבקרה של גורמי גדילה (Growth factors) שונים. מוטציות בגן גורמות ליצירת תוצר (=חלבון) לא תקין אשר מתערב עם התוצר (=חלבון) התקין שנוצר בהשראת הגן השני התקין ובמנגנון המכונה שליטה שלילית (Dominant negative) מפריע ליצירה תקינה של המיקרופיברילות. עבודות שונות הראו במקביל כי לחולי מרפן גם כמות מופחתת של רקמת חיבור ויש הטוענים כי הדבר נובע מחשיפת יתר של הרקמה הלא תקינה לחיתוך חלבון. יש לציין כי הדבר לא מסביר את מנגנון גדילת היתר בחולי מרפן. לאחרונה דווח על יחסי גומלין בין פיברילין לגורם הגדילה TGF-β {{כ}}(Transforming Growth Factor beta) ומוטציות בגן המקודד לקולטן שלו, TGFBR2, נמצאו כגורמות לתסמונת מרפן סוג 2 (Marfan type I ,MFS II). |
== קליניקה == | == קליניקה == | ||
גרסה מ־07:39, 7 בנובמבר 2012
ערך זה נמצא בבדיקה ועריכה על ידי מערכת ויקירפואה, וייתכן כי הוא לא ערוך ומוגה.
| תסמונuת גדילת יתר | ||
|---|---|---|
| Overgrowth syndromes | ||

| ||
סינדרום Sotos
| ||
| יוצר הערך | ד"ר חנה וינקלר, ד"ר עמיהוד זינגר 
|
|
תסמונות של גדילת יתר בילדים הן קבוצה לא אחידה ומגוונת של מצבים המאופיינים בגדילה של איברי גוף או בגדילה כללית מעל 2 סטיות תקן לגיל. קבוצת המחלות הקשורה בגדילת יתר מגוונת הן מבחינת המעורבות הנוספת של מערכות גוף פגועות והן מבחינה הגנים המעורבים. עם ההתקדמות בתחום הגנטי וגילוי הגנים השונים ניתנת כיום האפשרות לאישור מדויק כאשר קיים חשד קליני לאחת התסמונות. הבנת התהליכים הגנטיים והביולוגיים המשפיעים על התמונה הקלינית, היא כל העת גורם לשינוי בגישה למטופלים. ייתכן כי בעתיד הבנה זו תאפשר מתן טיפולים גנטיים או רפואיים טובים יותר למטופלים אלה.
אפידמיולוגיה
- תסמונת מרפן (Marfan), שכיחותה באוכלוסייה הכללית היא 1:5,000-10,000
- השכיחות של תסמונת ע"ש סוטוס (Sotos) באוכלוסייה היא 1:15,000 לידות.
- תסמונת ע"ש בקווית-ווידמן (Beckwith-Wiedemann), שכיחותה באוכלוסייה 1:13,700
- התסמונת ע"ש וויבר (Weaver) (MIM 277590) היא תסמונת נדירה ועד היום תוארו פחות ממאה מקרים.
אטיולוגיה
הגדילה לגובה היא תהליך מורכב התלוי בגורמים גנטיים, תזונתיים, הורמונליים וסביבתיים (כמו מחלות מתמשכות, טיפולי קרינה וכד'). שינוי באחד הגורמים המשפיעים על הגדילה, עלול לגרום האטה בגדילה וקומה נמוכה. נדיר יותר ששינוי כזה יגרום גדילה מואצת. זיהוי של מצבים של גדילה מואצת חשוב לא פחות מזיהוי של מצבים של האטה בגדילה, כי הוא קשור לעתים קרובות במעורבות של מערכות גוף שונות, ומחייב התייחסות טיפולית וייעוץ מתאים של הרופא המטפל בנוגע לפרוגנוזה ולהשלכות על המשפחה. יש מקום לחשוב על בעיות אנדוקריניות באבחנה מבדלת של קומה גבוהה וגדילה מואצת. בנוסף, עוברים או תינוקות גדולים נולדים לאם סוכרתית לא מאוזנת במהלך ההיריון.
בעשור האחרון הצטבר מידע המאפשר לנו לזהות את הגורמים הגנטיים לחלק מהמצבים של גדילת יתר. מידע זה נותן בידינו כלים אבחנתיים מצד אחד ומאפשר הבנה מעמיקה יותר של התהליכים העומדים בבסיס הפתולוגי של מצבים אלה, מצד שני. אין ספק, שהבנת התהליכים האלה תאפשר, בסופו של דבר, טיפול טוב יותר במטופלים. למשל, הומוציסטינוריה (Homocystinuria) היא מחלה נסגנית (Recessive) הנגרמת בשל חסר אנזימטי של ציסטתיון בתא סינתאז (Cystathionin beta-synthase) וקשורה בקומה גבוהה ובמראה מרפנואידי (Marphanoid) (וכן במעורבות רב מערכתית). לאחרונה נמצא כי עלייה ברמת הומוציסטאין אצל מטופלים עם הומוציסטינוריה גורמת חיזור של קשרי דיסולפיד באזור ה-cbEGF של הגן פיברילין 1 (Fibrillin 1) הקשור בתסמונת מרפן. לנוכח ההבנה של התהליכים המולקולריים במחלה זו, קיימות אפשרויות טיפוליות הכוללות מתן Betaine, מתן פירידוקסין (ויטמין B6) והגבלת כמות המתיונין (Methionine) בדיאטה. בעבודה מבוקרת נמצא הבדל בגובה הממוצע בין הילדים המטפולים לאלה שאינם מטופלים
גילוי הבסיס הגנטי של התסמונות השונות מקנה הבנה טובה יותר של התהליכים הביולוגיים התורמים לגדילה התקינה והבלתי תקינה של השלד, מאפשר מעקב נכון ולעתים גם טיפולים מתאימים יותר למטופלים ומקנה את האפשרות לתת ייעוץ גנטי מדויק למשפחות. לא תמיד האבחון המולקולרי (ברמת הגן) נותן כלים נוחים לסיווג. למשל, מוטציה בגן FGFR3 גורמת, מצד אחד, לסוגים שונים של גמדות/קומה נמוכה (Achondroplasia או Hypochondroplasia) ומצד שני, מוטציה באותו גן באזור שונה ובמנגנון אחר גורמת לתסמונת גדילת יתר CATSHL (Camptodactyly, Tall stature, and Hearing Loss). כמו כן, לעתים יש יותר מגן אחד הגורם לאותו חזותי (Phenotype), מצב המוכר כאי אחידות גנטית. למשל, תסמונת מרפן יכולה להיות קשורה בגן FBN1, אבל גם בגנים TGFBR2 ו-TGFBR1.
אתיולוגיות גנטיות לפי תסמונת
- תסמונת על שם סוטוס (MIM 117550) עוברת בתבנית הורשה אוטוזומלית שלטת. הגורם הגנטי למחלה הוא מצב, שבו נשא של מוטציה בעותק אחד של הגן יבטא את המחלה מפני שכמות התוצר של העותק האחר והתקין של הגן אינה מספיקה לתפקוד נורמלי (Haploinsufficiency), בגן המקודד ל-NSD1 (Nuclear Receptor SET Domainprotein 1) אשר נמצא על כרומוזום 5q35. ב-90%-60% של המקרים נמצא מוטציה בגן זה. מרבית המקרים קשורים במוטציות חדשות (De novo), אולם תוארו משפחות שבהן המוטציה עברה מדוד לדור בתורשה שלטת.
- תסמונת סימפסון-גולבי-בהמל (SGBS, Simpson-Golabi-Behmel) (MIM 312870) נמנית עם התסמונות הנמצאות בתאחיזה לכרומוזום X. הגן לתסמונת התגלה והוא נמצא על הזרוע הארוכה של כרומוזום X ומקודד לחלבון GPC3 (Glypican 3). ב-70%-40% מהמקרים ניתן למצוא מוטציות בגן זה. תוארה גם תסמונת סימפסון-גולבי-בהמל מסוג II, אשר בה נמצא מאפיינים של סימפסון-גולבי-בהמל 1 ללא גדילת יתר והיא קשורה לגן אחר. המנגנון של גדילת היתר בתסמונת זו קשור ככל הנראה לתפקיד הגן בבבקרה של גורמי גדילה שונים.
- תסמונת ע"ש נבו/אהלרס-דנלוס סוג VIA (Nevo/Ehlers Danlos Type VIA)(MIM 601451) היא תסמונת נדירה המועברת בתורשה נסגנית. התסמונת נגרמת בשל מוטציה בגן PLOD1 המקודד לאנזים Procollagen-Lysine 1,2-Oxoglutarate5-Dioxygenase 1. יש לציין כי מוטציה בגן PLOD1 יכולה לגרום לאהלרס-דנלוס VIA , בעלת מאפיינים דומים ללא קומה גבוהה.
- תסמונת ע"ש בקווית-ווידמן- המנגנון הגנטי קשור בהחתמה גנומית, אך הבסיס המולקולרי לתופעות השונות, כולל גדילת יתר, אינו נהיר לחלוטין. ידוע על מעורבות של גנים הקשורים בגדילה והפעלתם הבלתי תקינה אשר הוכחה במהלך השנים האחרונות. מדובר בקבוצת גנים הממוקמת על כרומוזום 11p15 הכוללת גם את הגן IGF2 (Insulin Growth Factor 2). באופן תקין הגנים מתבטאים בשני האללים, זה הנתרם מהצד האבהי וזה מהצד האמהי. במצבים שבהם קיימת החתמה גנטית, המנגנון שונה. באזור הקשור לתסמונת זו על כרומוזום 11p15, קיימת החתמה גנטית ולכן הגנים באזור אינם מתבטאים משני האללים. במקום זה חלקם מתבטאים מהאלל האבהי (IGF2 ו-KCNQ10T1) וחלקם מהאלל האמהי (H19 ,CDKN1C ו-KCNQ1). שינויים בתבנית ההחתמה הגנומית יכולים לקרות מסיבות רבות, למשל: בשל חסר בדנ"א (DNA, Deoxyribonucleic Acid) באזור האמור להתבטא (כגון: H19 באלל האמהי) או בשל מוטציה במרכז ההחתמה האמור לשלוט בתבנית מתילציה (Methylation) נכונה. גדילת היתר וכן נטיית היתר לגידולים יוחסו לגנים השונים המעורבים במנגנון מורכב זה. גן שנחקר רבות ויוחס לו תפקיד בגדילת יתר בתסמונת זו הוא IGF2, אשר נמצא תחת אותה מערכת בקרה של החתמה גנומית, כמו H19 (12), אולם גם נושא זה אינו חד-משמעי.
- תסמונת מרפן (MIM 154700) היא תסמונת גנטית המועברת בתורשה אוטוזומלית שלטת. רק ברבע מהמקרים (25%) לא קיים סיפור משפחתי ואז מדובר במוטציה חדשה, שמעתה תעבור הלאה בתורשה האופיינית. הגן לתסמונת מופה והוא נמצא על כרומוזום 15, סימונו FBN1 והוא מקודד לחלבון פיברילין 1 (Fibrillin). במצב תקין החלבון נמצא בחומר החוץ-תאי והוא מהווה מרכיב חשוב במבנה המכונה מיקרופיברילות (Microfibrils). מבנה זה נמצא ברקמות שונות בגוף ולו תפקידים חשובים ביצירה ובמאזן (Homeostasis) של החומר האלסטי, בחיבור בין התא לחומר החוץ-תאי ובבקרה של גורמי גדילה (Growth factors) שונים. מוטציות בגן גורמות ליצירת תוצר (=חלבון) לא תקין אשר מתערב עם התוצר (=חלבון) התקין שנוצר בהשראת הגן השני התקין ובמנגנון המכונה שליטה שלילית (Dominant negative) מפריע ליצירה תקינה של המיקרופיברילות. עבודות שונות הראו במקביל כי לחולי מרפן גם כמות מופחתת של רקמת חיבור ויש הטוענים כי הדבר נובע מחשיפת יתר של הרקמה הלא תקינה לחיתוך חלבון. יש לציין כי הדבר לא מסביר את מנגנון גדילת היתר בחולי מרפן. לאחרונה דווח על יחסי גומלין בין פיברילין לגורם הגדילה TGF-β (Transforming Growth Factor beta) ומוטציות בגן המקודד לקולטן שלו, TGFBR2, נמצאו כגורמות לתסמונת מרפן סוג 2 (Marfan type I ,MFS II).
קליניקה
ילדים אשר להם תסמונת של גדילת יתר, יכולים להיות גדולים במשקל, בגובה ובהיקף ראש (או בחלק מהמדדים האלה) עוד בחיים התוך-רחמיים ומיד לאחר הלידה או שהם נולדים עם מדדי גדילה תקינים וחוצים את עקומות הגדילה הרגילות בחודשים הראשונים לחייהם.
התסמונות הקשורות בגדילת יתר, המוכרות לנו כיום, מאופיינות במעורבות רב מערכתית הכוללת לעתים גם סיכון יתר לגידולים שונים ולעתים קשורה בבעיות קוגניטיביות שונות. חשוב להכיר את התסמונות השונות כדי לאפשר לילדים אלה מעקב נכון וטיפולים במסגרות מתאימות, כדי לתת ייעוץ גנטי למשפחה בנוגע להריונות נוספים בעתיד וכן כדי לתת הסבר למטפלים ולמשפחות לגבי הפרוגנוזה של המצבים השונים. בחלק גדול של המצבים הגורם ידוע, וניתן לאשר את האבחנה באמצעות בדיקות.
תסמונות טיפוסיות של גדילת יתר
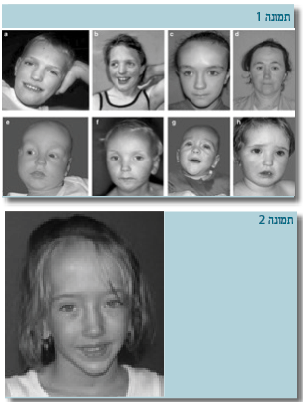
- תסמונת ע"ש סוטוס כוללת היקף ראש ו/או קומה גבוהה יותר מ-2 סטיות תקן לגיל ולמין, גיל עצמות מתקדם ובעיות התפתחות. יש לציין כי ברוב המקרים הקומה הסופית של הלוקים בתסמונת היא בטווח התקין. כמו כן, למטופלים סימנים של שינויים מבניים אופייניים הכוללים מצח גבוה ורחב, מפתח עיניים הנוטה כלפי מטה, סנטר בולט ומרחק גדול מהרגיל בין העיניים (Hypertelorism). מראה הפנים האופייני הוא הממצא האבחנתי הקליני הקיים כמעט בכל המקרים. בעיות נלוות נוספות כוללות כפיון, ממצאים במוח בבדיקת תהודה מגנטית, בעיות התנהגות, מומים בלב ומומים במערכת המין והשתן ועקמת.
אף שגדילת יתר היא מדד עיקרי בתסמונת זו, תוארו מקרים עם מוטציות בגן NSD1 אשר להם קומה רגילה והיקף ראש בגדר הרגיל. ההשערה היא כי הביטוי חמור יותר כאשר מדובר בחסר חלקי או מלא של הגן (Microdeletion) לעומת מצבים הנגרמים ממוטציה נקודתית, לפיכך במצבים המשפחתיים, שבהם התמונה הקלינית לרוב קלה יותר, אופייני למצוא מוטציה נקודתית.
לפי הספרות העדכנית, לילדים הלוקים בתסמונת סוטוס סיכון מוגבר של 3%-2% ללקות בגידולים שונים. תוארו מקרים של גידולים, כגון: טרטומה בעצמות העצה והזנב (Sacrococcygeal teratoma) וגידולים סרטניים, כגון: נוירובלסטומה (Neuroblastoma) והפטובלסטומה (Hepatoblastoma), וכן מקרים של לויקמיה לימפובלסטית חריפה (ALL, Acute Lymphoblastic Leukemia) ולימפומה של תאי T (T cell lymphoma). עדיין לא ברור אם מצב סיכון זה מחייב מעקב מיוחד בילדים עם תסמונת סוטוס.
- תסמונת וויבר מאופיינת בגדילת יתר המתחילה בחיים העובריים (Intrauterine) ונמשכת לאחר הלידה. למטופלים מבנה פנים עם שינויים, הדומה ללוקים בתסמונת סוטוס, אולם ללא הסנטר הבולט והרחב. בחולי Weaver הסנטר קטן, לעתים נסוג (Retrognatia) ואופייני קמט רוחבי בעור (Horizontal crease) בין הסנטר לשפה התחתונה. כמו כן, קיים מרחק גדול בין העיניים ואפרכסות אוזניים גדולות. לרובם קול נמוך וצרוד, בקע טבורי, שינויים אופייניים בשלד הכוללים גיל עצמות מתקדם, שינויים במבנה ובמנח האצבעות (Camptodactyly), תנועתיות לא מלאה של המפרקים (Contracture) וכן ציפורניים שקועות. היות וקיימת חפיפה קלינית בין תסמונת זו לתסמונת ע"ש סוטוס, בחלק מהחולים נבדק הגן NSD1 ואכן נמצאה בו מוטציה. אולם, ההנחה היא כי תסמונת Weaver היא תסמונת נפרדת אשר הגן האחראי לה עדיין לא אותר.
- מאפייני תסמונת סימפסון-גולבי-בהמל כוללים גדילת יתר המתחילה בחיים העובריים (Intra Uterine) ונמשכת לאחר הלידה. מראה פנים "גס", אף קצר עם נחיריים גדולים, אפרכסות נמוכות ומסובבות לאחור, מרחק גדול בין העיניים וכן נטייה כלפי מטה של הזוויות החיצוניות של ארובות העיניים. נוסף על כך, ניתן למצוא מעורבות של מערכות גוף שונות, כגון: מומי לב, מומי שלד (אצבע נוספת - Polydactyly), מומים בכליות ובדרכי השתן, חיך שסוע, בקע טבורי, בקע מפשעתי ומומים נוספים. לרוב החולים בעיות התפתחותיות ובעיקר איחור שפתי ותנועתי. חשוב לציין כי קיים סיכון יתר לגידולים בתסמונת זו, בעיקר גידול ע"ש וילמס בכליות וכן הפטובלסטומה ונפרובלסטומה. תסמונת ע"ש בקווית-ווידמן נמצאת באבחנה מבדלת, אולם קיימים הבדלים בין שתי התסמונות הן במאפיינים הקליניים והן בדרך ההורשה. התמונה הקלינית מתבטאת לעתים בצורה קלה גם אצל האמהות הנשאיות.
- תסמונת ע"ש נבו כוללת קומה גבוהה עוד בחיים העובריים, שילוב של עקמת ועקשת (Kyphoscoliosis), שינויים בכפות הרגליים, רפיון שרירים כללי, גמישות יתר של המפרקים הגדולים, בצקת של כפות הידיים והרגליים ואצבעות דמויות כישור שהולכות ומתחדדות כלפי הקצה (Fusiform).
- התסמונת ע"ש פרלמן או המרטומות כלייתיות, נפרובלסטומטוזיס וענקות עוברית (Renal hamartomas ,nephroblastomatosis and fetal gigantism) (MIM 267000) היא תסמונת נסגנית נדירה, המתאפיינת בריבוי מי שפיר בעת ההיריון, גדילת יתר מיד לאחר הלידה, שינויים בכליות, הכוללים: כליות מוגדלות, נפרובלסטומטוזיס, מבנה פגום (Dysplasia) של הכליות ונטייה לפתח גידול ע"ש וילמס בכליות. קיים מראה פנים אופייני, פנים עגולות ומלאות, גשר אף נמוך, מראה רפוי עם פה פעור ושפה עליונה בולטת וכן סנטר נסוג מעט. התמותה גבוהה ובדרך כלל בגיל צעיר. יש לעתים הגדלה של כבד וטחול, הפרשת יתר של אינסולין ומיימת. הגורם התורשתי אינו ידוע.
- התסמונת ע"ש בקווית-ווידמן (MIM 130650) היא ברוב המקרים אקראית. היא מתאפיינת בעובר גדול לגיל הריון (Macrosomia), לשון גדולה (Macroglossia), טחול וכבד מוגדלים (Visceromegaly) וכן נטיית יתר לגידולים שונים. סימנים מבניים נוספים ומעורבות מערכות גוף שונות מתוארים בטבלה 2. ברוב המקרים ההתפתחות של ילדים אלה היא תקינה. האבחנה מסתמכת על מדדים קליניים המתוארים בטבלה. המעקב כולל טיפול בהיפוגליקמיה לאחר הלידה, טיפולים הקשורים בבעיות משניות ללשון הגדולה (בעיות נשימה, האכלה ודיבור) ובדיקות תקופתיות של על-שמע ורמת חלבון עוברי בדם שנועדות לגילוי מוקדם של גידולים.
בממוצע, המשקל והאורך אצל מטופלים עם בקווית-ווידמן הוא בערכים הנמצאים מעל אחוזון 95 מיד לאחר הלידה ועד לבגרות. בהמשך הערכים הופכים לתקינים. יש לציין כי לחלק מהמטופלים גיל עצמות מתקדם לעומת הגיל עד גיל 4 שנים לערך.
תסמונות הקשורות בקומה גבוהה
;תסמונת מרפן (Marfan)
ערך מורחב – תסמונת מרפן - Marfan syndrome
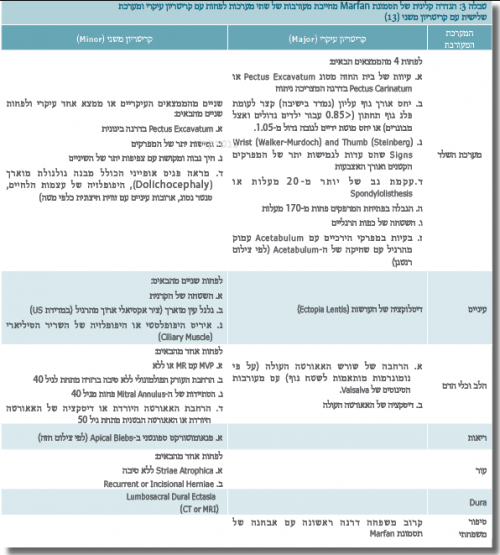
הלוקים בתסמונת הם ברוב המקרים בעלי קומה גבוהה עם אורך גפיים חריג ביחס לשלד (Dolichostenomelia). במעקבי גדילה רובם הגדול יימצא סביב אחוזון 95% ואילך. כיום, מתבצעת האבחנה הקלינית לפי המדדים שנקבעו ע"י הקבוצה הבלגית, De Paepe et al., בשנת 1996 (טבלה 3). המדדים נקבעו כדי להגיע לדיוק באבחון הקליני, כך שלא כל פרט גבוה בעל מבנה פנים מוארך ו/או מוטת ידיים גדולה (Marfan habitus) יקבל את האבחון הקליני כלוקה בתסמונת.
תסמונת ע"ש Loeys-Dietz
תסמונת נדירה אשר כיום מוכרים בה 2 סוגים עיקריים: LDS (Loeys-Dietz) Type I, II, המועברים בתורשה אוטוזומלית דומיננטית (AD). המערכות העיקריות המעורבות בחולי LDS הן:
- המערכת הווסקולרית - הרחבה או דיסקציה של שורש האאורטה (95% מהמקרים). אנוריזמות או פיתול (Tortuosity) של כלי הדם העורקיים באזורי גוף שונים.
- מערכת השלד, כגון: עקמת, מבנה לא תקין של בית החזה, ארכנודקטלי וכד'.# גולגולת/פנים - היפרטלוריזם, חייך שסוע או ענבל מפוצל (Bifid Uvula), תפרים לא תקינים בגולגולת (Craniosynostosis).
- העור - עור דק/שקוף, ניזוק בקלות, צלקות לא תקינות.
ב-2 הסוגים אופייני למצוא פגיעה במערכת הווסקולרית ובשלד. ב-LDS1 אופייני נוסף על כל אלה, עירוב של גולגולת/פנים, ואילו ב-LDS2 עירוב של העור.
בשנים האחרונות התברר כי הסיבה לתסמונות הן מוטציות בגנים TGFBR2 ו-1 TGFBR (Transforming Growth Factor ß Receptor) הנמצאים על כרומוזום 9q ו-3p בהתאמה.
תסמונת LDS2 דומה בחלק מהמאפיינים הקליניים שלה לתסמונת Marfan ונקראת גם Marfan Type II. בספרות קיימים דיווחים על חולים שענו לקריטריונים של תסמונת מרפן, אולם לא נמצאו נושאים מוטציה בגן FBN1, ובבדיקה נמצאה אצלם מוטציה בגן TGFBR2.
תסמונת CCA (Congenital contractural arachnodactyly) (Beals Syndrome)
תסמונת CCA (MIM 121050) העוברת בתורשה אוטוזומלית דומיננטית, מתאפיינת בקומה גבוהה, קונטרוקטורות מהלידה (בברכיים, במרפקים ובאצבעות) אצבעות ארוכות, היפוטוניה, קיפוסקוליוזיס מתקדמת ומבנה לא תקין של אפרכסות האוזניים (Crumpled Ears). בצורתה הקלסית התסמונת אינה כוללת מעורבת של המערכת הקרדיו-וסקולרית, אולם תוארו מספר מקרים של חולים עם CCA אשר נמצאה אצלם הרחבה של שורש האאורטה.
הגן המעורב בתסמונת זו הוא FBN2 המקודד לחלבון Fibrillin 2 אשר נמצא על הזרוע הארוכה של כרומוזום 5. מנגנון הפגיעה ברקמת החיבור דומה לזה של FBN1. ההנחה היא כי הביטוי הפנוטיפי שונה בשל עיתוי שונה של התבטאות הגן בעת התפתחות העובר והתבטאותו ברקמות שונות מאלה של FBN1.
הומוציסטינוריה
הומוציסטינוריה (MIM 236200) היא תסמונת נדירה העוברת בתורשה אוטוזומלית רצסיבית. היא מאופיינת בקומה גבוהה מעל אחוזון 95, אוסטאופורוזיס, סקוליוזיס, מעורבות של העיניים Ectopia Lentis) וקוצר ראייה) מעורבות של כלי דם (Livido Reticularis) וכן מעורבות נוירולוגית הכוללת פיגור שכלי ומחלות פסיכיאטריות.
התסמונת נגרמת ממוטציות בגן המקודד לאנזים Cystathionine Beta-Synthase. בשל ירידה בפעילות האנזים, נמצא בבדיקת דם רמות גבוהות מאוד של הומוציסטאין ומתיונין ורמות נמוכות של Cysteine ו-Cystathinine. כפי שכבר תיארנו, ניתן לטפל בחלק מהתופעות של המחלה באמצעות תרופות. גם במחלה זו נמצא קשר לתסמונת Marfan - הרמות הגבוהות של הומוציסטאין גורמות חיזור של גשרי דיסולפיד על החלבון פיברילין ומשנה את המבנה שלו, ובשל כך משנות גם את תפקודו.
תסמונות נדירות יותר
תסמונת LFS (Lujan-Fryns)
תסמונת LFS (MIM 309520) היא נדירה המועברת בתאחיזה לכרומוזום X. התסמונת כוללת קומה גבוהה, אצבעות ארוכות וגמישות יתר של המפרקים הקטנים ומבנה מרפנואידי המופיע לאחר גיל ההתבגרות. בשונה מתסמונת Marfan לחולים אלו פיגור שכלי. לאחרונה ידוע על שני גנים הקשורים בתסמונת: MED12 ו-UPF3B. ביטוי יתר של הגן NPPC (Natriuretic Peptide Precursor C) מדובר במצב נדיר אשר תואר בחולים בודדים בעולם. הביטוי כולל גדילת יתר לאחר הלידה מעבר לשתי סטיות תקן בגובה, Marfanoid Habitus, סקוליוזיס, אגודלים ארוכים וMetaphyseal-Epiphyseal Dysplasia. הגן מקודד לחלבון שלו תפקיד בבקרה על גדילה של העצמות, ולכן מוטציה בו גורמת לגדילת יתר.
תסמונת CATSHL
תסמונת CATSHL (MIM 610474) מועברת בתורשה אוטוזומלית דומיננטית. התסמונת כוללת קמפטודקטיליה, קומה גבוהה וליקוי שמיעה סנסורינאורלי. נוסף על כך, לחלק מהחולים פיגור שכלי, מיקרוצפליה ושינוי במבנה בית החזה (Pectus Excavatum). הגורם לתסמונת הוא מוטציה בגן FGFR3 באזור הטירוזין קינז של הרצפטור במנגנון Negative Dominant (הסבר לגבי מנגנון זה ראה בפרק הדן בתסמונת Marfan). מעניין לציין כי לגן זה תפקיד ידוע בגדילה של השלד, ומוטציות שונות באלל זה נותנות תמונה קלינית של גמדות או קומה נמוכה.
RNF135
תסמונת זו (MIM 611358) נדירה ותוארה עד כה בשישה חולים. הגן נמצא על כרומוזום 17. לחולים קומה והיקף ראש מעל הנורמה בשתי סטיות תקן. נוסף על כך, סימנים דיסמורפיים הכוללים מצח רחב, קצה אף רחב, פילטרום ארוך, ארובות עיניים Downslanting, שפה עליונה צרה ושפה תחתונה מלאה. לחלק החולים פיגור שכלי, גיל עצמות מתקדם, בעיות שמיעה וראייה. קיימת חפיפה פנוטיפית עם תסמונת Sotos ועם תסמונת Weaver, אולם לא נמצאה מוטציה בגן NSD1 בחולים אלו. תפקיד הגן אינו ידוע.
ישנם בנוסף מצבים הקשורים בענקות ראש (Macrocephaly) כממצא עיקרי ותסמונות הנובעות משינויים כרומוזומליים, כגון: תסמונת קליינפלטר או תסמונת הקשורה בקריוטיפ 47 ,תסמונת ה-X המשולש.
אבחנה
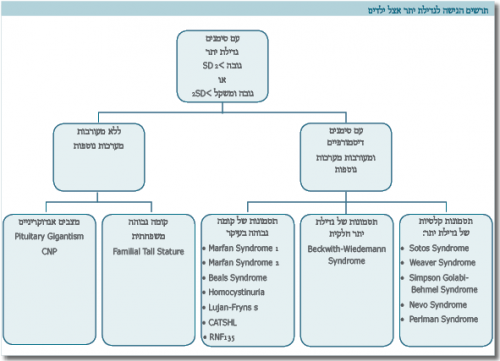
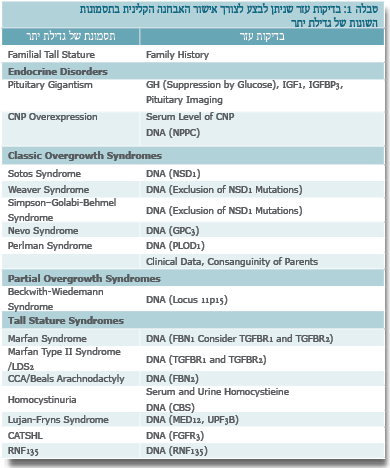
האבחנה ההתחלתית נקבעת על סמך מדידות האורך בעת ההיריון או מדידות הגובה לאחר הלידה. אנחנו מגדירים קומה גבוהה כאשר התוצאה המתקבלת היא מעל 2 סטיות תקן, לגיל, למין ולמוצא האתני. בהיעדר סימנים לשינויים מבניים (Dysmorphic) ומעורבות של מערכות אחרות זולת השלד, יש לשלול תבנית משפחתית. בעת הבדיקה יש למדוד משקל, היקף ראש, לציין סימנים של שינויים מבניים ולבחון מעורבות של מערכות נוספות, כמו: עיניים, לב, טחול, כבד, כליות ומערכת השתן, מערכת העצבים (בעיות התפתחות). כמו כן, יש לשקול ביצוע בירור של המערכת ההורמונלית לשלילת מצבים אנדוקריניים נדירים (טבלה 1).
טיפול
חשוב להדגיש את המעקבים הנדרשים והטיפולים הקיימים במצבים השונים כיום, הדורשים התייחסות של הרופא המטפל וההתייחסות לייעוץ הגנטי בהתאם לאופן ההורשה והמנגנון הגנטי בבסיס המחלות השונות.
פרוגנוזה
דגלים אדומים
ביבליוגרפיה
קישורים חיצוניים
- תסמונות של גדילת יתר, מדיקל מדיה
המידע שבדף זה נכתב על ידי ד"ר חנה וינקלר, ד"ר עמיהוד זינגר


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק