הבדלים בין גרסאות בדף "התגובה לטראומה - Physical trauma"
| שורה 1: | שורה 1: | ||
[[קובץ:כותרתחבלות.jpg|מרכז]] | [[קובץ:כותרתחבלות.jpg|מרכז]] | ||
| + | {{Sub Chapter | ||
| + | |Book=עקרונות בכירורגיה | ||
| + | |Chapter number=16 | ||
| + | |Sub Chapter number=1 | ||
| + | }} | ||
{{ספר| | {{ספר| | ||
|שם הספר= [[עקרונות בכירורגיה]] | |שם הספר= [[עקרונות בכירורגיה]] | ||
| שורה 23: | שורה 28: | ||
==שמירת הנוזל החוץ-תאי== | ==שמירת הנוזל החוץ-תאי== | ||
| − | |||
בעוד שבזמן חבלה יש הרס ואיבוד מסה תאית, מנסה הגוף לשמור את כמות ואיכות הנוזל החוץ-תאי, במיוחד הדגש הוא על הכמות. הניסיון הזה מתבטא בירידה בהפרשת הנתרן לשתן, עקב ספיגתו המוגברת יחד עם יון הביקרבונט, תוך הפרשה של אשלגן ומימן לשתן. לכן השתן חומצי והיפראוסמוטי עם היפוך היחס שבין הנתרן לאשלגן שבו. הפרשת המימן והאשלגן לשתן גורמת לבססת (alkalosis) מטבולית, המאפיינת את השלב ההתחלתי של החבלה. שמירת הנתרן מתבטאת גם בהקטנת תכולתו בזיעה, ברוק וכן בספיגתו המוגברת דרך מערכת העיכול, במיוחד במעי הכרוך ileum)). ספיגה מוגברת של הנתרן בכליות קשורה לספיגה מוגברת של מים, ולכן דרך מנגנון זה הגוף מנסה לשמר את כמות הנוזל. שמירת הנוזלים בגוף מתבטאת בשתן היפראוסמוטי המכיל בעיקר אשלגן, פוספט ואוריאה (תרשים 2.16). | בעוד שבזמן חבלה יש הרס ואיבוד מסה תאית, מנסה הגוף לשמור את כמות ואיכות הנוזל החוץ-תאי, במיוחד הדגש הוא על הכמות. הניסיון הזה מתבטא בירידה בהפרשת הנתרן לשתן, עקב ספיגתו המוגברת יחד עם יון הביקרבונט, תוך הפרשה של אשלגן ומימן לשתן. לכן השתן חומצי והיפראוסמוטי עם היפוך היחס שבין הנתרן לאשלגן שבו. הפרשת המימן והאשלגן לשתן גורמת לבססת (alkalosis) מטבולית, המאפיינת את השלב ההתחלתי של החבלה. שמירת הנתרן מתבטאת גם בהקטנת תכולתו בזיעה, ברוק וכן בספיגתו המוגברת דרך מערכת העיכול, במיוחד במעי הכרוך ileum)). ספיגה מוגברת של הנתרן בכליות קשורה לספיגה מוגברת של מים, ולכן דרך מנגנון זה הגוף מנסה לשמר את כמות הנוזל. שמירת הנוזלים בגוף מתבטאת בשתן היפראוסמוטי המכיל בעיקר אשלגן, פוספט ואוריאה (תרשים 2.16). | ||
גרסה מ־08:16, 30 באוגוסט 2021
עקרונות בכירורגיה
מאת ד"ר צבי קויפמן
| עקרונות בכירורגיה | ||
|---|---|---|
| ||
| שם המחבר | ד"ר צבי קויפמן | |
| שם הפרק | חבלות | |
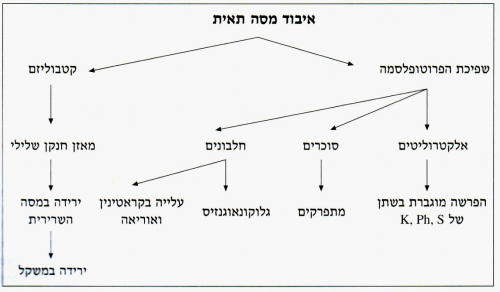
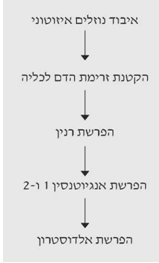
חבלה היא מצב הגורם להרס ולאובדן של מסה תאית מסיבות שונות. איבוד המסה התאית בזמן חבלה והפגיעה בתאים גורמת לשפיכת הפרוטופלזמה למרווח הבין-תאי. המרכיבים השומניים והסוכריים של פרוטופלזמה זו מתחמצנים עד ל-CO2 ומים. המרכיבים החלבוניים מפורקים עד אוריאה ואילו שרשרת הפחמן הנותרת מתפרקת למים + CO2; האוריאה מופרשת דרך הכליות. מרכיבים אלה אינם חוזרים למעגלי הבנייה מחדש של הגוף, כך שאיבוד זה הוא אובליגטורי. הפירוק המוגבר של החלבונים ניתן להדגמה על- ידי עלייה בערכי הקראטינין בדם ובשתן, והקטנת המסה התאית של השרירים. השינוי בולט במיוחד בחולים הנמצאים מחוסר-תנועה או סובלים רעב. בחולים חבולים ניתן למצוא מאזן חנקן שלילי, הפרשת אוריאה מוגברת בשתן, והופעת סוכרים חדשים, שלא ממקורות של סוכרים (גלוקונאוגנזיס מחלבונים). בנוסף להקטנת המסה התאית, הרס התאים גורם לשחרור של אלקטרוליטים תוך-תאיים כמו אשלגן, פוספט וסולפט, לנוזל הבין-תאי. אלקטרוליטים אלה מופרשים אף הם דרך מערכת השתן. קיימות ראיות לכך שאותו מנגנון של איבוד מסה תאית, הקיים בשריר, קיים גם באברים אחרים כמו: מערכת העיכול, כליות, מוח וכבד (תרשים 1.16).
העובדה שאחרי חבלה המסה השרירית חוזרת למשקלה מלפני החבלה, מרמזת על כך שכל שריר נשאר מחובר למערכת העצבית-שרירית שלו ללא קשר לחומרת הפגיעה המטבולית, ולכן עם השיפור המטבולי, השריר יכול לעבור תהליכי בנייה מחדש. אם עקב החבלה נפגע הקשר העצבי-שרירי, השריר יעבור אטרופיה ולא ייבנה מחדש.
חולה טראומה מדרגה בינונית המפסיד כ-30 גרם חנקן מאבד כ-220 גרם חלבון או 1 ק"ג של מסה שרירית, המהווה כ-5% ממשקל הגוף ללא השומן. בנוסף לאיבוד המסה השרירית - חלבון, קיים גם איבוד של המסה השומנית. השומן משמש כמקור להספקת אנרגיה לגוף. האנרגיה משומן מקורה במטבוליטים שלו כמו החומצה הביתא- הידרוקסי-בוטורית והחומצה האצטואצטית.
אין הוכחות כיום שתהליך איבוד המסה התאית משפיע על תהליכי ריפוי הפצע, יצירת המוגלובין, אלבומין או תהליכים אנבוליים אחרים. התהליך הקטבולי הזה מביא בעקבותיו תהליך אנבולי המתבטא בבנייה מחדש של החלקים שנהרסו. האכלת חולים בכוח בשלב הקטבולי, במטרה לשפר את התהליך האנבולי, אינה יעילה ואינה מזרזת את ההחלמה.
שמירת הנוזל החוץ-תאי
בעוד שבזמן חבלה יש הרס ואיבוד מסה תאית, מנסה הגוף לשמור את כמות ואיכות הנוזל החוץ-תאי, במיוחד הדגש הוא על הכמות. הניסיון הזה מתבטא בירידה בהפרשת הנתרן לשתן, עקב ספיגתו המוגברת יחד עם יון הביקרבונט, תוך הפרשה של אשלגן ומימן לשתן. לכן השתן חומצי והיפראוסמוטי עם היפוך היחס שבין הנתרן לאשלגן שבו. הפרשת המימן והאשלגן לשתן גורמת לבססת (alkalosis) מטבולית, המאפיינת את השלב ההתחלתי של החבלה. שמירת הנתרן מתבטאת גם בהקטנת תכולתו בזיעה, ברוק וכן בספיגתו המוגברת דרך מערכת העיכול, במיוחד במעי הכרוך ileum)). ספיגה מוגברת של הנתרן בכליות קשורה לספיגה מוגברת של מים, ולכן דרך מנגנון זה הגוף מנסה לשמר את כמות הנוזל. שמירת הנוזלים בגוף מתבטאת בשתן היפראוסמוטי המכיל בעיקר אשלגן, פוספט ואוריאה (תרשים 2.16).
חולים לאחר חבלה נוטים לאגור נתרן, אולם אם מעמיסים עליהם נתרן הם מפרישים אותו, ממצא המלמד על תפקוד כלייתי תקין. חולים לאחר חבלה נוטים גם לאגור מים, ולכן הם מפתחים היפופרוטאינמיה. ההיפופרוטאינמיה גורמת לירידה בלחץ האונקוטי, וכתוצאה מכך קיימת סכנה של היווצרות בצקות בגפיים, בריאות ובמוח.
מתן של נוזלים בכמות רבה לאחר ניתוחים גורם לשתינה (diuresis) טובה, אולם חלק מהנוזלים נשאר בגוף וגורם ל-dilutional hyponatremia ולהיפופרוטאינמיה. לכן יש להיזהר ממתן נוזלים לחולים אלה. צבירת הנוזלים נובעת גם מהפרשת-יתר של ההורמון האנטידאורטי, עקב החבלה (הרדמה, שוק, איבוד נוזלים וכוי), וכן עקב הפרשת-יתר של אדרנלין ונוראדרנלין, המקטינים את ה-GFR עקב התכווצות כלי הדם בכליה.
שינויים במקורות האנרגיה
מצבי דחק כמו חבלה, אוטם שריר הלב, אלח-דם, ניתוחים וכוי, גורמים להפרשת-יתר של קטכולאמינים, המגבירים את תצרוכת האנרגיה בגוף. ואכן, כאשר מודדים את התצרוכת הקלורית בחולים אלה מוצאים שהיא גבוהה פי 1.5 בחולי דלקת הצפק, או פי 2 בחולים בעלי אלח-דם, כוויות וכו'.
השאלה הנשאלת היא מה הם המקורות לאנרגיה זו באדם שלמעשה אינו אוכל או אינו אוכל מספיק, עקב מצבו? התשובה המתבקשת, בהתאם לידוע לנו ממצבי רעב, היא שהגוף יגביר את השימוש בשומן, על מנת לספק את הדרישות האנרגטיות המוגברות וישתדל לשמר את החנקן. אולם כאשר מבקשים לאמת תיאוריה זו במעבדה, מסתבר שהגוף משתמש דווקא בחלבון כמקור אנרגיה להשלמת תצרוכת האנרגיה המוגברת ופחות בשומן.
עבודות בשנים האחרונות הראו שרמות האינסולין בחולים במצבי חבלה הן אמנם נמוכות, אולם רק בשעות הראשונות. לאחר מכן רמות האינסולין עולות והתגובה תואמת את רמות הגלוקוז בנסיוב. הירידה ברמת האינסולין בנסיוב היא רק חלק קטן מההסבר לתופעה זו. עבודות הראו שתצרוכת החלבון לגלוקונאוגנזיס בכבד גוברת. האינסולין כידוע מעכב את הגלוקונאוגנזיס בכבד ואם רמתו בדם תקינה הרי שתהליך הגלוקונאוגנזיס היה צריך להיות מופחת, אלא אם כן קיימת הפרעה בהשפעת האינסולין ברמה התאית בכבד. ואכן ניתן להראות, בעבודות שונות, שקיימת האצה של התהליך של הגלוקונאוגנזיס למרות רמות גבוהות של אינסולין בחולים אלה. מכאן שאכן קיימת עמידות של תאי הכבד לאינסולין, הגורמת להאצת תהליך הגלוקונאוגנזיס, ומכאן השימוש המוגבר בחלבון בחולים במצבי דחק. השינויים ההורמונליים במצבי דחק, הכוללים עלייה ברמות האדרנלין, הסטרואידים, הגלוקגון ואחרים, והירידה בהשפעת האינסולין, מסיטים את המטבוליזם, שעיקרו מבוסס על ניצול השומנים למטבוליזם המשתמש בחלבונים כמקור אנרגיה יקר. כתוצאה מכך, בחולים במצבי דחק, מאזן החנקן הופך שלילי מאוד.
שינויים במאזן החומצי-בסיסי
חולים לאחר ניתוח או טראומה נוטים לפתח, בתגובה מידית למצב הדחק, בססת נשימתית ומטבולית. הסיבות לכך הן:
- היפאלדוסטרוניזם משני לאיבוד דם או נוזלים.
- שרפת הציטרט והלקטט שהחולה מקבל בעירוי.
- מתן ביקרבונט על-ידי המטפל.
- שאיבת תוכן הקיבה על-ידי זונדה.
- היפרוונטילציה, הנגרמת עקב מצב החרדה בו נתון החולה או השפעות מרכזיות.
כאשר הבססת הזו מחריפה או מתמשכת מתרחשים מספר שינויים, שהחשוב שבהם הוא התזוזה שמאלה של עקומת הדיסוציאציה של האוקסי-המוגלובין, אשר קושר חזק יותר את החמצן להמוגלובין ולא משחררו ברקמות. מסיבה זו הדם הוורידי מכיל כמות חמצן רבה יותר מהמקובל אצל בריאים, ולפעמים אפשר לטעות ולחשוב שמדובר בדלף עורקי-ורידי מוגבר. ירידה זו בחמצון התאים גורמת לאיסכמיה רקמתית, הגורמת ליצירת חומצה לקטית עקב המטבוליזם האנארובי, הגוברת ברקמות איסכמיות. תהליך זה גורם לחמצת (acidosis) רקמתית. החומצה הלקטית הזו, המצטברת בתאים, יוצאת מתוכם ומנוטרלת בחלקה בנוזל החוץ-תאי. אם כושר הנטרול הזה הוא קטן ביחס לכמות החומצה הלקטית הנוצרת, מופיעה חמצת מטבולית סיסטמית, המתבטאת בירידה בערכי הסטנדרט ביקרבונט וה-B.E. החומצה הלקטית נוצרת גם כתוצאה מהיפרוונטילציה, המתפתחת בחולים אלה, אולם כמותה היא קטנה יחסית. המצב מוחמר בחולים סוכרתיים, שעקב עמידותם בפני אינסולין הם אינם מסוגלים לנצל את הגלוקוז, עוברים למטבוליזם של שומנים ומפתחים בנוסף גם קטו-אצידוזיס (תרשים 3.16).
שינויים בתפוקת הלב
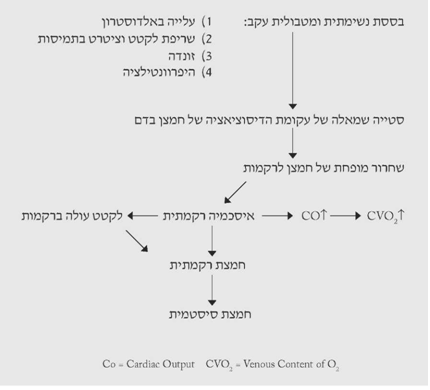
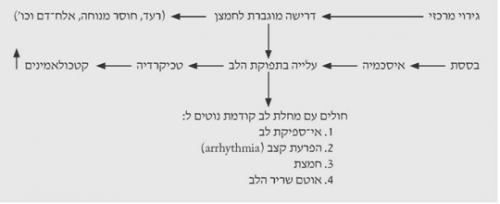
בחולים לאחר חבלה קיימת עלייה בתפוקת הלב, הנובעת מהפרשת- יתר של קטכולאמינים, דרישה מוגברת לחמצן על-ידי הרקמות החבולות או עקב שינויים סיסטמיים כמו: רעד וחוסר מנוחה, הנגרמים על-ידי גירויים מרכזיים. הבססת גורמת לאיסכמיה רקמתית, וזו מגרה את המרכזים במוח, האחראים על ויסות תפוקת הלב. גירוי המרכזים הללו מגביר את תפוקת הלב. באנשים צעירים עיקר הגירוי הוא מרכזי ונובע מאספקת חמצן לקויה למוח (תרשים 4.16).
הדרישה לתפוקת לב מוגברת נסבלת היטב על-ידי אנשים שהיו בריאים לפני המאורע החבלתי. בחולי לב שהיו במצב מאוזן, לפני החבלה, המאורע החבלתי מגביר את תפוקת הלב ומגביר את תצרוכת החמצן בלב, שלא בהתאם ליכולת הלב, ולכן גורם לאיסכמיה לבבית יחסית, היכולה לגרום להפרעות קצב, לאי-ספיקת לב חדה ולחמצת. כתוצאה מכל השינויים הללו - חולים אלה נוטים לפתח אוטם שריר הלב בקלות יחסית. חולים כאלה חייבים להימצא במעקב רפואי מתמיד עם ניטור קבוע, מכיוון שברגע שמצבם מתחיל להתדרדר, עקב עבודת הלב המוגברת, ההידרדרות היא מהירה.
שינויים בתפקוד הכליות
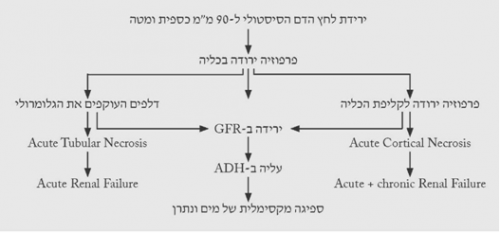
כתוצאה מאיבוד הנוזלים עקב החבלה, הבעיה העיקרית המתעוררת, מבחינה כלייתית, היא הפרפוזיה הלקויה לכליה והירידה בקצב סינון הפקעית (GFR - glomerular filtration rate) כתוצאה מכך. הירידה ב-GFR גורמת לעלייה בספיגת המים והנתרן בכליות, כתוצאה מהפרשה מוגברת של אלדוסטרון ו-ADH. כאשר ה-GFR יורד ל-20 ומטה, הנפרונים נחשפים לנזק על-ידי חומרים טוקסיים שונים כמו: תרופות, פורפרינים ואחרים. מכאן החשיבות הרבה לשמור על הידרציה טובה ופרפוזיה של הכליות.
הנזק הראשוני לכליה, עקב ירידה בפרפוזיה, הוא prerenal atzotemia, המתבטאת בעלייה באוריאה ללא עלייה מקבילה בקראטינין. השתן מרוכז מאוד וקיים היפוך יחס בין הנתרן לאשלגן. מצב זה מצביע על תגובה כלייתית תקינה להיפוולמיה, אולם אם המצב נמשך, השינויים האיסכמיים בכליה גורמים נזק לאבובית (tubulus), עקב שקיעת משקעים ו-debris בתוכה, וזאת בנוסף לנזק האיסכמי לרקמה הפונקציונלית. במקרים אלה הפגיעה מתבטאת באי-ספיקה כלייתית חריפה עם עלייה בקראטינין, ירידה ב-GFR וירידה בתפוקת השתן. המעבר הזה מתרחש באנשים שונים בתקופות זמן שונות. חולים עם סיפור רקע של מחלה כלייתית קודמת, או מחלה ארטריוסקלרוטית מפושטת, הם בעלי רזרבות פונקציונליות נמוכות, ולכן הם יעברו מהשלב הקדם-כלייתי לכלייתי מהר יותר, ולפעמים מבלי שניתן אפילו לזהות את השלב הקדם-כלייתי. במצבי אלח-דם, עקב הטוקסינים המשתחררים, הנזק הכלייתי יכול להיות חמור ביותר ולהסתיים ב-cortical necrosis הגורם לאי-ספיקה כלייתית חדה, שבמרבית המקרים אינה הפיכה (תרשים 5.16).
שינויים במערכת העיכול
השינויים במערכת העיכול, בחולים שלא נפגעו במערכת העיכול, מתבטאים בהפרעות בספיגת המזון ולפעמים בפריסטלטיקה ירודה. בחולים בעלי המטומה אחור-צפקית ניתן למצוא הפרעות בניע המעי עד אילאוס אדינמי. כתוצאה מכך האכלת חולה לאחר טראומה עלולה לגרום לאי-נוחות בטנית, להרמת הסרעפת, לכאבי בטן, להקאות ולסכנת שיאוף. מובן שבמצב בו יש גם חבלה בטנית עם פגיעה במערכת העיכול, המצב חמור יותר.
בחולים לאחר השלב החריף של החבלה, למרות שלא קיימת פגיעה בכושר הספיגה של המעי - שטח הספיגה משתנה עקב אספקת חמצן לקויה למעי, ולכן החולה אינו מסוגל, בטווח הקצר, לטפל במזון כמו לפני החבלה. מסיבה זו רצוי לתת לחולה דיאטה קלה.
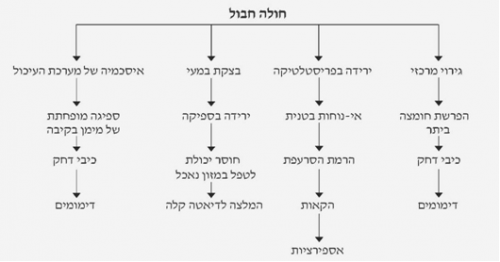
אחד מהסיבוכים המסוכנים לאחר חבלה הוא הופעת כיבי דחק (stress ulcer). כיבים אלה יכולים להיווצר במנגנונים שונים. הכיבים בחולים היפוולמיים נובעים מאספקת חמצן לקויה לרקמת הקיבה הגורמת לפגיעה בתהליך החמצון בתאים, ולהפרעה במנגנוני ההגנה של רירית הקיבה (פחות יצירת ריר ופגיעה ב-back diffusion של המימן). פגיעה זו גורמת לחשיפת הרירית לחומצה ולפפסין ולהיווצרות כיבים חריפים. מנגנון אחר המאפיין חולים בעלי חבלה מוחית היא הפרשה מוגברת של חומצה עקב גירוי מתמיד של הואגוס. דימומים אלה מופיעים כשבוע-שבועיים לאחר החבלה. בחולים בעלי כיב קודם ניתן לראות התלקחות של הכיב ודימומים. רוב החולים הללו מגיבים לטיפול שמרני, אולם חלקם (10%) יזדקקו לניתוח על מנת לעצור את הדימום (תרשים 6.16).
שינויים בריאות
קיימות השפעות שונות ורבות על הריאות בטראומה. השינויים יכולים להיות תוצאה של:
- פגיעה בדרכי הנשימה, כמו בשיאוף של חומרים, שאיפת עשן, הרעלת חמצן ועוד.
- הפרעות בזרימת הדם - עקב בצקת ריאות, בעקבות מתן עודף נוזלים, תסחיפים בריאות, עקב מתן מנות דם מרובות, זיהומים, ועוד.
- חבלה ישירה בריאות מלווה בחזה-אוויר, בחזה-דם, במחלת דקומפרסיה ועוד.
כל הגורמים האלה מתבטאים בסופו של דבר בתסמונת משותפת הנקראת תסמונת המצוקה הנשימתית של המבוגר -ARDS (respiratory distress syndrome (adult.
הסיבות השכיחות להופעת ה-ARDS הן:
- שיאופים.
- הרעלת חמצן.
- הפרעות בזרימת הדם.
- תסחיפים מרובים - קרישים, שומן, ועוד.
- הפרשת קינינים וקטכולאמינים.
- חבלה בחזה.
- שיינת הדם (uremia).
- תרופות.
עישון ומחלות ריאה כרוניות קודמות מזרזות את הופעת התסמונת הזו בחולים שנחבלו.
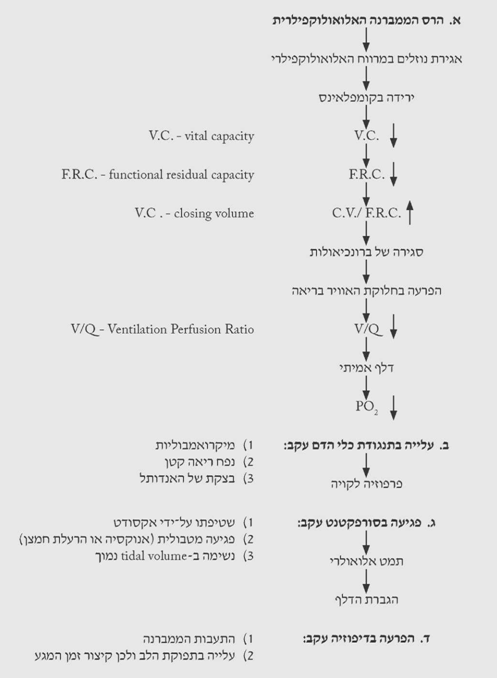
כל הגורמים האלה יכולים לגרום נזק לממברנה האלואולוקפילרית בצד האלואולרי או הקפילרי. הנזק לממברנה האלואולוקפילרית מתחיל בשפעול של הקומפלמנט ובהצטברות של ניטרופילים במיקרוצירקולציה של הריאות. הצטברות זו גורמת לליקוסטזיס פולמונרית, וזו, בשילוב עם שפעול הקומפלמנט גורמת לשחרור של סופראוקסידים, hydroxyl anion, פראוקסיד ואנזימים ליזוזומליים, הגורמים נזק לאנדותליום בממברנה האלואולוקפילרית והרס של ה-microvascular endothelial barrier. הפרשת ה-Leukotrienes, שהוא פרוסטגלנדין המופרש על-ידי הליקוציטים, מגבירה את חדירות הממברנה האלואולוקפלרית ומחמירה לכן את התסמונת. לפרוסטגלנדין זה יש גם השפעה כימוטקטית, המגבירה את אגירת הנירופילים והליקוסטזיס. היסטמין וחומרים וזו-אקטיביים אחרים המופרשים ביתר בזמן החבלה גורמים להצטברות של טסיות במיקרוצירקולציה הריאתית, ומגבירים את לחץ הדם במערכת הריאתית. עלייה זו גורמת לעליית הלחץ ההידרוסטטי במקרוצירקולציה הריאתית, ולבריחת נוזלים למרווח הבין-רקמתי (interstitium) של הריאות.
התוצאה המשותפת לפעילות זו היא הרס הממברנה האלואולוקפילרית, הגורמת למספר שינויים בריאות, המופיעים בתרשים 7.16. כתוצאה משינויים אלה נגרמים:
- עלייה במתח הפנים בבועיות הריאתיות.
- עלייה בעבודת הנשימה.
- חמצת מטבולית.
- ירידה בלחץ החלקי של החמצן.
תסמונת המצוקה הנשימתית של המבוגר (ARDS) תוארה לראשונה על-ידי Ashbaugh וחבריו לפני יותר מ-20 שנה. כיום, מהווה תסמונת זו סיבה שכיחה לאי-ספיקה נשימתית חדה במחלקות לטיפול נמרץ, כאשר התמונה הקלינית המוכרת מופיעה בעקבות מגוון רחב של מצבים ומחלות הגורמים נזק לרקמת הריאה. בעקבות הנזק הריאתי, חל תהליך דלקתי ניכר תוך פגיעה מפושטת בתאי הריאה, והופעת בצקת בועיתית ובינתאית. התסמונת הקלינית מאופיינת על-ידי נשמת, היפוקסמיה, תסנינים ריאתיים מפושטים הנראים בצילום בית החזה, וירידה בהענות הריאתית. שיעור התמותה מ-SDRA גבוה מאוד גם כיום, ונע בין 20% ל-80% (בהתאם לחומרת המחלה), כאשר ברוב העבודות שיעור התמותה הוא יותר מ-50%. מספרים אלה מסבירים את המחקר הרב המושקע בהבנת התהליכים הפתופיזיולוגיים המתרחשים, ואת הפתוגנזה ברמה התאית.
בעבודות שונות תוארה המעורבות של הכדוריות האדומות, האאוזינופילים, טסיות הדם והניטרופילים ב- ARDS.
כדוריות אדומות
בין שאר מאפייני התמונה הפתולוגית של ARDS, בולטת הצטברות כדוריות אדומות בחללים הבועיתיים וברווחים הבינתאיים בריאות הפגועות של חולים הלוקים ב- ARDS, וגם בריאות של חיות, בדגמים ניסויים למיניהם. בנוסף הובחן, כי כדוריות אדומות נמצאות לרוב בקרבה לניטרופילים ולתאי אנדותל פגועים בנימיות הריאתיות. תצפיות אלו העלו את השאלה, האם אמנם משתתפות הכדוריות האדומות בפתוגנזה של ARDS?
רדיקאלים חופשיים של חמצן הם קבוצה כימית בלתי יציבה, בעלת רעילות גבוהה ביותר. תוצרים אלה יכולים לגרום נזק לקרומים תאיים על-ידי חמצון שומנים, וכמו-כן יכולים לפרק חומצה היאלורונית במרווח הבינתאי - ולכן, ייצור-יתר של ראדיקלים חופשיים של חמצן בעת תגובה דלקתית יכול לפגוע בקרום הנימי-בועיתי. כפי שיוסבר בהמשך, ב- ARDS מצטברים ליקוציטים פעילים בכלי הדם הריאתיים. בתהליך חילוף החומרים המואץ של תאי הדלקת המשופעלים, נודדים הליקוציטים דרך תאי האנדותל ומשחררים כמות גדולה של רדיקאלים חופשיים. הרדיקאלים הללו, תוך חמצון שומנים ושחרור הידרופראוקסידים, גורמים להרס השטח האנדותלי, לעלייה בחדירות כלי הדם הריאתיים, ולבצקת ריאות.
כדוריות אדומות מכילות כמויות גדולות של תססים נוגדי חמצון, המפחיתים את ריכוז תוצרי פירוק החמצן. הכדוריות האדומות משמשות "מפנים" (scavengers) של תוצרי חמצון, וכך, עקב ירידה בריכוז תוצרים אלה פוחתת הבצקת הריאתית.
תצפיות מחקריות מעלות קשר אפשרי בין כדוריות אדומות לפתוגנזה של ARDS. קיימת השערה כי חולים בעלי רמות ירודות של תססים נוגדי חמצון בכדוריות יפתחו ARDS, כאשר שינויים ברמות התססים (גלותטיון וקטלזה) יהוו סימן רגישות לנזק חמצוני, ומדד חיזוי להופעת ARDS.
אאוזינופילים
כפי שיוסבר בהמשך, המחקר לגבי תפקיד הגראנולוציטים ב- ARDS התמקד בעיקר בנושא הניטרופילים. בשנים האחרונות פורסמו מספר עבודות המרמזות כי גם לאאוזינופילים תפקיד אטיופתוגנטי בתסמונת. התברר, כי בחולים הלוקים ב-ARDS נמצאו רמות חלבון אאוזינופילי גבוהות. הועלתה השערה, כי החלבון מופרש מאאוזינופילים הלכודים ברקמת הריאה. נמצא מתאם בין רמות גבוהות של חלבון אאוזינופיל בנוזל השטיפה, לבין ARDS חמורה יותר (הפרעת חמצון קשה יותר). כמו-כן נמצא מתאם בין רמות חלבון האאוזינופיל לפעילות המיאלופראוקסידאזה (סימן לשפעול ניטרופילים) בנוזל השטיפה הריאתי של חולי ARDS, שמרמז על משפעל משותף לניטרופילים ולאאוזינופילים.
עדיין לא ברור תפקידם של האאוזינופילים בתהליך הדלקתי, אך נמצא כי הם יכולים לשחרר מספר חומרים בעלי ציטוטוקסיות גבוהה, ביניהם חלבון בסיסי עיקרי (major basic protein) ופראוקסידאזה אאוזינופילית. נמצא שחלבון בסיסי עיקרי יכול לגרום נזק ציטוטוקסי ריאתי.
טסיות דם
ביותר מ-50% מהחולים הלוקים ב-ARDS נצפית תרומבוציטופניה; לטסיות בחולים אלו משך חיים קצר וקצב מיחזור גבוה. לפחות חלק מהירידה במספר הטסיות מוסבר על-ידי הצטברותן ברקמת הריאה (וברקמת הטחול והכבד). קיימת עדות נוספת לאגירת טסיות ברקמת הריאה, והיא כי ב-50% מהחולים בתחילת מהלך ה-ARDS נראו פגמי מילוי בעורקי הריאה באנגיוגראפיה, כאשר בבדיקות מיקרוסקופיות של רקמת ריאה מביופסיה "פתוחה" ומנתיחה לאחר המוות, נמצא כי קרישים אלה נוצרים על-ידי טסיות, פיברין וניטרופילים. התרומבוציטופניה מקבילה למהלך הירידה בחמצון הדם בחיות ובבני אדם.
אגירת טסיות בתחילת התסמונת הקלינית אכן תורמת לבצקת ריאות ולנזק אנדותלי מקומי, אך כנראה לא כגורם יחיד או עיקרי. תגובות טסיות עם תאים אחרים יכולות גם הן להשפיע על התהליך הפתופיזיולוגי.
- ייתכן, שטסיות מחמירות את הנזק הריאתי הנגרם על-ידי ניטרופילים, על-ידי שחרור חומרים המגבירים כימוטקסיס, הידבקות, אגירה וזריעה של ניטרופילים. עם החומרים הללו נמנים תרומבוקסן A2, חומצה אראכידונית, סרוטונין ואחרים.
- מתברר, כי תאי אנדותל אינם מהווים רק מטרה סבילה לפגעי התאים ב- ARDS , אלא משתתפים באופן פעיל בתהליך התהוות הנזק הריאתי. תאי האנדותל מסוגלים לייצר תרומבוקסן A2 וגורם משפעל טסיות (platelet activating factor), המגבירים את ריכוז הטסיות במקום בו נגרם הנזק האנדותלי, וגם את ריכוז גורם ואן-וילבראנד, המשתתף בהצמדת טסיות לקרומים אנדותליים פגועים.
- גורם גדילה ממקור טסיות (platelet derived growth factor) מהווה גורם חשוב להתהוות גירוי לשגשוג תאים באזורים עם אספקת דם לקויה. הועלתה השערה, כי לייפת ריאתית נרחבת, השלב הפתולוגי האחרון ב- ARDS, נובעת משחרור מוגבר של גורם גדילה זה.
יתר-לחץ-דם ריאתי
בין הממצאים ההמודינמיים השכיחים הקיימים ב- ARDS, מתוארת עלייה בתנגודת כלי דם ריאתיים ובעקבותיה יתר-לחץ-דם ריאתי, בשעות הראשונות לאי-הספיקה הנשימתית. העלייה בתנגודת כלי הדם מתבצעת בשני שלבים: בשלב המוקדם, מופיע יתר-לחץ-דם ריאתי קל, הנובע מאגירת טסיות וניטרופילים ומשחרור חומרים וזואקטיביים, תופעה הניתנת לטיפול על-ידי מרחיבי כלי דם. השלב המאוחר המתמשך של יתר-לחץ-דם ריאתי שאינו מגיב לטיפול, נובע מהשינויים האנטומיים שחלו בינתיים ברקמת הריאה. לטסיות הדם מערכת ציקלואוקסגנאזה מפותחת, שיכולה להפוך חומצה אראכידונית לתרומבוקסן A2. חומר זה גורם לאגירת טסיות (וכך תורם למשוב חיובי) ופעיל גם בכיווץ כלי דם ריאתיים ובדיכוי תפקוד שריר הלב. למרות שהוכח, כי הטסיות הן המקור החשוב לתרומבוקסן ,A2 ב- ARDS מצויים תאים אחרים (ניטרופילים, מאקרופאגים, בועתיים ותאי אנדותל), המסוגלים להפריש חומר זה.
חומר אחר המופרש מהטסיות ותורם אף הוא לתגובה של יתר-לחץ- דם ריאתי (בשלב המוקדם) הוא הסרוטונין, הידוע כמכווץ כלי דם. בחולים הלוקים ב- ARDS נמצא מתאם חיובי בין עלייה בריכוז הסרוטונין ללחצים ריאתיים מוגברים. אף בחיות, במספר דגמים ניסויים גרם טיפול בקנטאסרין, מעכב סרוטונין, לירידה בלחצים בכלי הדם הריאתיים, שאירעו כנראה כתוצאה מעיכוב סרוטונין שהופרש מהטסיות.
ליתר-לחץ-הדם הריאתי והעלייה בתנגודת המופיעים ב- ARDS, תפקיד חשוב בפתופיזיולוגיה של אי הספיקה הנשימתית. כיווץ כלי הדם מחמיר את יחס האוורור/זילוח הגרוע, ואת ההיפוקסמיה הנוצרת. בנוסף, עליית הלחצים האלה, בנוכחות פגיעה בקרום הנימי- בועיתי, תורמת להיווצרות בצקת ריאות (לפי חוק סטרלינג).
ניטרופילים
עבודות מחקר מרובות מצביעות על שפעול ניטרופילים על-ידי משלים כמנגנון חשוב, אם לא עיקרי, בתהליך התהוות הנזק הריאתי ב-ARDS.
תיאוריית המשלים-ניטרופילים גורסת, כי ניטרופילים משופעלים המתרכזים בתוך כלי הדם הריאתיים, גורמים נזק לתאי האנדותל המצפים את כלי הדם. הובחנה עלייה במספר הניטרופילים, וגם בריכוז האלסטאזה והקולגנאזה מתאים אלה. מספר הגראנולוציטים וגם רמת המיאלופראוקסידאזה (סימן לשפעול ניטרופילים) בנוזל השטיפה הריאתי נמצאו במתאם הפוך (באופן משמעותי) למדד החמצון (לחץ החמצן בדם עורקי מחולק באחוז החמצן באוויר הנשאף).
מרכיבי המשלים ידועים כבעלי יכולת אגירה ומשיכה של ניטרופילים בתנאי מעבדה. עירוי משלים משופעל לחיות גרם להצטברות ניטרופילים בכלי הדם הריאתיים, ולפרע-תפקוד ריאתי. נמצאה עלייה ברמת C3 משופעל, וכן עדות לקישור של C5a לקולטנים על ניטרופילים. כמו-כן נמצא מתאם משמעותי בין רמות C3a לחדירות הקרומית. חסר ב- C5a, או טיפול בנוגדנים מסוג אנטי-C5a מנעו חלקית לפחות התהוות ARDS בדגמים ניסויים.
בבדיקה מיקרוסקופית של רקמת ריאה מחיות עם נזק ריאתי חד, הובחנה צבירה של ניטרופילים בכלי הדם הריאתיים הקטנים.
גראנולוציטים משופעלים יכולים לגרום נזק ריאתי על-ידי מספר מנגנונים:
- שחרור פרוטאזות המשפעלות את גורם הגמאן, משלים, פלסמינוגן וחלבונים אחרים. הנזק מפרוטאזות הוא כפול אפוא: נזק אנדותלי ישיר והגברה עקיפה דרך שפעול מנגנונים נוספים.
- שחרור תוצרי פירוק חומצה אראכידונית, ביניהם גורם משפעל טסיות, פרוסטגלנדינים, תרומבוקסנים וליקוטרינים.
- שחרור רדיקאלים חופשיים של חמצן.
- הפרעה בקרישה עקב שפעול בו-זמני של תהליך הקרישה ופירוק הקריש (שפעול גורם הגמאן).
הופעת ARDS בחולים ניטרופניים, ובחולים אחרים בעיצומה של ניטרופניה קשה, תומכת בהשערה, כי נוכחות ניטרופילים ותוצריהם אינה חיונית להיווצרות הנזק הריאתי, וייתכן שבחולים אלה המנגנון הפתוגנטי שונה ומערב משלים בלבד או גורמים אחרים.
גורם נמק השאת בתסמונת המצוקה הנשימתית - Tumor Necrosis Factor - TNF
אחד הסיבוכים הקשים ביותר של מצבי אלח-דם והלם זיהומי הוא הכשל הרב-מערכתי (multiple system organ failure). לאחר שהחולה מתחיל לכאורה להתייצב מבחינה המודינמית ולהגיב לטיפול באלח-דם, מתפתחת תסמונת הכוללת אי-ספיקה מתקדמת של מערכות אברים חיוניות, המבשרת ברוב המקרים את מותו הקרב של החולה. משוער, כי כשל רב-מערכתי נובע מתהליך דלקתי ממאיר היוצא מכלל פיקוח, המתרחש בתוך כלי הדם. מתווכי הדלקת וגורמי הפגיעה הרקמתית הם חומרים שונים המשתחררים בעקבות התהליך הזיהומי.
ברוב הסדרות הקליניות, האבר הראשון שבו מתרחשים הפגיעה הרקמתית והכשל התפקודי בתסמונת הכשל הרב-מערכתי, הוא הריאה. הפגיעה האילחית בריאה מתבטאת בתחילה בעלייה בחדירות של הנימיות הריאתיות, ומתפתחת בהדרגה לצורתה הקלינית המוכרת כתסמונת המצוקה הנשימתית של המבוגר. ייתכן, שהכישלון הריאתי הוא המפתח לכישלון שאר מערכות האברים, שכן התהליך הדלקתי וההרס הרקמתי בריאה מהווים מקור עשיר של מתווכים דלקתיים המשתחררים למחזור הדם. מובנת אפוא החשיבות המיוחסת להגדרתם של המנגנונים המעורבים בפגיעה ריאתית ממקור אילחי. הגורם השכיח ביותר כיום לתסמונת המצוקה הנשימתית של המבוגר הוא אלח-הדם. שיעור התמותה מתסמונת זו, של בצקת ריאות לא- קארדיוגנית, גבוה מאוד, ונע בסדרות שונות בין 60% ל-90%.
על-ידי מתן קאכקטין (TNF) לחיות ניסוי ניתן לחקות את ההפרעות הקרדיוואסקולריות, הדלקתיות, ההמטולוגיות והמטבוליות, המתרחשות לאחר מתן אנדוטוקסין. בחיות ניסוי גורם TNF לירידה בלחץ הדם, לירידה בתפוקת הלב וליציאת נוזלים מתוך כלי הדם אל החללים הבינתאיים. כמו-כן מופיע כשל תפקודי של מערכות אברים, הכולל אי-ספיקה כלייתית חדה, נמק דמי של המעי ובצקת ריאות, תמונה הזהה להלם אנדוטוקסי מתקדם בחיות אלו. הוכח, כי גם בבני אדם מהווה TNF מתווך ביניים עיקרי שבאמצעותו גורם האנדוטוקסין מחיידקים גרם-שליליים להשפעות הרסניות ידועות.
הזרקה לעכברים של TNF הומאני שיוצר בשיטה של הנדסה גנטית, יחד עם אלבומין שסומן רדיואקטיבית, גרמה לעלייה ניכרת בכמות האלבומין המסומן שהופיע בנוזל השטיפה הריאתית. לא נמדדה כל עלייה ראויה לציון בלחצים בעורק הריאה, ולכן את הופעת החלבון ייחסו החוקרים לעלייה בחדירות הקרום הבועיתי-נימי. קיים קשר הדוק בין ניטרופילים לבין גורם נמק השאת בפתוגנזה של מצוקה נשימתית, ולכן לא יופיע נזק ריאתי כתוצאה מהזרקת קאכקטין לחיות ניטרופניות.
הועלו מספר השערות לגבי מנגנונים, שבאמצעותם יכול ה-TNF לגרום לפגיעה ריאתית בעת אלח-דם. קאכקטין מקדם את הצמדתו של הניטרופיל לתאי אנדותל, יוצר סידור מחדש של שכבות תאי האנדותל (תוך חשיפת קרום הבסיס), ומגביר את ביטוין של תכונות מקדמי הקרישה (procoagulant) של תאי האנדותל - כל אלה מהווים חלק מהתהליך הדלקתי בבועיות הריאה, המתרחש בתחילת היווצרותה של תסמונת המצוקה הנשימתית. TNF גם גורם לעלייה בריכוזם של מספר מתווכי דלקת, המוכרים אף הם כמשתתפים בתהליך יצירת הנזק הריאתי, ביניהם אינטרליקין- 1 , פרוסטגלנדינים ורדיקאלים חופשיים של חמצן.
לחלק מהעבודות, שנערכו כדי לברר את חשיבותו של הקאכקטין בהלם זיהומי, גם משמעות טיפולית חשובה ביותר, לפחות מבחינה תיאורטית. עכברים שחוסנו באורח סביל נגד TNF, נמצאו עמידים יותר בצורה משמעותית נגד השפעות קטלניות של אנדוטוקסין, יחסית לקבוצת בקרה. טיפול מונע בקופים על-ידי נוגדנים חד-שיבטיים נגד TNF שעתיים לפני חשיפתם לחיידקי א' קולי במינון LD100, מנע הופעת הלם צירקולטורי, כשל מערכות חיוניות ותמותה, לעומת הקופים בקבוצת בקרה. לאחרונה נמצא גם בארנבות, כי נוגדן נגד TNF מנע תת-לחץ-דם ושקיעת פיברין בריאה ואף הפחית את שיעור התמותה בדגם ניסויי של הלם זיהומי קטלני.
אבחנה
מבחינה קלינית החולה נמצא במצוקה נשימתית שגוברת והולכת. החולה טכיפנאי עד רעב לאוויר. החולה משתמש בשרירי העזר לנשימה, הוא ציאנוטי, מבולבל ומצוי באי-שקט פסיכומוטורי, הנובע מאנוקסיה מוחית. ערכי ה-PO2 בדם העורקי יורדים ובמקביל ערכי ה-PCO2 יורדים. כאשר ערכי ה-PCO2 מתחילים לעלות, הרי מצבו של החולה מחמיר מאוד. ממצא זה מהווה סימן פרוגנוסטי גרוע מאוד. כאשר מעלים את ה-FiO2 עד 1 (100%), השיפור PO2o הוא קטן יחסית עקב הדלף הגדול. אחד המדדים הרגישים ביותר להתפתחות ה-ARDS הוא ה-A-a)DO2) ההולך וגדל ככל ה-ARDS מחמירה והולכת. ה-A-a)DO2) משתנה בצורה בולטת לפני הופעת ביטוי קליני של ARDS. ערך זה יכול לשמש מדד המנבא הופעת התסמונת. ה- Qs/Qt, שהוא מדד של הדלף הריאתי, עולה והולך ככל שמצב החולה מוחמר. ה-pH בדרך כלל בסיסי ומבטא בססת נשימתית ומטבולית. כאשר המחלה מחמירה ה-pH יורד, והחולה מפתח חמצת מטבולית. ה-pH היורד משמש כמדד טוב להחמרת ב-ARDS.
בצילום חזה, כעבור 24 שעות, ניתן לראות ריאה לבנה בצורת פתיתי שלג, המעידה על חדירת נוזלים לממברנה האלואולוקפילרית ולבועיות הריאה. מאחר שחלק מהבועיות מלאות נוזל בעוד שחלק אחר של הבועיות מלאות אוויר - נוצר מראה של נקודות כהות העטופות בטבעות לבנות.
טיפול
הטיפול בחולים אלה הוא:
- טיפול בגורם ל-ARDS.
- הנשמה בלחץ חיובי, סוף אקספירטורי (PEEP) גבוה.
- תמיכה קרדיווסקולרית.
שינויים במוח
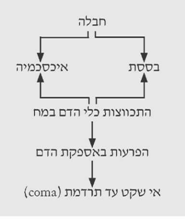
בחולים לאחר חבלה מופיעים בססת והיפוקרביה הגורמים להתכווצות כלי הדם במוח ולהפרעות באספקת הדם למוח. בחולים זקנים, שאספקת הדם אצלם היא גבולית, הפרעה זו גורמת להופעת הזיות, לחוסר שקט ולתרדמת (תרשים 8.16).
תגובה אנדוקרינית
ההיוותרות בחיים לאחר חבלה תלויה באופן מוחלט בתגובה ההגנתית של הגוף וביכולת הגוף להתאים את עצמו למצב החדש שנוצר. מנגנון ההגנה הראשוני מנסה לייצב את המערכת ההמודינמית בזמן היפוולמיה. מספר מנגנונים משתתפים בתהליך זה:
- הגירוי הראשוני מועבר דרך המערכת העצבית הסימפטטית ודרך הברורצפטורים, וגורם להפרשת-יתר של קטכולאמינים, וזופרסין ואנגיוטנסין. כתוצאה מגירוי זה חולים הלוקים בהיפוולמיה יפתחו וזוקונסטריקציה פריפרית מפצה. וזוקונסטריקציה זו גוברת ככל שרמות האנגיוטנסין 2, הוזופרסין והקטכולאמינים בנסיוב גבוהות יותר.
- מנגנון מפצה אחר, המופעל בתגובה לחבלה, הוא הגברת קצב הלב המגביר את תפוקת הלב. מנגנון זה משופעל על-ידי העלייה ברמות האפינפרין והגלוקגון.
- העלייה באוסמולליות הנוזל החוץ-תאי גורמת למשיכת נוזלים מהתאים למערכת החוץ-תאית, והיא מושפעת על-ידי הקורטיזול, הגלוקוגן והורמון הגדילה.
- ספיגת-יתר של נוזלים ונתרן בכליה, בהשפעת הוזופרסין והאלדוסטרון, משמרת גם היא את נפח הדם.
- על מנת לספק אנרגיה חיונית למערכות השונות, הגוף משפעל תהליכים אנבוליים ומקריב את החלבונים, לשם יצירת גלוקוז כמקור אנרגיה זמין, על-ידי גלוקונאוגנזיס, גליקוליזה וליפוליזה. כל זה יכול להתבצע רק אם תהיה הפרשת-יתר של הורמונים החיוניים לביצוע שינויים אלה.
שינויים בהפרשת הקטכולאמינים
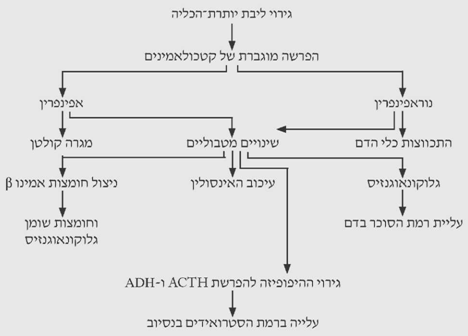
הפרשת האפינפרין מליבת יותרת-הכליה גוברת לאחר חבלה. האפינפרין הוא אב-טיפוס של מגרה קולטן p הגורם לשינויים מטבוליים, כמו הגברת הגלוקוגנזיס בכבד, עלייה ברמת הסוכר בדם, עיכוב ביצירת האינסולין והשפעתו על אבר המטרה, וניצול רב יותר של חומצות אמינו וחומצות שומן. האפינפרין הינו וזוקונסטריקטור חלש ווזודאילטטור בינוני. הנוראפינפרין, לעומת זאת, משפיע בעיקר על כלי הדם וגורם להתכווצותם (תרשים 9.16).
העלייה בהפרשת הקטכולאמינים בזמן חבלה היא קצרה יחסית, אולם גורמת לגירוי ההיפופיזה, וכתוצאה מכך מופרשים ה-ACTH וההורמון האנטי-דיאורטי. הפרשת-יתר של ACTH גורמת להפרשת- יתר של סטרואידים. ככל שמצב החבלה ממושך יותר, כך הפרשת הקטכולאמינים תהיה ממושכת יותר, וכתוצאה מכך ההפרעות המטבוליות תהיינה קשות יותר.
שינויים בהפרשת הסטרואידים
קיימת עלייה ברורה בהפרשת הגלוקוקורטיקואידים בחולים לאחר חבלה. העלייה היא בעיקר של ה-17 הידרוקסי-קורטיקוסטרואידים. עלייה זו מלווה בדרך כלל בהרס מוגבר של הגלוקוקורטיקוסטרואידים בכבד, ובהפרשה מוגברת של תוצרי הפירוק בשתן. ברוב החולים, שבהם החבלה אינה יוצרת חוסר שיווי משקל ביולוגי קשה, רמת הסטרואידים עולה לזמן קצר בלבד, ויורדת לאחר מספר שעות או מספר מועט של ימים. בחבלות קשות, רמות הסטרואידים יכולות להישאר גבוהות במשך שבועות. נדיר לראות חולים ללא עלייה ברמת הסטרואידים לאחר חבלה. חולים אלה סובלים בדרך כלל מאי-ספיקה של יותרת-הכליה עקב:
- דימום לתוך קליפת יותרת-הכליה.
- חדירת תסחיפים אילחיים ליותרת-הכליה.
חולים שהשתמשו זמן ממושך בסטרואידים ממקור חיצוני, וכתוצאה מכך פיתחו אטרופיה של האדרנל, כושרם לעמוד במצב ה-Stress של החבלה הוא ירוד, ולכן חבלה קלה יחסית תגרום הפרעות קשות לשיווי המשקל של הגוף.
הכאב וההיפוולמיה משפעלים את התגובה ההורמונלית:
- ההיפוולמיה מגרה את הקולטנים האפרנטיים הנמצאים בעלייה הימנית ובעורקי הקרוטיס. העצבים הללו נפגשים laterals solitary nucleus, משם הגירוי עובר ללא סינפסות ל-ceruleus ב- dorsal ponsול- tegmental raphe nuclei. מכאן הגירוי עובר ב-3 מסלולים, שאחד מהם הוא מעכב והשניים האחרים מגרים. המסלולים המגרים מסתיימים בגרעינים ב- anteroventral hypotalomus. המסלול המעכב עובר דרך ה- tract central tegmental ומסתיים בהיפותלמוס האחורי. מסלולים אלה נפגשים בהיפותלמוס הבאזלי ומפקחים על שחרור ה-CRF, המפקח על שחרור ה-ACTH.
- גירוי הכאב מתחיל ברקמות, עובר ל-substanstia gelatinosa בקרן האחורית של עמוד השדרה, ומשם הוא עובר למדולה ולפונס. מהפונס סיבים עוברים להיפותלמוס. בהיפותלמוס קיימים גרעינים ספציפיים המפקחים על שחרור ה-releasing factors, ואלה מפקחים על הפרשת ההורמונים מההיפופיזה הקדמית.
במנגנון המשוב הנורמלי עלייה ברמת הקורטיזול בדם מדכאה את הפרשת ה-ACTH. בחולים עם דמם מסיבי מנגנון המשוב הזה נפסק, וקיימת הפרשה מוגברת גם של ACTH וגם של קורטיזול, עד אשר נפח הדם חוזר לתקנו. בזמן חבלה קיימת הפרשת-יתר של קורטיזול, הגורמת לדיכוי הפרשת ה-ACTH, אולם חבלה נוספת, כמו ניתוח, גורמת לדיכוי פעולת משוב זו, ולכן על אף שנפח הדם חזר לתקנו, חבלה כפולה גורמת לעלייה של רמות ה-ACTH והקורטיזול בדם. דיכוי פעולת משוב זו יוחסה לגירויים שאינם תלויים ברמת הקורטיזול בדם והמעודדים הפרשת ACTH כמו: הפרשת-יתר של קטכולאמינים או רגישות מוגברת של ליבת יותרת-הכליה ל-ACTH. בחולים הלוקים בהיפוולמיה קשה ובאיסכמיה של יותרת-הכליה עקב פרפוזיה לקויה, לא תיראה עלייה ברמת הקורטיזול.
מצבי חבלה גורמים לירידה בהפרשת ה-17-קטוסטרואידים בשתן, כביטוי לירידה ביצירת הסטרואידים הגונדאליים. בחולים אלה, בתקופת החבלה, יש ירידה בלבידו והיעלמות הווסת. הירידה ברמת ההורמונים האנבוליים הללו מאפשרת פעילות מוגברת של ההורמונים הקטבוליים, אשר לא ניתן לשנותה על-ידי הוספת אנדרוגנים ממקור חיצוני.
אינסולין
האינסולין הוא אחד מההורמונים האנבוליים החשובים של הגוף:
- האינסולין גורם להחדרת הסוכר לתאים וניצולו.
- האינסולין נחשב כאנטיקטוגני כיוון שהוא:
- משפעל של ליפופרוטאין ליפז.
- מזרז פעילות הליפז.
- מחדיר שומנים לשריר.
- מעכב ליפוליזיס.
- האינסולין מעכב את הגלוקונאוגנזיס.
- האינסולין משמר חלבון.
בחבלה, רמות האינסולין יורדות עקב:
- ירידה בהפרשתו.
- דיכוי הנגרם על-ידי הרמות הגבוהות של הקטכולאמינים.
בעבודות שבוצעו בשנים האחרונות נמסר, שאמנם קיימת ירידה כזו, אולם היא נמשכת תקופה קצרה בלבד (שעות). לאחר מכן, רמות האינסולין עולות והתגובה תואמת את כמות הגלוקוז בנסיוב. למרות זאת החולה מתנהג כמי שרמת האינסולין שלו בנסיוב נמוכה, כלומר לחולה יש היפרגליקמיה ומטבוליזם מוגבר של שומנים. נמצא שהשפעת האינסולין על עיכוב הגלוקונאוגנזיס בכבד קטנה מאוד ולכן חולים אלה מייצרים גלוקוז מחלבון בצורה מואצת, למרות הרמות התקינות או אף הגבוהות של האינסולין בנסיוב. מתן גלוקוז מעלה את רמת האינסולין בנסיוב של החולה, אולם עלייה זו רק מקטינה את האפקט של הגלוקונאוגנזיס ואינה יכולה להפסיק את התהליך המואץ.
אלדוסטרון
בחולים לאחר חבלה קיימת עלייה ברמות האלדוסטרון. הגירוי החזק ביותר להפרשת אלדוסטרון הינו איבוד נוזלים איזוטוניים מהגוף. איבוד הנפח גורם להקטנת זרימת הדם לכליה, לירידה ב-GFR, ולהפרשת רנין. הרנין מגרה הפרשת אנגיוטנסין מהמערכת הגוקסטהגלומרולרית ומהכבד, ומגרה ישירות את קליפת יותרת- הכליה להפריש אלדוסטרון (תרשים 10.16).
גורמים מגרים נוספים להפרשת האלדוסטרון הם:
- ה-ACTH
- עלייה ברמת האשלגן בנסיוב.
- ירידה בערכי הנתרן בנסיוב.
- ירידה בנפח החוץ-תאי.
האלדוסטרון משפיע על הכליה. הוא גורם לספיגה מוגברת של נתרן וביקרבונט, ולהפרשת-יתר של מימן ואשלגן בשתן. עקב ההפרשה המוגברת של מימן בשתן יווצר שתן חומצי. ייתכן שלאלדוסטרון אפקטים פרסוריים נוספים הכוללים שינויים ישירים בשחלוף היונים בלב ובשריר החלק של כלי הדם.
וזופרסין (ADH)
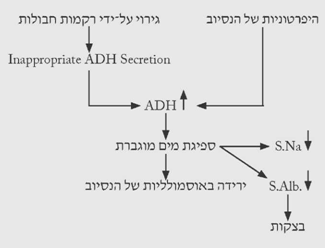
לאחר חבלה אפשר למצוא עלייה ברמת הוזופרסין בנסיוב ללא קשר לאוסמולליות הדם. בדרך כלל ההיפרטוניות של נוזלי הגוף מגרה את הפרשת הוזופרסין, המונע איבוד נוסף של נוזלים מהגוף, ועל-ידי כך מנסה לשמר את אוסמולליות הנוזלים. הגירוי החבלתי ההיקפי גורם לגירוי העצבים האפרנטיים הפועלים על ההיפותלמוס. גירוי הגרעין הסופרה-אופטי והגרעין הפרה-ונטריקולרי, גורם לשחרור הוזופרסין מההיפופיזה האחורית. בחולים נורמוטונים, המפרישים וזופרסין ביתר, נוצר מצב הנקרא inappropriate ADH secretion, הגורם לחולים אלה להפוך להיפוטוניים עם ירידה בערכי הנתרן וחלבוני הדם בנסיוב, עקב מיהול הנוצר בעקבות ספיגה מוגברת של מים בכליה. ירידה זו היא זמנית בלבד ומתקנת את עצמה (תרשים 11.16).
גלוקגון
הורמון זה מיוצר על-ידי תאי האלפא בלבלב, ורמתו בנסיוב עולה בזמן חבלה. הגלוקגון גורם לליפוליזיס על-ידי הגברת פעילות האנזימים הליפוליטיים. אנזימים אלה גורמים להידרוליזה של השומנים לחומצות שומן חופשיות ולגליצרול. העלייה בחומצות השומן החופשיות מגרה את הגלוקונאוגנזיס. הגלוקגון מגרה גם באופן ישיר את הגלוקונאוגנזיס על-ידי שפעול ה-cAMP של הפוספורילאז. כתוצאה מכך חלה עלייה ברמות הסוכר בדם. לגלוקגון גם השפעה קרדיווסקולרית, הוא מגביר את תפוקת הלב ומקטין את ההתנגדות ההיקפית.
הורמון הגדילה
בפציעות נרחבות, עם איבוד דם ונזק רקמתי, ניתן לראות עלייה ברמות הורמון הגדילה בנסיוב. הורמון זה מעלה את רמת הסוכר בדם על-ידי עיכוב פעולת האינסולין והגברת הגלוקונאוגנזיס.
תירוקסין
רמות הורמון זה אינן עולות במצבי דחק ואף יכולות, באופן מעשי, לרדת לאחר חבלה.
הפצע
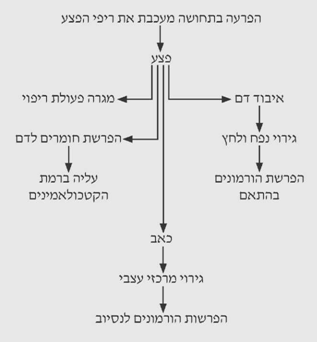
הפצע בחולה החבול מהווה למעשה את הגירוי לתחילת תהליך הריפוי. הפצע מפריש חומרים לדם, אשר מגרים הפרשת קטכולאמינים. הוא גורם לכאב, הגורם לגירוי מרכזי, הקשור להפרשת ההורמונים השונים. איבוד הדם דרך הפצע מהווה גירוי לקולטני נפח ולחץ, ולכן גורם להפרשת הורמונים המגורים על-ידי הקולטנים הללו. כל זמן שהפצע פתוח יש עיכוב של התהליכים האנבוליים בגוף וגירוי מתמשך לתהליכים הקטבוליים.
לשם ריפוי הפצע אין צורך במטבוליטים מבחוץ. הגוף מגייס חומרים לבנייה ממקורות אנדוגניים עד השגת הריפוי המלא, אולם חוזק הצלקת תלוי בקיום של מאזן חנקן חיובי. בעצמות - הריפוי שונה ומלכתחילה יש צורך במאזן חנקן חיובי. בכוויות - כל זמן שהן פתוחות מאזן החנקן של החולים שלילי; לעומת זאת כיסוי הפצעים בעור מביא לקיצור השלב הקטבולי ולזירוז השלב האנבולי.
דם המצטבר באזור הפצע, בליווי פרפוזיה ירודה ובצקת מקומית, גורמים לחמצת מקומית ולבריחת האשלגן מהתאים. בנוכחות זיהום גם הטוקסינים החיידקיים מתאספים באזור הפצע. החמצת גורמת ליצירה מוגברת של קינינים ופרוסטגלנדינים המשתחררים לצירקולציה, לאחר שיפור המצב ההמודינמי, ומתחילים את תהליך התגובה לחבלה (תרשים 12.16).
על ריפוי הפצע ראה בפרק "ריפוי פצעים".
זיהומים
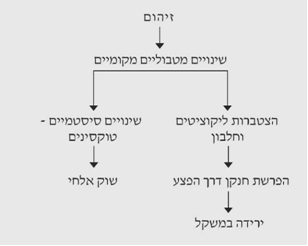
בכל חולה עם פצע פתוח יש מושבות של חיידקים מהסביבה הקרובה. גם בניתוחים נקיים אפשר למצוא חיידקים בפצע, אשר לא יתפתחו לזיהום עם סגירת הפצע. בזמן ההתיישבות של החיידקים בפצע יש מספר שינויים מטבוליים מקומיים הנגרמים עקב נזק לרקמה והצטברות הליקוציטים במקום. רק בחלק מהפצעים שבהם התיישבו חיידקים מהסביבה יתפתחו זיהומים. התפתחות הזיהום תלויה במספר החיידקים שבפצע, במידת אלימותם, במתן או אי-מתן אנטיביוטיקה מונעת, ובעוצמת החבלה הרקמתית (תרשים 13.16).
ניקוז זיהומים ומורסות ומתן אנטיביוטיקה, מורידים את התצרוכת המטבולית, ומפנים את האנרגיה לתהליכי ריפוי ובנייה.
במצבי חבלה, במיוחד אם מצב ה-stress הוא ממושך, קיימת ירידה בחסינות הגוף בפני זיהומים, עקב פגיעה במערכת החיסון הספציפית והבלתי ספציפית. הפגיעה במערכת החיסון הספציפית בולטת במיוחד במערכת הלימפוציטים מסוג T עם ירידה במספר התאים בדם, ירידה בתפקוד ה- helper cells והsupressor cells-. קיימת ירידה בכושר הבקטריוצידי והפונגוצידי, עקב תפקוד לקוי של הפולימורפונוקלארים. קיימת גם ירידה בפעולות מערכת החיסון המושהית. כל אלה חושפים את הנפגע לזיהומים ולאלח-דם.
על אלח-דם ראה פרק "הלם זיהומי".
שינויים פסיכולוגיים
השינויים הפסיכולוגיים בחולים לאחר חבלה הם רבים:
- הפחד וחוסר הבהירות ביחס לעתיד גורמים לחרדה ולשינויים מטבוליים עם עלייה ברמת ההורמונים הקטבוליים ועלייה ברמת הקטכולאמינים.
- בידוד החולה ביחידה לטיפול נמרץ, שם החולה מאבד יכולת אבחנה בין יום ללילה, ונחשף לחוסר פרטיות ורעש.
- חוסר שינה עקב כאבים, מתח נפשי או רעש, גורמים לגירוי המערכת האוטונומית ומגבירים את החרדה. חולים אלה זקוקים לתרופות מרגיעות או מרדימות.
- בידוד חברתי, במיוחד של חולים זקנים, גורם לחוסר-התמצאות, לבלבול ולשקיעה של החולה.
- הפחד מהמוות גורם לחרדה רבה ולאי-שקט נפשי.
ראו גם
- לנושא הבא: שלבי החבלה
- לתוכן העניינים של הפרק
- לתוכן העניינים של הספר
- לפרק הקודם: כירורגיה של המערכת הוורידית
- לפרק הבא: הלם
המידע שבדף זה נכתב על ידי ד"ר צבי קויפמן - מומחה בכירורגיה, מנהל היחידה לבריאות השד מרכז רפואי מאיר, כפר סבא


 כניסה
כניסה  עקבו אחרינו בפייסבוק
עקבו אחרינו בפייסבוק